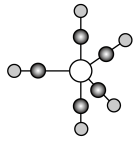
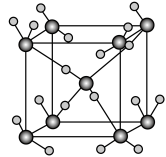
下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
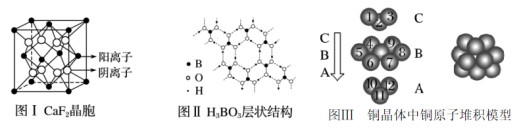
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________ ,基态Cu原子的电子排布式为___________________ 图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________ 。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________ ,H3BO3晶体中B原子个数与极性键个数比为________ 。
(3)三种晶体中熔点最低的是________ ,其晶体受热熔化时,克服的微粒之间的相互作用分别为________________ 、_________________ 、______________ 。
(4)结合CaF2晶体的晶胞示意图,已知两个距离最近的Ca2+核间距离为a×10-8cm,计算CaF2晶体的密度为____________________ 。

(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是
(3)三种晶体中熔点最低的是
(4)结合CaF2晶体的晶胞示意图,已知两个距离最近的Ca2+核间距离为a×10-8cm,计算CaF2晶体的密度为
更新时间:2021-10-21 14:26:18
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】化学选修物质结构与性质2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸。发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是_______ (填元素符号),解释原因_____________________ 。
(2)二甲基二硫和甲酸中,在水中溶解度较大的是______ (填名称),原因是__________________ ;烧碱所属的晶体类型为________ ;硫化碱(Na2S)的S2-的基态电子排布式是__________________________ 。
(3)硝酸铵中,NO3-的立体构型为_______ ,中心原子的杂化轨道类型为___________ 。
(4)1mol化合物NaCN中CN-所含的π键数为___________ ,与CN-互为等电子体的分子有_________ 。(CN)2又称为拟卤素,实验室可以用氰化钠、二氧化锰和浓硫酸在加热条件下制得,写成该制备的化学方程式____________ 。
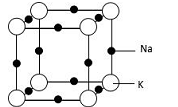
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________ ;晶胞中K 原子的配位数为___ ;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 __________________ (列出计算式,不需要计算出结果)。
回答下列问题:
(1)在组成NH4NO3、NaCN两种物质的元素中第一电离能最大的是
(2)二甲基二硫和甲酸中,在水中溶解度较大的是
(3)硝酸铵中,NO3-的立体构型为
(4)1mol化合物NaCN中CN-所含的π键数为
(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2•6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____ 。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______ ,1mol草酸分子中含有σ键的数目为______ 。
(3)与SiF4互为等电子体的阴离子的化学式为______ 。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______ 。
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______ 。

2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2•6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
(3)与SiF4互为等电子体的阴离子的化学式为
(4)CH3COOH易溶于水,除了它是极性分子外,还因为
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁、钴、镍等金属及其化合物有广泛用途。
(1)基态Ni原子共有_______ 种不同能量的电子,其成对电子数与未成对电子数之比是_______ 。
(2)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故 在酸性溶液中常发生如下水解:
在酸性溶液中常发生如下水解: (配离子)
(配离子) 。则配离子中
。则配离子中 的配位数为
的配位数为_______ ,1 mol该配离子所含σ键的数目为_______ 。(设 为阿伏加德罗常数)
为阿伏加德罗常数)
(3) 、
、 常用于陶瓷工业。已知:
常用于陶瓷工业。已知: ,则真空条件下分解温度
,则真空条件下分解温度
_______  (填“高于”“等于”或“低于”);溶液中,
(填“高于”“等于”或“低于”);溶液中, 、
、 、
、 的氧化性依次增强,请从结构上分析,其原因是
的氧化性依次增强,请从结构上分析,其原因是_______ 。
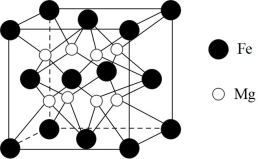
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。晶体中Fe原子和Mg原子之间的最近距离为a nm。该晶体中一个Mg与之距离最近且等距的Mg原子有_______ 个。储氢时, 分子在晶胞的体心和棱的中点位置,则晶体吸附
分子在晶胞的体心和棱的中点位置,则晶体吸附 后的化学式为
后的化学式为_______ ,理论上1dm3 Fe-Mg最多能储存
_______ kg。
(1)基态Ni原子共有
(2)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故
 在酸性溶液中常发生如下水解:
在酸性溶液中常发生如下水解: (配离子)
(配离子) 。则配离子中
。则配离子中 的配位数为
的配位数为 为阿伏加德罗常数)
为阿伏加德罗常数)(3)
 、
、 常用于陶瓷工业。已知:
常用于陶瓷工业。已知: ,则真空条件下分解温度
,则真空条件下分解温度
 (填“高于”“等于”或“低于”);溶液中,
(填“高于”“等于”或“低于”);溶液中, 、
、 、
、 的氧化性依次增强,请从结构上分析,其原因是
的氧化性依次增强,请从结构上分析,其原因是(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。晶体中Fe原子和Mg原子之间的最近距离为a nm。该晶体中一个Mg与之距离最近且等距的Mg原子有
 分子在晶胞的体心和棱的中点位置,则晶体吸附
分子在晶胞的体心和棱的中点位置,则晶体吸附 后的化学式为
后的化学式为
您最近一年使用:0次
【推荐1】已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A元素原子1s轨道只有1个电子;B元素原子第二能层的最高能级不同轨道上都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
(1)A原子的电子式:___________ 。
(2)B原子的轨道表示式:___________ 。
(3)A、B、C三种元素的电负性:___________ >___________ >___________
(4)B、C、D元素的第一电离能:___________ >___________ >___________
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、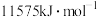 。
。
①E元素原子逐级电离能越来越大的原因:___________ 。
②这些数据说明E的最高正化合价为___________ 。
(6)关于F元素:
①位于周期表的___________ 区;
②它的价电子排布式为___________ ;
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:___________ 。
 ;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。
;D元素原子有三个能层,能量最高的能层上只有一个电子;E与D的最高能层数相同,但其价层电子数等于其电子层数;F元素的原子序数为26。请用化学用语或相关叙述按要求回答下列问题。(1)A原子的电子式:
(2)B原子的轨道表示式:
(3)A、B、C三种元素的电负性:
(4)B、C、D元素的第一电离能:
(5)已知E元素原子逐级失去电子的电离能分别为578、1817、2745、
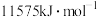 。
。①E元素原子逐级电离能越来越大的原因:
②这些数据说明E的最高正化合价为
(6)关于F元素:
①位于周期表的
②它的价电子排布式为
③气态的+3价F离子较+2价F离子再失去一个电子更难,其原因是:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B 原子核外电子s 轨道电子数是p轨道电子数的两倍;D 原子L 层上有2对成对电子;E2+原子核外有3 层电子且M层3d轨道电子半满。请回答下列问题:
(1)A元素位于周期表_____ 区,CD3-的空可构型为_____ ,中心C 原子的杂化方式为______ 。
(2)第一电离能C>D的原因是__________________ 。
(3)下列表述中能证明D元素比氟元素电负性弱这一事实的是______ 。
A.常温下氟气的颜色比D 单质的颜色深
B. 氟气与D 的氢化物剧烈反应,产生D单质
C. 氟与D形成的化合物中D元素呈正价态
D.比较两元素单质与氢气化合时得电子的数目
(4)黄血盐是一种配合物,其化学式为K4[E (CN)6] ·3H2O,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________________ 。
(5).铜能与类卤素(SCN)2反应生成Cu (SCN)2,1mol (SCN)2分子中含有σ键的数目为_____ ;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N) 的沸点低于异硫氰酸(H—N=C=S) 的沸点,其原因是______________ 。
(1)A元素位于周期表
(2)第一电离能C>D的原因是
(3)下列表述中能证明D元素比氟元素电负性弱这一事实的是
A.常温下氟气的颜色比D 单质的颜色深
B. 氟气与D 的氢化物剧烈反应,产生D单质
C. 氟与D形成的化合物中D元素呈正价态
D.比较两元素单质与氢气化合时得电子的数目
(4)黄血盐是一种配合物,其化学式为K4[E (CN)6] ·3H2O,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为
(5).铜能与类卤素(SCN)2反应生成Cu (SCN)2,1mol (SCN)2分子中含有σ键的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族。F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为__________ ,B、C、D三种元素的第一电离能从大到小的顺序为_____________ 。
(2)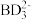 中B原子的杂化方式为
中B原子的杂化方式为__________ ,该离子的空间构型为________
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式___________ ,化合物ABC中σ键和π键数目之比为___________ ,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因___________________ 。
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为___________________ ,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为___________ cm 。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为
(2)
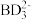 中B原子的杂化方式为
中B原子的杂化方式为(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式

(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)的基态原子M能层中能量不同的电子有___________ 种。
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是___________ (填“微粒符号”)。
(3)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为___________ ,1 mol CH2=CH2中含有的σ键数目为___________ 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是___________ 。
(4)高温超导材料,是具有高临界转变温度,能在液氮温度条件下工作的超导材料。高温超导材料钢钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为___________ 。化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显+4价。下面四种稀土元素的电离能(单位:kJ·mol-1)数据如下表,判断最有可能显+4价的稀土元素是___________ (填元素符号)
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,则PrO2(二氧化镨)的晶胞中Pr原子的配位数为___________ 。O原子与Pr原子配位数不同,影响这一结果的是离子晶体的___________ (填“几何”“电荷”或“键性”)因素。
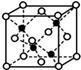
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为___________ 。
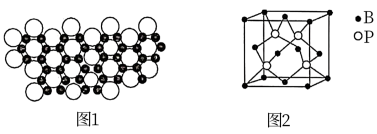
(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示,在BP晶胞中B的堆积方式为___________ ,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为___________ cm。
(1)钪(Sc)的基态原子M能层中能量不同的电子有
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是
(3)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为
(4)高温超导材料,是具有高临界转变温度,能在液氮温度条件下工作的超导材料。高温超导材料钢钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为
元素 | I1 | I2 | I3 | I4 |
Se(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(6)掺杂稀土的硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图1是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为

(7)磷化硼(BP)是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图2所示,在BP晶胞中B的堆积方式为
您最近一年使用:0次
【推荐2】A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________ ;(用元素符号表示),D元素基态原子价层电子排布式为______________________ ;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________ ;
(3)C、D形成的化合物的晶体类型为___________ ;
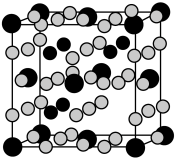
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________ 。
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。
该配合物形成配位键时提供空轨道的原子是___________ (填元素符号),该配合物中大白球代表的元素的化合价为___________ 。
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________ 个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为
(2)A、C形成的三原子分子中,C原子的杂化方式为
(3)C、D形成的化合物的晶体类型为
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:

(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。

该配合物形成配位键时提供空轨道的原子是
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硼是一种重要的非金属元素,硼的化合物在能源、化工等领域的应用十分广泛。
(1)基态硼原子的价电子排布式为________ 。
(2)乙硼烷(B2H6)可用作火箭或导弹的高能燃料,常温下为无色气体,它可用硼氢化钠(NaBH4)为原料反应制得。乙硼烷的晶体类型是_______ ,硼氢化钠中含有BH ,1个BH
,1个BH 中含有的σ键数目为
中含有的σ键数目为_______ 。
(3)硼氨烷(NH3BH3)是一种新型的储氢材料,具有超高的质量储氢密度,它的一种合成方法是:
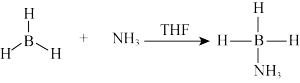
则在BH3和NH3BH3分子中B原子的杂化轨道类型分别为_______ 、_______ 。请描述硼氨烷分子中B、N原子之间的成键特征:________ 。
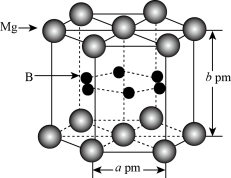
(4)硼化镁是新型超导材料,硼化镁的晶体结构如图所示,底面边长为apm,高为bpm,其中B原子的配位数是_______ ,硼化镁晶体的密度ρ=_______ g•cm-3(列出计算式即可,阿伏加德罗常数用NA表示)。
(1)基态硼原子的价电子排布式为
(2)乙硼烷(B2H6)可用作火箭或导弹的高能燃料,常温下为无色气体,它可用硼氢化钠(NaBH4)为原料反应制得。乙硼烷的晶体类型是
 ,1个BH
,1个BH 中含有的σ键数目为
中含有的σ键数目为(3)硼氨烷(NH3BH3)是一种新型的储氢材料,具有超高的质量储氢密度,它的一种合成方法是:
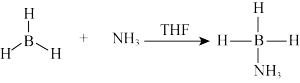
则在BH3和NH3BH3分子中B原子的杂化轨道类型分别为
(4)硼化镁是新型超导材料,硼化镁的晶体结构如图所示,底面边长为apm,高为bpm,其中B原子的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
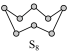
【推荐1】(1)硫及其化合物有许多用途,相关物质的物理常数如下表所示:
如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______________________________________ 。
(2)关于化合物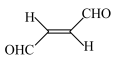 ,下列叙述正确的是
,下列叙述正确的是________ 。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2丁烯
(3)已知苯酚(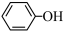 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子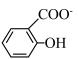 能形成分子内氢键,据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键,据此判断,相同温度下电离平衡常数Ka2(水杨酸)__________ Ka(苯酚)(填“>”或“<”),其原因是____________________ 。
(4)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_________________________ 。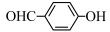 的沸点比
的沸点比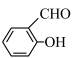 高,原因是
高,原因是__________ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(2)关于化合物
 ,下列叙述正确的是
,下列叙述正确的是A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个σ键和1个π键
D.该分子在水中的溶解度大于2丁烯
(3)已知苯酚(
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键,据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键,据此判断,相同温度下电离平衡常数Ka2(水杨酸)(4)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为
 的沸点比
的沸点比 高,原因是
高,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.2021年诺贝尔化学奖授予德国科学家Benjamin List和美国科学家David W.C.MacMillan,以表彰他们在不对称有机催化的发展方面的贡献。金属钴络合物R在有机不对称合成中起催化诱导效应,其结构简式如图1所示。

(1)络合物R中,碳原子的杂化类型为_______ 杂化;第一电离能: ,原因是
,原因是_______ 。
(2)基态 的核外电子排布式为
的核外电子排布式为_______ ;已知:CoO的熔点是1935℃,CoS的熔点是1182℃,CoO的熔点较高的原因是_______ 。
Ⅱ.铀对于核能的发展具有重要作用,沥青铀矿的晶胞结构如图2所示。

(3)该物质的化学式为_______ ,U的配位数为_______ 。
(4)以晶胞中A点U为原点建立空间直角坐标系,晶胞内B点U的坐标为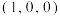 ,则晶胞内C和D氧原子的坐标分别为
,则晶胞内C和D氧原子的坐标分别为_______ 、_______ 。
(5)已知:铀原子半径为anm,氧原子半径为bnm,晶胞参数为0.5nm,阿伏加德罗常数的值为 。该晶胞中原子的空间占有率为
。该晶胞中原子的空间占有率为_______ (列出计算式即可,下同),该晶体的密度为_______  。
。

(1)络合物R中,碳原子的杂化类型为
 ,原因是
,原因是(2)基态
 的核外电子排布式为
的核外电子排布式为Ⅱ.铀对于核能的发展具有重要作用,沥青铀矿的晶胞结构如图2所示。

(3)该物质的化学式为
(4)以晶胞中A点U为原点建立空间直角坐标系,晶胞内B点U的坐标为
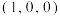 ,则晶胞内C和D氧原子的坐标分别为
,则晶胞内C和D氧原子的坐标分别为(5)已知:铀原子半径为anm,氧原子半径为bnm,晶胞参数为0.5nm,阿伏加德罗常数的值为
 。该晶胞中原子的空间占有率为
。该晶胞中原子的空间占有率为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
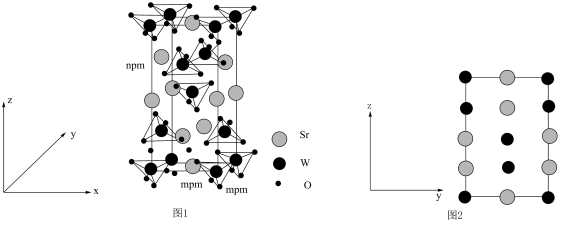
【推荐3】钨酸锶是一种功能性材料,在光致发光、发光二极管、闪质子交换膜烁材料、磁性材料、湿度传感器和催化剂等领域有着广泛的应用,从而备受人们关注,其晶胞结构如图1所示,晶胞棱边夹角均为90°,Sr原子和W原子沿x轴投影如图2所示。
(1)基态氧原子最高能级理论上具有的轨道数为___________ ,原子中运动的电子有两种相反的自旋状态,若有一种自旋状态用 表示,则与之相反的用
表示,则与之相反的用 表示,
表示,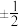 称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为
称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为___________ 。
(2)Sr的原子序数为38,其位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区,SrO的熔点比MgO___________ (填“高”或“低”),原因是___________ 。
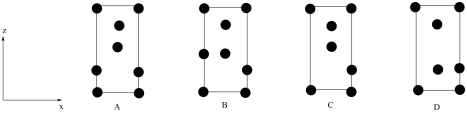
(3)钨酸锶的化学式为___________ ,晶胞中W原子沿y轴投影所形成的投影图为___________ (填标号),设 为阿佛加德罗常数的值,则该晶体的密度为
为阿佛加德罗常数的值,则该晶体的密度为___________ g·cm-3。

(1)基态氧原子最高能级理论上具有的轨道数为
 表示,则与之相反的用
表示,则与之相反的用 表示,
表示,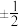 称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为
称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为(2)Sr的原子序数为38,其位于元素周期表的
(3)钨酸锶的化学式为
 为阿佛加德罗常数的值,则该晶体的密度为
为阿佛加德罗常数的值,则该晶体的密度为
您最近一年使用:0次



