在恒容密闭容器中充入一定量的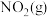 和
和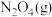 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,

下列说法错误的是
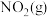 和
和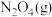 ,发生反应N2O4(g)⇌2NO2(g)
,发生反应N2O4(g)⇌2NO2(g)  ,体系中各物质的百分含量与温度的变化关系如图所示,
,体系中各物质的百分含量与温度的变化关系如图所示,
下列说法错误的是
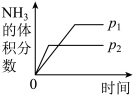
A.曲线①表示 的百分含量 的百分含量 |
B. 的键能总和大于 的键能总和大于 的键能总和 的键能总和 |
C.若 点为反应平衡点,此时平衡常数 点为反应平衡点,此时平衡常数 |
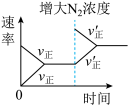
| D.反应达到平衡后,往该容器中充入少量N2O4,N2O4转化率减小 |
更新时间:2021-11-03 17:36:04
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
| A.吸收183kJ | B.吸收366kJ | C.放出366kJ | D.放出183kJ |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
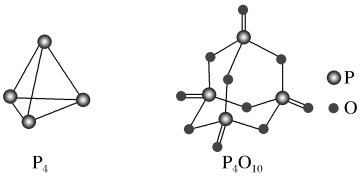
【推荐2】下表是部分化学键的键能数据:
已知白磷燃烧的热化学方程式为 ,白磷和白磷完全燃烧的产物
,白磷和白磷完全燃烧的产物 的结构如图所示,则表中x为
的结构如图所示,则表中x为
| 化学键 |  |  |  |  |
键能/( ) ) | 200 | x | 498 | 434 |
 ,白磷和白磷完全燃烧的产物
,白磷和白磷完全燃烧的产物 的结构如图所示,则表中x为
的结构如图所示,则表中x为
A. | B. | C. | D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】如图为PCl5(g) PCl3(g)+Cl2(g)(正反应为吸热反应).从平衡状态I移动到平衡状态II的反应速率(v)与时间(t)的曲线,此图表示的变化是
PCl3(g)+Cl2(g)(正反应为吸热反应).从平衡状态I移动到平衡状态II的反应速率(v)与时间(t)的曲线,此图表示的变化是
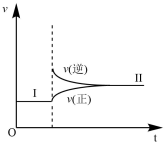
 PCl3(g)+Cl2(g)(正反应为吸热反应).从平衡状态I移动到平衡状态II的反应速率(v)与时间(t)的曲线,此图表示的变化是
PCl3(g)+Cl2(g)(正反应为吸热反应).从平衡状态I移动到平衡状态II的反应速率(v)与时间(t)的曲线,此图表示的变化是 
| A.升温 | B.增压 | C.增加PCl3的量 | D.增加PCl5的量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是
A.A(s)+B(g) C(g)+D(g) ΔH>0 C(g)+D(g) ΔH>0 |
B.A2(g)+3B2(g) 2AB3(g) ΔH<0 2AB3(g) ΔH<0 |
C.2AB(g) A2(s)+B2(g) ΔH>0 A2(s)+B2(g) ΔH>0 |
D.2A(g)+B(g) 3C(g)+D(s) ΔH<0 3C(g)+D(s) ΔH<0 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】已知下列反应的平衡常数: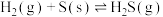

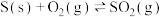
 ,则反应
,则反应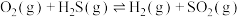 的平衡常数为
的平衡常数为
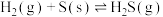

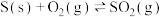
 ,则反应
,则反应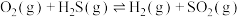 的平衡常数为
的平衡常数为A. | B. | C.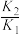 | D.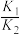 |
您最近一年使用:0次
单选题
|
较易
(0.85)
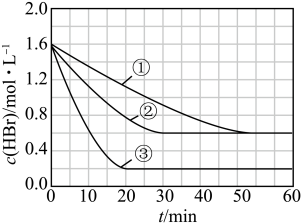
【推荐2】密闭容器中加入 ,一定条件下发生反应:
,一定条件下发生反应: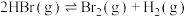 ,
, 随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法错误的是
随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法错误的是
 ,一定条件下发生反应:
,一定条件下发生反应: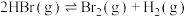 ,
, 随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法错误的是
随反应时间的变化如曲线①所示,分别改变一个条件,得到曲线②和③,下列说法错误的是
| A.该反应正反应为吸热反应 |
B.曲线①,0~50min用 表示的平均反应速率为 表示的平均反应速率为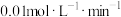 |
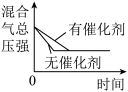
| C.曲线②,可能使用了催化剂或压缩容器体积 |
D.曲线③,达到平衡后,容器内各物质的浓度分别增加 ,平衡正向移动 ,平衡正向移动 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
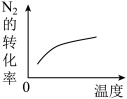
【推荐1】在一定条件下,对于反应 ,物质 C 的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是
,物质 C 的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是
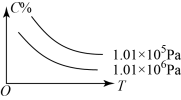
 ,物质 C 的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是
,物质 C 的体积分数(C%)与温度、压强的关系如图所示,下列判断正确的是 
A. | B. |
C. | D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】T℃在 2 L 密闭容器中使 X(g)与 Y(g)发生反应生成 Z(g).反应过程中 X、Y、Z 的物质的量变化如图 1 所示;若保持其他条件不变,温度分别为 T1和 T2,Y 的体积百分含量与时间的关系如图 2 所示.下列分析正确的是
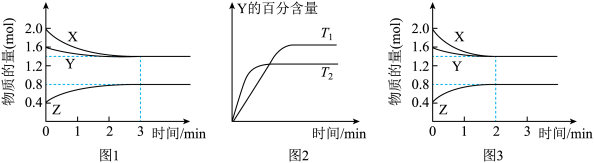

| A.容器中发生的反应可表示为:3X(g)+Y(g)⇌Z(g) |
B.图 1 中 0~3min 内, (X)=0.2 mol•L-1•min-1 (X)=0.2 mol•L-1•min-1 |
C.其他条件不变,升高温度,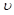 正、 正、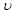 逆都增大,且达到新平衡前 逆都增大,且达到新平衡前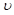 正> 正> 逆 逆 |
| D.若改变条件,使反应进程如图 3 所示,则改变的条件可能是增大压强 |
您最近一年使用:0次

 )。下表列出了部分键能的数据,试计算
)。下表列出了部分键能的数据,试计算 的
的 是
是


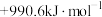
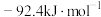
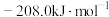
 ,发生反应
,发生反应
 。经过一段时间后达到平衡,测得反应过程中部分数据如下表所示。
。经过一段时间后达到平衡,测得反应过程中部分数据如下表所示。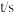


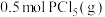 ,则平衡时
,则平衡时
 2NH3(g)△H<0,下列图像正确的是
2NH3(g)△H<0,下列图像正确的是