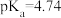常温下,用pH仪测定0.10mol•L-1NaOH溶液滴定某20mL的一元酸HA溶液过程中pH的变化,如图所示,图中c(20,>7)点为滴定终点,忽略溶液混合时体积的变化。则下列有关说法正确的是
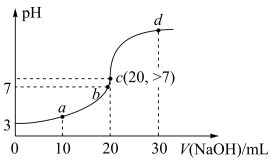

| A.HA为弱酸,Ka≈1.0×10—6 |
| B.a点时:c(A—)+c(HA)=0.10mol•L-1 |
| C.a、b、c三个点,c(HA)+c(A—)+c(Na+)相等 |
| D.d点时:2c(OH—)—c(A—)=2c(H+)+2c(HA) |
更新时间:2021-11-15 14:01:10
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】常温下,向 溶液(不考虑空气的影响)中缓慢通入
溶液(不考虑空气的影响)中缓慢通入 ,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入
,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入 的物质的量之间的变化曲线如图所示。下列说法错误的是。(不考虑与
的物质的量之间的变化曲线如图所示。下列说法错误的是。(不考虑与 发生的其他反应)
发生的其他反应)
已知:常温下,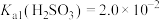 ,
, 。
。
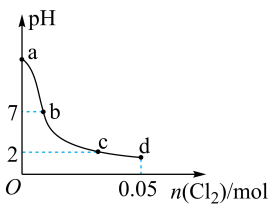
 溶液(不考虑空气的影响)中缓慢通入
溶液(不考虑空气的影响)中缓慢通入 ,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入
,整个过程中无气体逸出,忽略溶液中体积和温度的变化,测得溶液的pH与通入 的物质的量之间的变化曲线如图所示。下列说法错误的是。(不考虑与
的物质的量之间的变化曲线如图所示。下列说法错误的是。(不考虑与 发生的其他反应)
发生的其他反应)已知:常温下,
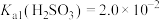 ,
, 。
。
A.a点溶液中,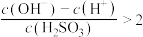 |
B.b点溶液中,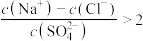 |
C.c点溶液中,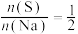 |
D.d点溶液中,水电离出的 和水电离出的 和水电离出的 之积为 之积为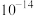 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系不正确的是( )
| A.向0.10mol·L-1NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+2c(CO32-) |
| B.向0.10mol·L-1NaHSO3溶液中通NH3:c(NH4+)+c(H2SO3)=c(SO32-) |
| C.向0.10mol·L-1Na2SO3溶液中通SO2:c(Na+)=2[c(HSO3-)+c(SO32-)+c(H2SO3)] |
| D.向0.10mol·L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】常温下,向10mL H2A溶液中滴加0.1mol/L NaOH溶液.有关微粒的物质的量变化如图.根据图示判断,下列说法不正确的是


| A.H2A是二元弱酸 |
| B.当0 mL<V(NaOH)<20 mL时,一定有:c(OH﹣)+c(HA﹣)+2c(A2﹣)=c(Na+)+c(H+) |
| C.当V(NaOH)=10 mL时,溶液中离子浓度关系一定有:c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣) |
| D.当V(NaOH)=20 mL后,再向溶液中加水稀释,c(H+)减小,c(OH﹣)也减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,将体积为 的
的 溶液与体积为
溶液与体积为 的
的 溶液混合(无
溶液混合(无 生成),已知
生成),已知 ,
, 。下列说法正确的是
。下列说法正确的是
 的
的 溶液与体积为
溶液与体积为 的
的 溶液混合(无
溶液混合(无 生成),已知
生成),已知 ,
, 。下列说法正确的是
。下列说法正确的是A. 时, 时, |
B. 时,混合液中: 时,混合液中: |
C. 时,混合液中碳元素多以 时,混合液中碳元素多以 形式存在 形式存在 |
D. 时,混合液中: 时,混合液中: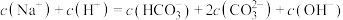 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】常温时,磷酸型体分布优势区域图如下图所示(虚线处表示两种型体浓度相等)。下列有关说法错误的是


A. 溶液中由水电离出的 溶液中由水电离出的 |
B.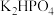 溶液中存在: 溶液中存在: |
C.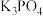 溶液中存在: 溶液中存在: |
D.0.1 的 的 溶液加水稀释,稀释过程中 溶液加水稀释,稀释过程中 比值不变 比值不变 |
您最近一年使用:0次

 ,实验测得溶液中
,实验测得溶液中 、
、 的分布系数
的分布系数 与
与 。下列说法错误的是
。下列说法错误的是