回答下列问题:
(1)Ⅰ.已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g)△H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式___________ 。
Ⅱ.水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(2)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192.根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO___________ H2(填“大于”或“小于”)。
(3)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为___________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(1)Ⅰ.已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g)△H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式
Ⅱ.水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(2)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721 ℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192.根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO
(3)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为___________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
更新时间:2021-12-24 13:02:06
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】SO2 、CO 、NOx 是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101kPa时:
2SO2(g) + O2(g) 2SO3(g) △H1=" -" 197 kJ•mol-1
2SO3(g) △H1=" -" 197 kJ•mol-1
H2O(g) = H2O(l) △H2=" -" 44 kJ•mol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3=" -" 545 kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是________________________________ ;
(2)若反应2H2(g)+ O2 (g)═ 2H2O(g ),△H=-241.8kJ•mol-1。根据下表数据, 则x="______ " kJ•mol-1;
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H="-90" kJ•mol-1。某温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
CH3OH(g) △H="-90" kJ•mol-1。某温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
则 c1_________ c2(填“>”或“<”或“=”) , a=____________ ;
(4)氮氧化物都是常见的大气污染物,某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g) 2ClNO(g) △H1< 0 其平衡常数为K1
2ClNO(g) △H1< 0 其平衡常数为K1
ii. 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
①现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=____ (用K1、K2表示);
②为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则10min内υ(ClNO) =___________ ,平衡常数K2=____________ ;若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:α1(NO2)________ α2(NO2)(填“>”“<”或“=”)。
③工业上利用氨还原法除去氮氧化合物,生成两种对环境友好的物质。请以氮氧化合物的通式NOX写出化学方程式:______________________ 。
(1)已知25℃、101kPa时:
2SO2(g) + O2(g)
 2SO3(g) △H1=" -" 197 kJ•mol-1
2SO3(g) △H1=" -" 197 kJ•mol-1H2O(g) = H2O(l) △H2=" -" 44 kJ•mol-1
2SO2(g) + O2(g) + 2H2O(g) = 2H2SO4(l) △H3=" -" 545 kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是
(2)若反应2H2(g)+ O2 (g)═ 2H2O(g ),△H=-241.8kJ•mol-1。根据下表数据, 则x="
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
(3)甲醇汽油也是一种新能源清洁燃料。工业上可用CO和H2制取甲醇,热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) △H="-90" kJ•mol-1。某温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:
CH3OH(g) △H="-90" kJ•mol-1。某温度下,在两个容积均为1 L的密闭容器中,分别发生该反应:| 容器 | 甲 | 乙 |
| 反应物投入量 | 1 mol CO (g)和2 mol H2(g) | 1 mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
则 c1
(4)氮氧化物都是常见的大气污染物,某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i. 2NO(g)+Cl2(g)
 2ClNO(g) △H1< 0 其平衡常数为K1
2ClNO(g) △H1< 0 其平衡常数为K1ii. 2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2①现有反应4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=
2NaNO3(s)+2NO(g)+Cl2(g), 则此反应的平衡常数K3=②为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则10min内υ(ClNO) =
③工业上利用氨还原法除去氮氧化合物,生成两种对环境友好的物质。请以氮氧化合物的通式NOX写出化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
②2Al(s)+ O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
Al和FeO发生铝热反应的热化学方程式是______________________ 。某同学认为,铝热反应可用于工业炼铁,你的判断是________ (填“能”或“不能”),你的理由是________________________ 。
 O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;
O2(g)=FeO(s) ΔH1=-272.0 kJ/mol;②2Al(s)+
 O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。
O2(g)=Al2O3(s) ΔH2=-1 675.7 kJ/mol。Al和FeO发生铝热反应的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】写出下列反应的热化学方程式:
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是___________ 。
(2)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
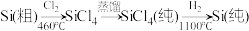
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___________ 。
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成lmolAX5,放出热量123.8kJ。该反应的热化学方程式为___________ 。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是
(2)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
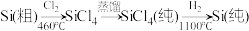
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成lmolAX5,放出热量123.8kJ。该反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:

根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为_______ mol/(L·min)。
(2)在实验2,A的初始浓度c2=_______ mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_______ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______ v1(填>、=、<),且c3_______ 1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_______ 反应(选填吸热、放热)。理由是_______ 。
 B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内A的平均速率为
(2)在实验2,A的初始浓度c2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
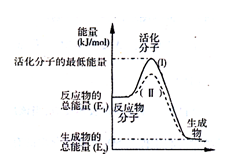
【推荐2】已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K=______________ 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q_____ 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是______ 曲线。
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
从表中数据分析,该实验的目的是___________________________________________ ;
表中显色时间t1=_____ s;最终得出的结论是__________________________________ 。
 I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q(1)写出反应的平衡常数表达式:K=
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q

(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
从表中数据分析,该实验的目的是
表中显色时间t1=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g) CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________ (用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________ (填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________ (填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________ (填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
(1)在—定温度和压强下,CO(g)+2H2(g)
 CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(2)判断该反应达到平衡状态的依据是
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】一定条件下,CH4与CO2反应可制备CH3COOH,反应的热化学方程式为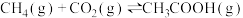 ,
,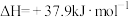 。回答下列问题:
。回答下列问题:
(1)若上述反应在恒容密闭容器中进行,则下列情况能说明反应已经达到平衡状态的是___________(填字母,下同)。
(2)下列措施既能提高CH4的平衡转化率又能加快反应速率的是___________。
(3)T1℃时催化剂作用下,将体积比为1:1的CH4与CO2混合气体充入恒容密闭容器中反应生成CH3COOH(g),每隔一定时间测得容器内气体压强如表所示:
①已知: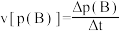 。反应开始10 min内,用CH4的压强变化表示该反应的平均反应速率为
。反应开始10 min内,用CH4的压强变化表示该反应的平均反应速率为___________  。
。
② ℃时,反应的平衡常数Kp=
℃时,反应的平衡常数Kp=___________  (Kp为用各气体分压表示的平衡常数,分压
(Kp为用各气体分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。
(4)用Co作催化剂,可使反应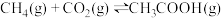 在较温和条件下进行,反应历程如图:
在较温和条件下进行,反应历程如图:
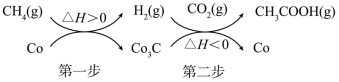
①第二步反应的化学方程式为___________ 。
②为增大CH3COOH的平衡产率:从温度角度考虑,第一步反应在高温下进行,第二步反应在___________ 进行;从H2浓度的角度考虑,第二步应采取的措施是___________ 。
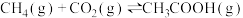 ,
,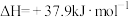 。回答下列问题:
。回答下列问题:(1)若上述反应在恒容密闭容器中进行,则下列情况能说明反应已经达到平衡状态的是___________(填字母,下同)。
| A.容器内气体密度保持不变 | B.CO2的体积分数保持不变 |
| C.该反应的平衡常数保持不变 | D.混合气体的平均相对分子质量不变 |
| A.升高温度 | B.使用高效催化剂 |
| C.加入CH4 | D.扩大容器体积 |
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 压强/kPa | 2 | 1.5 | 1.3 | 1.2 | 1.2 | 1.2 |
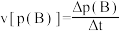 。反应开始10 min内,用CH4的压强变化表示该反应的平均反应速率为
。反应开始10 min内,用CH4的压强变化表示该反应的平均反应速率为 。
。②
 ℃时,反应的平衡常数Kp=
℃时,反应的平衡常数Kp= (Kp为用各气体分压表示的平衡常数,分压
(Kp为用各气体分压表示的平衡常数,分压 总压
总压 物质的量分数)。
物质的量分数)。(4)用Co作催化剂,可使反应
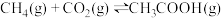 在较温和条件下进行,反应历程如图:
在较温和条件下进行,反应历程如图:
①第二步反应的化学方程式为
②为增大CH3COOH的平衡产率:从温度角度考虑,第一步反应在高温下进行,第二步反应在
您最近一年使用:0次
【推荐2】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______ ,离子方程式____________________________ 。
(2) 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
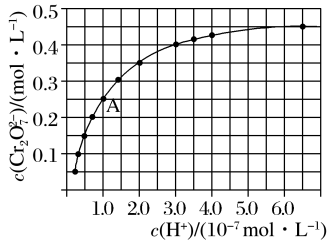
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________ 。
②由图可知,溶液酸性增大, 的平衡转化率
的平衡转化率_________ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________ 。
③升高温度,溶液中 的平衡转化率减小,则该反应的ΔH
的平衡转化率减小,则该反应的ΔH_____ 0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)___ mol⋅L−1,此时溶液中c( )等于
)等于_____ mol⋅L−1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
(2)
 和
和 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c( )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
①当溶液酸性增强的时候,溶液颜色变化情况为:
②由图可知,溶液酸性增大,
 的平衡转化率
的平衡转化率③升高温度,溶液中
 的平衡转化率减小,则该反应的ΔH
的平衡转化率减小,则该反应的ΔH(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+)
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol⋅L−1)时,溶液中c(Ag+) )等于
)等于
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)向碘水中加入四氯化碳后充分振荡,静置后的现象是__ 。
(2)①已知反应H2(g)+I2(g)=2HI(g),该反应中相关化学键的键能数据如表所示:
则该反应的ΔH=___ kJ·mol−1。
②下列叙述能说明上述反应已达到平衡的是___ 。
a.单位时间内生成nmolH2,同时生成nmolHI
b.温度和体积一定时,HI浓度不再变化
c.温度和体积一定时,混合气体颜色不再变化
d.温度和压强一定时,混合气体的密度不再变化
(3)NaHSO3溶液在不同温度下均可被过量KIO3(IO 被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:__ 。依据I2析出所需时间可以求得NaHSO3的反应速率,将浓度均为0.020mol·L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。
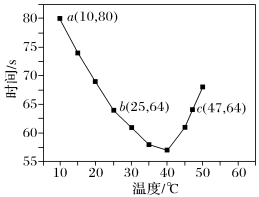
图中a点对应的NaHSO3反应速率为__ mol·L-1·s-1。b、c两点对应的NaHSO3反应速率v(b)__ v(c)(填“>”、“=”、“<”)。
(4)在1L真空密闭容器中加入amolNH4I固体,t℃时发生如下反应:
NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=__ mol,t℃时反应①的平衡常数K值为__ (用字母表示)。
(1)向碘水中加入四氯化碳后充分振荡,静置后的现象是
(2)①已知反应H2(g)+I2(g)=2HI(g),该反应中相关化学键的键能数据如表所示:
| 共价键 | H-H | I-I | H-I |
| 键能/kJ·mol−1 | 436 | 151 | 299 |
则该反应的ΔH=
②下列叙述能说明上述反应已达到平衡的是
a.单位时间内生成nmolH2,同时生成nmolHI
b.温度和体积一定时,HI浓度不再变化
c.温度和体积一定时,混合气体颜色不再变化
d.温度和压强一定时,混合气体的密度不再变化
(3)NaHSO3溶液在不同温度下均可被过量KIO3(IO
 被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
被还原成I-)氧化,当NaHSO3完全消耗即有I2析出,写出I2析出时发生反应的离子方程式:
图中a点对应的NaHSO3反应速率为
(4)在1L真空密闭容器中加入amolNH4I固体,t℃时发生如下反应:
NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=
您最近一年使用:0次



