某温度下25mL含KCl和KCN的溶液,用0.1000mol·L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示,曲线上的转折点即为化学计量点。
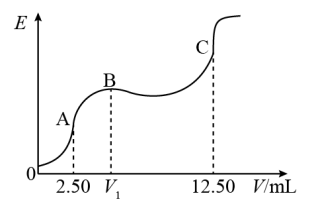
已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是

已知:I、Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-、②[Ag(CN)2]-+Ag+=2AgCN↓
II、该温度时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
下列说法不正确的是
| A.V1=5.00,B点时生成AgCN |
| B.c(KCN)=0.02000mol·L-1,c(KCl)=0.03000mol·L-1 |
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1×K2=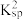 (AgCN) (AgCN) |
D.C点时,溶液中 =106 =106 |
21-22高三上·福建福州·阶段练习 查看更多[4]
福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)专题19 沉淀溶解平衡的图像问题分析-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专题12 电解质溶液中的四大平衡常数(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练
更新时间:2021-12-31 23:04:19
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列有关沉淀溶解平衡的说法正确的是
A.向 饱和溶液中加水, 饱和溶液中加水, 的溶解度和 的溶解度和 均增大 均增大 |
B.将饱和 溶液加入到饱和石灰水中,有白色沉淀产生,说明 溶液加入到饱和石灰水中,有白色沉淀产生,说明 大于 大于 |
C. 难溶于水,溶液中不存在 难溶于水,溶液中不存在 和 和 |
D.已知 时 时 ,在 ,在 溶液中加入氨水调混合液的 溶液中加入氨水调混合液的 ,产生沉淀,则此时溶液中的 ,产生沉淀,则此时溶液中的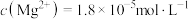 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温下,向20mL含有0.10mol/LCr2+和0.10mol/LFe2+的混合溶液中滴加0.10mol/LNaOH溶液,金属阳离子的浓度与滴入NaOH溶液体积的关系如图所示。若溶液中金属阳离子浓度小于10-5mol/L可视为完全沉淀,则下列说法错误的是( )

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3

已知:Ksp[Cr(OH)2]=2.0×10-16mol3/L3,Ksp[Fe(OH)2]=8.0×10-16mol3/L3
| A.曲线A表示c(Fe2+)与NaOH溶液体积的关系 |
| B.当V(NaOH溶液)=30mL时,Cr2+开始沉淀 |
| C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀 |
| D.当V(NaOH溶液)>30mL时,溶液中c(Fe2+):c(Cr2+)=4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列说法正确的是
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水b.0.1mol·L-1盐酸、c.0.1mol·L-1氯化镁溶液d.0.1mol·L-1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol·L-1),至中性时,溶液中的酸未被完全中和
⑤将水加热到100℃,pH=6:c(OH)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmol·L-1的硫酸铵溶液中:c( )> c(
)> c( )> c(H+)
)> c(H+)
⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水b.0.1mol·L-1盐酸、c.0.1mol·L-1氯化镁溶液d.0.1mol·L-1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol·L-1),至中性时,溶液中的酸未被完全中和
⑤将水加热到100℃,pH=6:c(OH)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmol·L-1的硫酸铵溶液中:c(
 )> c(
)> c( )> c(H+)
)> c(H+)⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
| A.③⑤ | B.①⑧ | C.④⑦ | D.②⑥ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某温度下,向10 mL 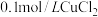 溶液中滴加
溶液中滴加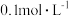 的
的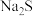 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中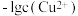 与
与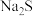 溶液体积(V)的关系如图所示,下列说法正确的是已知:
溶液体积(V)的关系如图所示,下列说法正确的是已知: 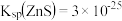 。
。

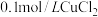 溶液中滴加
溶液中滴加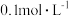 的
的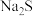 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中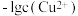 与
与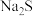 溶液体积(V)的关系如图所示,下列说法正确的是已知:
溶液体积(V)的关系如图所示,下列说法正确的是已知: 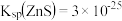 。
。
A.该温度下  |
| B.X、Y、Z三点中,Y点水的电离程度最小 |
C.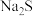 溶液中: 溶液中: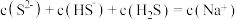 |
D.向100 mL 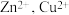 浓度均为 浓度均为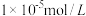 的混合溶液中逐滴加入 的混合溶液中逐滴加入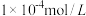 的 的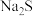 溶液, 溶液,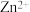 先沉淀 先沉淀 |
您最近一年使用:0次
【推荐2】一定温度下,向含 、
、 、
、 、
、 4种金属离子(
4种金属离子( )的溶液中滴加
)的溶液中滴加 溶液,生成硫化物沉淀所需
溶液,生成硫化物沉淀所需 浓度的对数值
浓度的对数值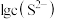 与
与 的关系如图所示。下列判断错误的是
的关系如图所示。下列判断错误的是
 、
、 、
、 、
、 4种金属离子(
4种金属离子( )的溶液中滴加
)的溶液中滴加 溶液,生成硫化物沉淀所需
溶液,生成硫化物沉淀所需 浓度的对数值
浓度的对数值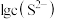 与
与 的关系如图所示。下列判断错误的是
的关系如图所示。下列判断错误的是
A. |
B.向含等物质的量浓度的 、 、 的稀溶液中滴加 的稀溶液中滴加 溶液, 溶液, 先沉淀 先沉淀 |
| C.该温度下,a点相对于ZnS是过饱和溶液 |
D.该温度下,溶解度: |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列化学用语对事实的表述错误的是
| A.Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓ |
| B.乙烯的燃烧热是1411.3 kJ·mol-1,则乙烯燃烧的热化学方程式为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1411.3kJ·mol-1 |
| C.P(s,白磷)=P(s,红磷) ΔH=-17.6kJ·mol-1由此推知,红磷比白磷更稳定 |
| D.闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(Cus):ZnS(s)+Cu2+(aq)⇌CuS(s)+Zn2+(aq) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】硫化汞(HgS)是一种难溶于水的红色颜料,其在水中的沉淀溶解平衡曲线如图所示(已知: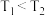 ),下列关于沉淀溶解平衡的说法错误的是
),下列关于沉淀溶解平衡的说法错误的是

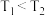 ),下列关于沉淀溶解平衡的说法错误的是
),下列关于沉淀溶解平衡的说法错误的是
A.图中a点对应的是 温度下HgS的不饱和溶液 温度下HgS的不饱和溶液 |
B.图中p、q点对应的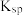 的关系为 的关系为 |
C.向m点对应的溶液中加入少量 固体,HgS的Ksp减小 固体,HgS的Ksp减小 |
| D.升高温度,溶度积增大,可实现由p点向q点的移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,用氢氟酸或氢氧化钠溶液调节 、
、 沉淀共存体系中溶液的pH,溶液中粒子浓度
沉淀共存体系中溶液的pH,溶液中粒子浓度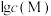 与pH的关系如图所示(其中M代表
与pH的关系如图所示(其中M代表 或
或 )。下列说法正确的是
)。下列说法正确的是
 、
、 沉淀共存体系中溶液的pH,溶液中粒子浓度
沉淀共存体系中溶液的pH,溶液中粒子浓度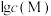 与pH的关系如图所示(其中M代表
与pH的关系如图所示(其中M代表 或
或 )。下列说法正确的是
)。下列说法正确的是
A. 表示 表示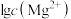 与pH的关系 与pH的关系 |
B.常温下溶度积常数: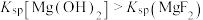 |
C.Q点对应状态下有 沉淀生成 沉淀生成 |
D.pH在8~13之间,溶液中均存在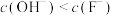 |
您最近一年使用:0次
【推荐3】下列实验操作、现象和结论都正确的是
| 实验操作 | 现象 | 结论 | |
| A | 其他条件不变,将NO2气体压缩至原体积的一半 | NO2气体颜色逐渐变到比压缩前还浅 | 增大压强,平衡向体积缩小的方向移动 |
| B | 将收集满Cl2的集气瓶A口朝上,装满N2的集气瓶B口朝下对准A,移走玻璃片 | 一段时间后集气瓶AB均出现黄绿色 | 该实验中熵增的方向是自发进行的 |
| C | 在稀硫酸中加入少量的红色Cu2O粉末 | 产生蓝色溶液和红色固体 | Cu2O在该反应中没有体现还原性 |
| D | 在含S2-和 的溶液中滴加 的溶液中滴加 溶液 溶液 | 先生成黑色沉淀,后生成白色沉淀 | 溶度积: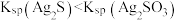 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
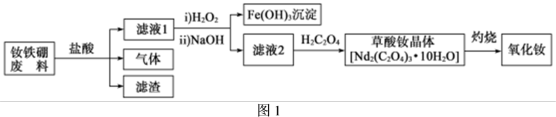
【推荐1】稀土永磁材料——高性能钕铁硼合金为新能源汽车提供核心原材料。从制钕铁硼的废料中提取氧化钕(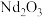 )的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。
)的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。

已知:常温下 ,
, ,下列说法错误的是
,下列说法错误的是
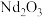 )的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。
)的工艺流程如图1所示,草酸钕晶体的热重曲线如图2所示。

已知:常温下
 ,
, ,下列说法错误的是
,下列说法错误的是| A.气体的主要成分是H2,滤渣是硼和其他不溶性杂质 |
| B.往滤液1中加入H2O2的目的是将Fe2+氧化为Fe3+,且温度越高反应速率越快 |
| C.常温下,加入氢氧化钠溶液pH=4时,Fe3+已沉淀完全 |
| D.由图2可知,500℃时剩余固体的主要成分是Nd2O2CO3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】碳酸锰是制造电信器材软磁铁氧体、合成二氧化锰和制造其他锰盐的原料。室温下,用含少量 的
的 溶液制备
溶液制备 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是

 的
的 溶液制备
溶液制备 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是
A.在 溶液中: 溶液中: |
B.“除钙”得到的上层清液中: |
C.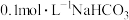 溶液中: 溶液中: |
D.“沉锰”反应的离子方程式: |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】室温下,通过下列实验探究NH4HCO3溶液的性质。
下列有关说法正确的是
| 实验 | 实验操作 |
| 1 | 用pH试纸测定0.1 mol·L-1 NH4HCO3溶液的pH,测得pH约为8 |
| 2 | 将浓度均为0.1 mol·L-1 NH4HCO3溶液和Ba(OH)2溶液等体积混合,产生白色沉淀和刺激性气味的气体 |
| 3 | 将等体积1 mol·L-1 NH4HCO3与NaCl溶液混合,析出晶体 |
| 4 | 向0.1 mol·L-1 NH4HCO3溶液中滴加0.1 mol·L-1 AlCl3溶液,产生白色沉淀,溢出无色气体 |
A.实验1溶液中存在c(NH )>c(HCO )>c(HCO )>c(CO )>c(CO ) ) |
| B.根据实验2的现象可以得出Ksp(BaCO3)=2.5×10-3 |
C.实验3静置后的上层清液中有c(NH3·H2O)+c(NH )=c(HCO )=c(HCO )+c(CO )+c(CO )+c(H2CO3) )+c(H2CO3) |
| D.实验4中产生的气体是CO2和NH3混合气体 |
您最近一年使用:0次



