KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:
a.软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;
b.溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;
c.滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
测定KMnO4产品的纯度可用标准Na2S2O3溶液进行测定。
(1)写出a的化学方程式_______ 。
(2)写出b的离子方程式_______ 。
(3)配制250mL0.1000 mol∙L−1标准Na2S2O3溶液:
①用托盘天平称取_______ g硫代硫酸钠固体样品,将其在_______ 中用新煮沸并冷却的蒸馏水溶解,完全溶解后,全部转移至_______ 中,加蒸馏水至溶液的凹液面最低处与刻度线相切。
②若配制中未洗涤烧杯及玻璃棒,则溶液浓度_______ (填“偏大”、“偏小”或“无影响”,下同),若定容时仰视刻度线,则溶液浓度_______ 。
(4)测定KMnO4产品的纯度:取3份0.6000g上述制得的KMnO4产品,酸化后分别用0.100 mol∙L−1标准Na2S2O3溶液进行反应,有关离子方程式为 。记录所消耗Na2S2O3溶液的体积为:
。记录所消耗Na2S2O3溶液的体积为:
计算该KMnO4产品的纯度为_______ 。(保留小数点后两位)
a.软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;
b.溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;
c.滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
测定KMnO4产品的纯度可用标准Na2S2O3溶液进行测定。
(1)写出a的化学方程式
(2)写出b的离子方程式
(3)配制250mL0.1000 mol∙L−1标准Na2S2O3溶液:
①用托盘天平称取
②若配制中未洗涤烧杯及玻璃棒,则溶液浓度
(4)测定KMnO4产品的纯度:取3份0.6000g上述制得的KMnO4产品,酸化后分别用0.100 mol∙L−1标准Na2S2O3溶液进行反应,有关离子方程式为
 。记录所消耗Na2S2O3溶液的体积为:
。记录所消耗Na2S2O3溶液的体积为:| 测定次数 | 第1次 | 第2次 | 第3次 |
| V[Na2S2O3(aq)]/mL | 20.00 | 19.90 | 21.10 |
更新时间:2022-04-05 02:02:31
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
【推荐1】高铁酸钾( )是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物
)是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物 可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为
可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为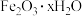 )制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
)制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:

(1) 中Fe呈
中Fe呈___ 价;列举 常见的一种用途:
常见的一种用途:________ 。
(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:__________ ;用电子式表示Cl2的形成过程:_________________ 。
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且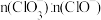 =1:5,则溶液中c(ClO-)=
=1:5,则溶液中c(ClO-)=______ mol∙L−1。(设KOH与Cl2恰好完全反应)
(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:___________ 。
(5) 在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为________ mol。
 )是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物
)是20世纪70年代以来开发的一种继臭氧、过氧化氢之后的新型水处理剂,且还原产物 可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为
可以作为净水剂,不存在二次污染;分解产物为氧气,不会造成环境污染。某化学兴趣小组计划用铁锈(主要成分为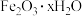 )制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
)制备高铁酸钾,其工艺流程如图。根据工艺流程并结合所学知识,回答下列问题:
(1)
 中Fe呈
中Fe呈 常见的一种用途:
常见的一种用途:(2)该小组同学准备利用KMnO4与浓盐酸制取Cl2,请写出该反应的离子方程式:
(3)已知:低温时,Cl2与NaOH生成NaClO与NaCl;高温时,Cl2与NaOH反应生成NaClO3与NaCl。若测得Cl2与KOH反应后的溶液中c(K+)=8 mol∙L−1,且
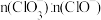 =1:5,则溶液中c(ClO-)=
=1:5,则溶液中c(ClO-)=(4)该流程中进行了多次过滤操作,请写出过滤时需要用到的玻璃仪器:
(5)
 在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
在高温下会分解产生Fe2O3和O2,若高铁酸钾分解收集到672mL气体(标准状况下,气体全部逸出),此时转移的电子的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】已知A、B、C、D、E、F 6种物质的转化关系如下
(1) A+B→C+H2O
(2) C+KOH→D↓(蓝色)+E
(3) B+D→C+H2O
(4) E+BaCl2→KCl + F↓(白色,不溶于稀硝酸)
(5)G+B→CO2↑+ F↓+ H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B_______ ;C _______ ;G __________ 。
(2)检验E中的阴离子的实验是______________________________________________
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为__________________
(1) A+B→C+H2O
(2) C+KOH→D↓(蓝色)+E
(3) B+D→C+H2O
(4) E+BaCl2→KCl + F↓(白色,不溶于稀硝酸)
(5)G+B→CO2↑+ F↓+ H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B
(2)检验E中的阴离子的实验是
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】有以下多种物质,请回答相关问题:
①硫酸钠②氢氧化钡③醋酸④一水合氨⑤次氯酸钠⑦乙醇
(1)上述物质的水溶液显碱性的是___________ 。(填序号)
(2)从显碱性的溶液中任选一种,用化学用语说明其显碱性的原因___________ 。(写表达式)
(3)室温下,配制浓度均为0.1 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
① ②
② ③
③ ④
④ ⑤
⑤
资料:某些弱酸在25℃时的电离常数如下:
①写出碳酸的第一级电离平衡常数 的计算公式
的计算公式___________ 。
②上述酸中酸性最强的是___________ 。(填化学式)
③25℃时,若次氯酸中初始 的物质的量浓度为0.01
的物质的量浓度为0.01 ,达到电离平衡时溶液中。
,达到电离平衡时溶液中。
___________ (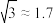 )
)
④下列反应可以发生的是___________ (填字母)。
A.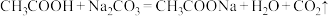
B.
C.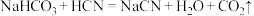
①硫酸钠②氢氧化钡③醋酸④一水合氨⑤次氯酸钠⑦乙醇
(1)上述物质的水溶液显碱性的是
(2)从显碱性的溶液中任选一种,用化学用语说明其显碱性的原因
(3)室温下,配制浓度均为0.1
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①
 ②
② ③
③ ④
④ ⑤
⑤
资料:某些弱酸在25℃时的电离常数如下:
| 化学式 |  |  |  |  |  |
| 电离常数 |  | 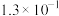 |  |  | 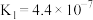  |
 的计算公式
的计算公式②上述酸中酸性最强的是
③25℃时,若次氯酸中初始
 的物质的量浓度为0.01
的物质的量浓度为0.01 ,达到电离平衡时溶液中。
,达到电离平衡时溶液中。
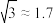 )
)④下列反应可以发生的是
A.
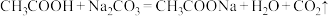
B.

C.
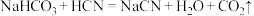
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】下图A、B、C是某课外活动小组设计的制取氨气并进行喷泉实验的三组装置示意图,制取NH3选用试剂如图所示,回答下列问题:

(1)用A图所示的装置可制备干燥的NH3
①反应的化学方程式为:____________________________ 。装置中收集NH3的试管口放置棉花团的作用是_________________________________________ 。
②干燥管中干燥剂能否改用无水CaCl2___________ ,理由是_______________________ 。
(2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。根据B图所示的装置及试剂回答下列问题:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:_________________________
②检验NH3是否收集满的实验方法是:______________________________________________ 。
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发喷泉的操作是_______________________ ,该反应的原理是_____________________ 。
(4)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示_________ 。汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反应可转化为无害气体排放,写出相关反应的化学方程式:___________________

(1)用A图所示的装置可制备干燥的NH3
①反应的化学方程式为:
②干燥管中干燥剂能否改用无水CaCl2
(2)用B图所示的装置可快速制取较大量NH3拟作喷泉实验。根据B图所示的装置及试剂回答下列问题:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:
②检验NH3是否收集满的实验方法是:
(3)用C图所示的装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发喷泉的操作是
(4)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】Cl2O又称次氯酸酐,是强氧化剂,极易溶于水,沸点为3.8℃,42℃以上分解为Cl2和O2,高浓度时易爆炸。某学习小组利用Cl2和潮湿的碳酸钠反应生成Cl2O,再用水吸收Cl2O制备HClO溶液,装置如下,回答下列问题:
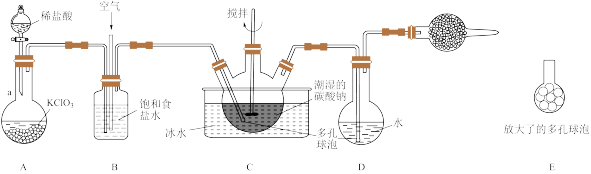
(1)仪器a的名称是_______ ,A中发生反应的化学方程式为_______ 。
(2)B中饱和食盐水的作用是_______ ,实验中须控制氯气和空气(空气不参与反应)的体积比为1:3,其目的是_______ ,球形干燥管中所装试剂为_______ 。
(3)装置C中生成Cl2O、CO2,反应的化学方程式为_______
(4)若装置C不冷却,则进入装置D中的Cl2O会大量减少,可能的原因是_______ 。
(5)测定装置D中HClO溶液的物质的量浓度的实验方案:取20.00mL HClO溶液,加入足量H2O2溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为0.861g,则HClO溶液的物质的量浓度为_______ mol/L(HClO可被H2O2还原成Cl-)。

(1)仪器a的名称是
(2)B中饱和食盐水的作用是
(3)装置C中生成Cl2O、CO2,反应的化学方程式为
(4)若装置C不冷却,则进入装置D中的Cl2O会大量减少,可能的原因是
(5)测定装置D中HClO溶液的物质的量浓度的实验方案:取20.00mL HClO溶液,加入足量H2O2溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为0.861g,则HClO溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】I.A、B、C、D、E为中学常见化学物质,它们之间可发生如图所示的转化,反应条件和部分产物已略去。其中A、C、E含有同一种元素X;A、D是常见金属单质,B是一种黄绿色气体。
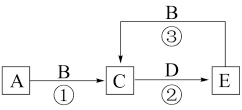
(1)物质B的化学式为_______ ;物质C中元素X的价态为_______ 。
(2)反应②可用于蚀刻铜电路板,其化学方程式为_______ 。
II.高铁酸钠是钠的六价铁酸盐,化学式为 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
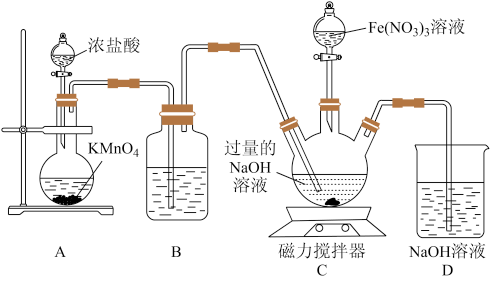
(3)装置A中,盛装浓盐酸的仪器名称为_______ ;若不考虑本实验条件限制,制备 时还可以将
时还可以将 替换为
替换为_______ (写出一种即可)。
(4)装置B中盛装液体的作用为_______ 。
(5)先向装置C的三颈烧瓶中通入一段时间 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

(1)物质B的化学式为
(2)反应②可用于蚀刻铜电路板,其化学方程式为
II.高铁酸钠是钠的六价铁酸盐,化学式为
 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为
 时还可以将
时还可以将 替换为
替换为(4)装置B中盛装液体的作用为
(5)先向装置C的三颈烧瓶中通入一段时间
 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐1】水合氧化铁[FeO(OH)]是一种重要的化工原料,用作磁性材料、颜料铁黄等.一种以硫铁矿烧渣(含Fe、FeO、SiO2和少量CuO)为原料生产FeO(OH)的工艺流程如下:
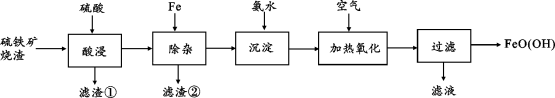
回答下列问题:
(1)“酸浸”时CuO与硫酸发生反应的离子方程式为_______
(2)“除杂”时滤渣②的成分有Fe和_______
(3)常温时,当“沉淀”后溶液中的Fe2+浓度为8.0×10-6mol·L-1时,溶液的pH=_______ {Ksp[Fe(OH)2]=8.0×10-16}。
(4)“加热氧化”的化学方程式为_______ 。
(5)“过滤”后需洗涤FeO(OH)沉淀,请设计实验检验FeO(OH)沉淀是否洗涤干净_______ 。

回答下列问题:
(1)“酸浸”时CuO与硫酸发生反应的离子方程式为
(2)“除杂”时滤渣②的成分有Fe和
(3)常温时,当“沉淀”后溶液中的Fe2+浓度为8.0×10-6mol·L-1时,溶液的pH=
(4)“加热氧化”的化学方程式为
(5)“过滤”后需洗涤FeO(OH)沉淀,请设计实验检验FeO(OH)沉淀是否洗涤干净
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl3•6H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是_____________ ;
(2)试剂A是______ ;
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是______ ;
a. 检验Cl2的存在 b. 检验Fe3+的存在 c. 检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是______ (填字母)。
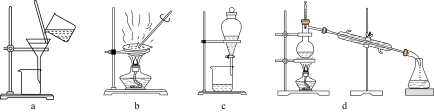
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl3•6H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是
(2)试剂A是
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是
a. 检验Cl2的存在 b. 检验Fe3+的存在 c. 检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是

您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
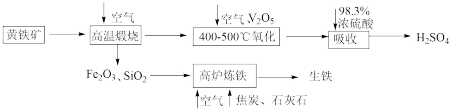
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】某化学兴趣小组利用如图装置制备氨气并探究相关性质。
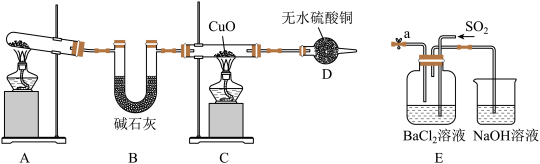
(1)实验室用A装置生成 的化学方程式为
的化学方程式为_______ 。
(2)D装置后接尾气吸收装置,下列能用来吸收尾气的装置是_______ (填序号)。
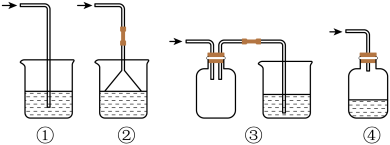
若将D与a相连,在E中产生白色沉淀,其沉淀的化学式为_______ 。设计实验验证E装置中含有
_______ 。
(3)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为_______ ;若充分反应后红色固体有剩余,再加入下列的_______ (填序号)试剂,固体又可以继续溶解。
A.稀 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
(4)已知 为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为
为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为_______ 。

(1)实验室用A装置生成
 的化学方程式为
的化学方程式为(2)D装置后接尾气吸收装置,下列能用来吸收尾气的装置是

若将D与a相连,在E中产生白色沉淀,其沉淀的化学式为

(3)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为
A.稀
 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液(4)已知
 为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为
为红色固体,反应前C中CuO质量为8g,反应后C中红色固体质量为6.8g,则C中发生的总反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】次氯酸钠可用于漂白、制药、化工等众多领域。实验室可用如图所示装置制备次氯酸钠。已知:氯气与氢氧化钠溶液反应放热,能使溶液温度升高。
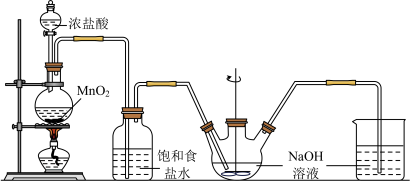
(1)上述装置中制取 的化学方程式为
的化学方程式为_______ ,标准状况下若产生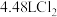 ,则反应过程中被氧化的HCl的物质的量为
,则反应过程中被氧化的HCl的物质的量为_______ mol。
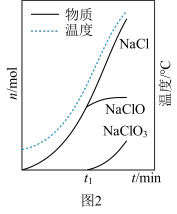
(2)三颈烧瓶中生成物的物质的量和溶液温度随时间变化如图2所示。 分钟后有副产物
分钟后有副产物 生成,要减少该物质生成可以采取的方法有
生成,要减少该物质生成可以采取的方法有_______ 。
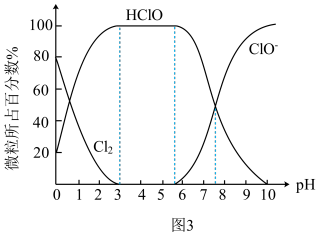
(3)已知氯水中HClO浓度越大杀菌能力越强。25℃时,氯水中 、HClO、
、HClO、 三种微粒所占百分数与pH的关系如图3。用
三种微粒所占百分数与pH的关系如图3。用 处理饮用水时,溶液的pH
处理饮用水时,溶液的pH最佳 范围是_______ 。
(4)为了测定三颈烧瓶中次氯酸钠的浓度(假设其它成分不参与反应),某兴趣小组进行了如下实验。已知:化学反应中参加反应的各物质的物质的量之比等于化学方程式中对应物质的化学计量数之比。
①取20.00mL溶液,调pH至溶液呈酸性,加入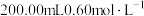 的
的 溶液(过量),充分发生下列反应:
溶液(过量),充分发生下列反应: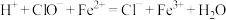 (未配平)
(未配平)
②向上述反应后的溶液中滴加 的
的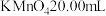 溶液,恰好完全发生下列反应(此条件下
溶液,恰好完全发生下列反应(此条件下 不参与反应)
不参与反应) (未配平)
(未配平)
计算次氯酸钠的物质的量浓度_______ (写出计算过程)。

(1)上述装置中制取
 的化学方程式为
的化学方程式为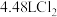 ,则反应过程中被氧化的HCl的物质的量为
,则反应过程中被氧化的HCl的物质的量为(2)三颈烧瓶中生成物的物质的量和溶液温度随时间变化如图2所示。
 分钟后有副产物
分钟后有副产物 生成,要减少该物质生成可以采取的方法有
生成,要减少该物质生成可以采取的方法有
(3)已知氯水中HClO浓度越大杀菌能力越强。25℃时,氯水中
 、HClO、
、HClO、 三种微粒所占百分数与pH的关系如图3。用
三种微粒所占百分数与pH的关系如图3。用 处理饮用水时,溶液的pH
处理饮用水时,溶液的pH
(4)为了测定三颈烧瓶中次氯酸钠的浓度(假设其它成分不参与反应),某兴趣小组进行了如下实验。已知:化学反应中参加反应的各物质的物质的量之比等于化学方程式中对应物质的化学计量数之比。
①取20.00mL溶液,调pH至溶液呈酸性,加入
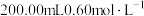 的
的 溶液(过量),充分发生下列反应:
溶液(过量),充分发生下列反应: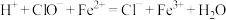 (未配平)
(未配平)②向上述反应后的溶液中滴加
 的
的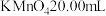 溶液,恰好完全发生下列反应(此条件下
溶液,恰好完全发生下列反应(此条件下 不参与反应)
不参与反应) (未配平)
(未配平)计算次氯酸钠的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】下图是某儿童微量元素体检报告单的部分数据:
根据上表的数据,回答下列问题:
(1)该儿童___________ 元素含量偏低。
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
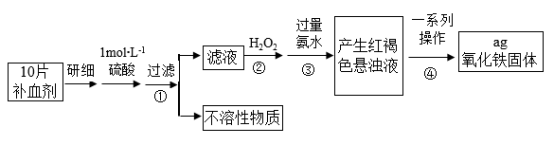
请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式___________ 。
b.④中一系列处理的操作步骤为___________ 、___________ 、灼烧、冷却、称量。
c.若实验无损耗,则每片补血剂含铁元素的质量分数为___________ 。
怀化市医疗机构临床检验结果报告单 | ||||
分析项目 | 检测结果 | 单位 | 参考范围 | |
1 | 锌(Zn) | 115.92 |
| 66~120 |
2 | 铁(Fe) | 6.95↓ | mmol·L-1 | 7.52~11.82 |
3 | 钙(Ca) | 1.68 | mmol·L-1 | 1.55~2.10 |
(1)该儿童
(2)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:

请回答下列问题:
a.②中加入H2O2后发生的反应的离子方程式
b.④中一系列处理的操作步骤为
c.若实验无损耗,则每片补血剂含铁元素的质量分数为
您最近一年使用:0次

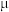 mol·L-1
mol·L-1

