能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上用天然气为原料,分为两阶段制备甲醇:
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是_______ 。
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。
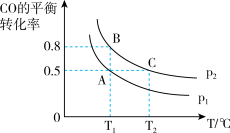
①比较A、B 两点压强大小PA_______ PB(填“>、<、=”)
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=_______ L;
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH_______ 0(填“>、=、<”)
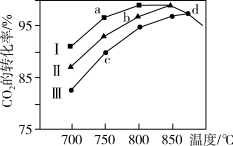
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是_______ ;CO2的转化率a 点比c点高的原因是_______ 。
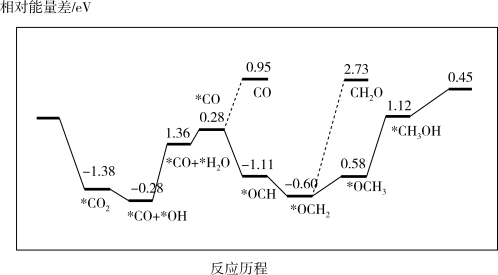
③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为_______ ;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH
(Ⅰ)制备合成气:CH4(g)+H2O(g) ⇌CO(g)+3H2(g) ΔH= +206.0kJ•mol-1
(Ⅱ)合成甲醇:CO(g)+2H2(g)⇌CH3OH(g) ΔH= -90.67kJ•mol-1
(1)在刚性容器中制备合成气,下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化
B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变
D.体系的密度不再发生变化
E.反应速率v(CH4)=3v(H2)
(2)在一容积可变的密闭容器中充入10mol CO和20mol H2合成甲醇,CO的平衡转化率随温度(T)、压强(P)的变化如图所示。

①比较A、B 两点压强大小PA
②若达到化学平衡状态 A 时,容器的体积为 10L,如果反应开始时仍充入 10mol CO和20mol H2,则在平衡状态 B 时,容器的体积V(B)=
(3)为节约化石能源、减少碳排放,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成水蒸气和甲醇,CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g)该反应在低温下可自发进行,则ΔH
②研究表明在二氧化碳合成甲醇的原料气的反应中,保持其它条件不变,采用Ⅰ、Ⅱ、Ⅲ三种催化剂,反应进行相同时间后,CO2的转化率随反应体系的温度变化如图所示;a~d点中反应可能处于平衡状态的点是

③最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示;容易得到的副产物有 CO 和CH2O,其中相对较少的副产物为
A.*CO → *OCH B.*CO+*OH→*CO+*H2O
C.*OCH2→*OCH3 D.*OCH3→*CH3OH

更新时间:2022-04-14 16:08:55
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205kJ/mol
写出CO2重整的热化学方程式:___________ 。
(2)“亚硫酸盐法”吸收烟气中的SO2
①将烟气通入1.0mol/L的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___________ (填“减小”“不变”或“增大)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO )=0.2mol/L,则溶液中c(HSO
)=0.2mol/L,则溶液中c(HSO )=
)=___________ 。
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图:
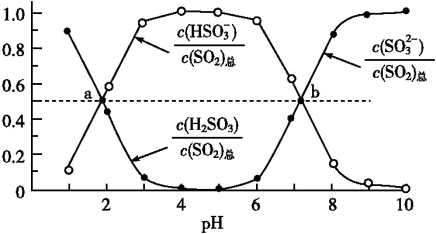
b点时溶液pH=7,则n(NH )∶n(HSO
)∶n(HSO )=
)=___________ 。
(3)催化氧化法去除NO。一定条件下,用NH3消除NO污染,其反应原理:4NH3+6NO 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1,3∶1,1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1,3∶1,1∶3时,得到NO脱除率曲线如图所示:
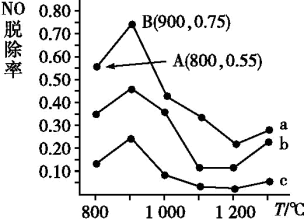
①曲线a中,NO的起始浓度为6×10−4mg·m−3,从A点到B点经过0.8s,该时间段内NO的脱除速率为___________ mg·m−3·s−1。
②曲线b对应NH3与NO的物质的量之比是___________ 。
(4)间接电化学法除NO。其原理如图所示:

写出阴极的电极反应式(阴极室溶液呈酸性):___________
(1)CO2的重整用CO2和H2为原料可得到CH4燃料。
已知:①CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH1=+247kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH2=+205kJ/mol
写出CO2重整的热化学方程式:
(2)“亚硫酸盐法”吸收烟气中的SO2
①将烟气通入1.0mol/L的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断
 )=0.2mol/L,则溶液中c(HSO
)=0.2mol/L,则溶液中c(HSO )=
)=②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图:

b点时溶液pH=7,则n(NH
 )∶n(HSO
)∶n(HSO )=
)=(3)催化氧化法去除NO。一定条件下,用NH3消除NO污染,其反应原理:4NH3+6NO
 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1,3∶1,1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1,3∶1,1∶3时,得到NO脱除率曲线如图所示:
①曲线a中,NO的起始浓度为6×10−4mg·m−3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
②曲线b对应NH3与NO的物质的量之比是
(4)间接电化学法除NO。其原理如图所示:

写出阴极的电极反应式(阴极室溶液呈酸性):
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】MgH2和Mg2Cu可用作贮氢材料,MgO可用作炉膛内脱硫脱硝的试剂。
(1)MgH2是一种离子化合物,其电子式为_______________ 。
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为_____________ 。
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ•mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ•mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 kJ•mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为______________ 。
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为__________________ 。
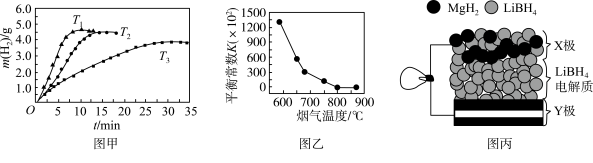
(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g) 2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
①上述反应的平衡常数表达式为K=_________ 。
②a_________ 0(填“>”或“<”)。
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为_________ 。充电时,Y极的电极反应式为______________ 。
(1)MgH2是一种离子化合物,其电子式为
(2)Mg2Cu在加压条件下储氢时生成MgH2和MgCu2,该反应的化学方程式为
(3)已知MgH2的有关热化学方程式如下:
MgH2(s) =Mg(s)+H2(g) △H1=+74.4kJ•mol-1;
H2(g)+l/2O2(g)=H2O(g) △H2=-241.8 kJ•mol-1;
Mg(s)+l/2O2(g)=MgO(s) △H3=-141.6 kJ•mol-1。
①氢化镁燃烧生成氧化镁和水蒸气的热化学方程式为
②MgH2作贮氢材料时,单位贮氢材料释放出氢气的质量随时间的变化如图甲所示,其中温度T1、T2、T3由小到大的顺序为

(4)炉膛内脱除 SO2、NO 反应为2MgO(s)+2SO2(g)+2NO(g)
 2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。
2MgSO4(s)+N2(g) △H =akJ/mol,其平衡常数与温度的关系如图乙所示。①上述反应的平衡常数表达式为K=
②a
(5)全固态锂离子电池的结构如图丙所示,放电时电池反应为2Li+MgH2=Mg+2LiH。放电时,X极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】CO2减排能有效降低温室效应,同时,CO2也是一种重要的资源,因此CO2捕集与转化技术研究备受关注。
I.CO2催化加氢制甲醇
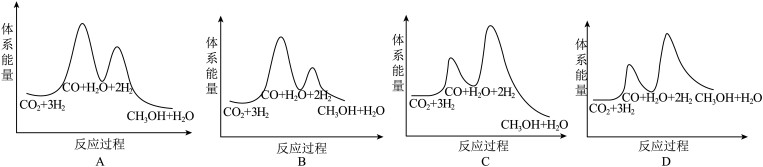
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为_______ 。若反应①为慢反应(活化能高),下列图中能体现上述能量变化的是_______ 。
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
①离子液体聚合物捕集CO2的反应为_______ (填“吸热”或“放热”)反应。
②离子液体聚合物捕集CO2的有利条件是_______ 。
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。_______ (填“正”或“负”)。
(4)B极的电极反应为_______ 。
I.CO2催化加氢制甲醇
(1)已知:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ•mol-1
则CO2催化加氢制甲醇的热化学方程式为
(2)已知离子液体聚合物在不同温度和不同CO2流速下,CO2吸附容量随时间的变化如图1和图2。
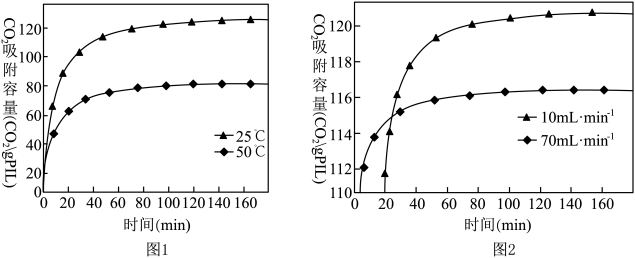
①离子液体聚合物捕集CO2的反应为
②离子液体聚合物捕集CO2的有利条件是
Ⅲ:Me-CO2电池捕集CO2
图3是一种基于Na超离子导体固体电解质的钠-二氧化碳电池,该电池以饱和氯化钠溶液作为水系电解液,以氮掺杂单壁碳纳米角(N-SWCNH)为催化剂,其主要放电产物为NaHCO3和C。
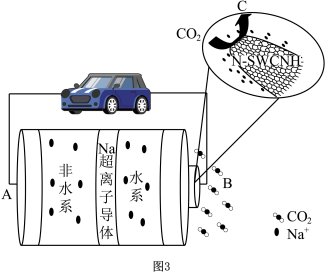
(4)B极的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: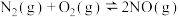
 。回答下列问题:
。回答下列问题:
(1)某温度下,向2L的密闭容器中充入 和
和 各1mol,5min后
各1mol,5min后 的物质的量为0.5mol,则
的物质的量为0.5mol,则 的反应速率为
的反应速率为___________ 。
(2)已知该反应是在恒容条件下进行,判断该反应达到平衡的标志___________ (填序号)。
a.消耗 同时生成
同时生成 b.混合气体密度不变
b.混合气体密度不变
c.混合气体的质量不变 d.混合气体平均相对分子质量不变
e.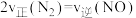 f.混合气体的压强不变
f.混合气体的压强不变
(3)向恒温恒容的密闭容器中充入等物质的量的 和
和 ,反应达到平衡后,再向其中充入一定量NO,反应重新达到平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数
,反应达到平衡后,再向其中充入一定量NO,反应重新达到平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数___________ (填“增大”“减小”或“不变”)。
(4)升高温度,达到新平衡时NO的百分含量增大,理由是___________ 。
Ⅱ.在容积为1L的密闭容器中,充入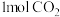 和
和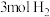 ,在500℃下发生发生发应:
,在500℃下发生发生发应: 。实验测得
。实验测得 和
和 的物质的量(n)随时间变化如下图1所示:
的物质的量(n)随时间变化如下图1所示:
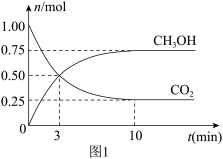
(5)从反应开始到平衡,氢气的转化率为___________ ,500℃该反应的平衡常数为___________ (结果保留一位小数)。
(6)图2是 时刻,改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃,反应达平衡状态Ⅱ时,K值
时刻,改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃,反应达平衡状态Ⅱ时,K值___________ (填“增大”“减小”或“不变”)。

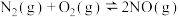
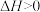 。回答下列问题:
。回答下列问题:(1)某温度下,向2L的密闭容器中充入
 和
和 各1mol,5min后
各1mol,5min后 的物质的量为0.5mol,则
的物质的量为0.5mol,则 的反应速率为
的反应速率为(2)已知该反应是在恒容条件下进行,判断该反应达到平衡的标志
a.消耗
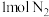 同时生成
同时生成 b.混合气体密度不变
b.混合气体密度不变c.混合气体的质量不变 d.混合气体平均相对分子质量不变
e.
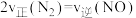 f.混合气体的压强不变
f.混合气体的压强不变(3)向恒温恒容的密闭容器中充入等物质的量的
 和
和 ,反应达到平衡后,再向其中充入一定量NO,反应重新达到平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数
,反应达到平衡后,再向其中充入一定量NO,反应重新达到平衡状态。与原平衡状态相比,此时平衡混合气体中NO的体积分数(4)升高温度,达到新平衡时NO的百分含量增大,理由是
Ⅱ.在容积为1L的密闭容器中,充入
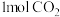 和
和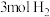 ,在500℃下发生发生发应:
,在500℃下发生发生发应: 。实验测得
。实验测得 和
和 的物质的量(n)随时间变化如下图1所示:
的物质的量(n)随时间变化如下图1所示:
(5)从反应开始到平衡,氢气的转化率为
(6)图2是
 时刻,改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃,反应达平衡状态Ⅱ时,K值
时刻,改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃,反应达平衡状态Ⅱ时,K值
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
Ⅰ.氮氧化物的研究
(1)一定条件下,将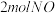 与
与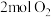 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应: ,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
(2)已知反应 ,在不同条件时
,在不同条件时 的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线
的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线 表示的是
表示的是_______ (填字旺序号)。
A.压强B.温度C.催化剂
根据图2中的能量变化数据,计算反应 的
的
_______ 。
Ⅱ.碳氧化物研究
(3)图3甲为恒温恒容装置,乙为恒温恒压装置。已知CO和 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: 。
。
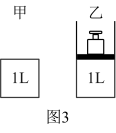
相同温度下,将 和
和 分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲
分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲_______ 乙(填“<”、“>”或“=”);若再向乙容器中通入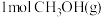 ,重新达到平衡后,
,重新达到平衡后, 在体系中的百分含量
在体系中的百分含量_______ (填“变大”或“变小”或“不变”)。
Ⅰ.氮氧化物的研究
(1)一定条件下,将
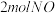 与
与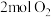 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应: ,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。| A.混合气体的密度保持不变 | B.NO的转化率保持不变 |
C.NO和 的物质的量之比保持不变 的物质的量之比保持不变 | D. 的消耗速率和 的消耗速率和 的消耗速率相等 的消耗速率相等 |
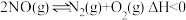 ,在不同条件时
,在不同条件时 的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线
的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线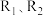 表示的是
表示的是A.压强B.温度C.催化剂
根据图2中的能量变化数据,计算反应
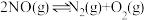 的
的

Ⅱ.碳氧化物研究
(3)图3甲为恒温恒容装置,乙为恒温恒压装置。已知CO和
 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: 。
。
相同温度下,将
 和
和 分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲
分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲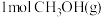 ,重新达到平衡后,
,重新达到平衡后, 在体系中的百分含量
在体系中的百分含量
您最近一年使用:0次
【推荐3】氨是重要的无机化工产品之一,在国民经济占有重要地位。
(1)1913年成为工业现实的合成氨反应又称为“哈珀-博施法”,反应为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。
①在500℃、20MPa时,将1molN2、4molH2和固体催化剂置于一个容积为2L的密闭容器中发生反应,15min后反应达到平衡状态,容器内气体压强变为起始的80%,则15min内的v(H2)=___ ,平衡常数K=___ L2/mol2(计算结果可用分数表示)。
②在绝热恒容密闭容器中进行合成氨反应,下列能表示反应达到平衡状态的是___ (填序号)。
A.平衡常数K不再发生变化
B.混合气体的密度不再发生变化
C.单位时间内断开3amolH-H键的同时断开2amolN-H键
D.3v逆(NH3)=2v正(H2)
(2)根据最新“人工固氮”的研究报道,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l) 2NH3(g)+1.5O2(g)△H=akJ/mol,进一步研究NH3生成量与温度的关系,测得部分实验数据如表:
2NH3(g)+1.5O2(g)△H=akJ/mol,进一步研究NH3生成量与温度的关系,测得部分实验数据如表:
此合成反应的a___ 0(填“>”、“<”或“=”),该反应可以自发进行的理由是___ 。
(3)工业上通常利用NH3的催化氧化反应合成硝酸。
①图1是氨氧化率与氧氨比的关系,直线表示理论值,曲线表示实际情况。实际生产时要将r值维持在1.7-2.2之间的原因是___ 。
②N2O是硝酸生产过程中的副产物,可用反应N2O(g)+CO(g)=CO2(g)+N(g)进行消除,反应历程如图2所示。该反应的催化剂是___ ,已知总反应达平衡的时间主要由第I步反应决定,由此推知第II步反应的活化能___ (填“>”、“<”或“=”)第I步反应活化能。
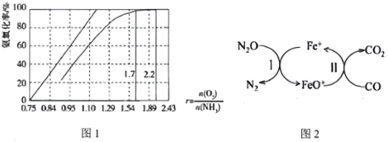
(4)NH3还常用于合成尿素。
已知:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=-151.5kJ/mol
CO(NH2)2(s)+H2O(g)=NH2CO2NH4(s)△H2=-120.5kJ/mol
H2O(l)=H2O(g)△H3=+44kJ/mol
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为___ 。
(1)1913年成为工业现实的合成氨反应又称为“哈珀-博施法”,反应为:N2(g)+3H2(g)
 2NH3(g)△H=-92.4kJ/mol。
2NH3(g)△H=-92.4kJ/mol。①在500℃、20MPa时,将1molN2、4molH2和固体催化剂置于一个容积为2L的密闭容器中发生反应,15min后反应达到平衡状态,容器内气体压强变为起始的80%,则15min内的v(H2)=
②在绝热恒容密闭容器中进行合成氨反应,下列能表示反应达到平衡状态的是
A.平衡常数K不再发生变化
B.混合气体的密度不再发生变化
C.单位时间内断开3amolH-H键的同时断开2amolN-H键
D.3v逆(NH3)=2v正(H2)
(2)根据最新“人工固氮”的研究报道,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)
 2NH3(g)+1.5O2(g)△H=akJ/mol,进一步研究NH3生成量与温度的关系,测得部分实验数据如表:
2NH3(g)+1.5O2(g)△H=akJ/mol,进一步研究NH3生成量与温度的关系,测得部分实验数据如表:| T/K | 303 | 313 | 323 |
| NH3生成量(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a
(3)工业上通常利用NH3的催化氧化反应合成硝酸。
①图1是氨氧化率与氧氨比的关系,直线表示理论值,曲线表示实际情况。实际生产时要将r值维持在1.7-2.2之间的原因是
②N2O是硝酸生产过程中的副产物,可用反应N2O(g)+CO(g)=CO2(g)+N(g)进行消除,反应历程如图2所示。该反应的催化剂是

(4)NH3还常用于合成尿素。
已知:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=-151.5kJ/mol
CO(NH2)2(s)+H2O(g)=NH2CO2NH4(s)△H2=-120.5kJ/mol
H2O(l)=H2O(g)△H3=+44kJ/mol
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】我国提出争取在2030年前实现碳达峰,这对于改善环境,实现绿色发展至关重要。催化还原CO2是解决温室效应及能源问题的重要手段之一,以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.
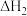 =-90.5 kJ∙mol-1
=-90.5 kJ∙mol-1
Ⅲ.
 = +40.9 kJ∙mol-1
= +40.9 kJ∙mol-1
回答下列问题:
(1) =
=_______ kJ∙mol-1。
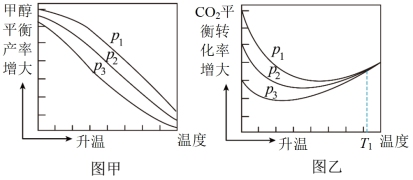
(2)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CH3OH的平衡产率和CO2的平衡转化率随温度的变化关系分别为图甲和图乙所示。
已知:CO2的平衡转化率=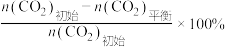 ,CH3OH的平衡产率=
,CH3OH的平衡产率=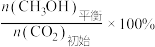
其中图甲中CH3OH的平衡产率随温度升高而下降的原因是_______ ,压强p1、p2、p3由大到小的顺序为_______ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
(3)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件_______(填标号)。
(4)已知反应: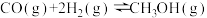
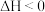 。T℃时,向体积为1L的密闭容器中通入1molCO(g)和2molH2(g),在催化剂作用下反应,10分钟后达到平衡,CO的平衡转化率为50%,则CO的反应速率为
。T℃时,向体积为1L的密闭容器中通入1molCO(g)和2molH2(g),在催化剂作用下反应,10分钟后达到平衡,CO的平衡转化率为50%,则CO的反应速率为_______ ,平衡时混合气体的总压强为p Pa,则该温度下反应的平衡常数Kp=_______ Pa-2(用平衡分压代替平衡浓度进行计算,分压=总压×物质的量分数)。
Ⅰ.


Ⅱ.

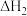 =-90.5 kJ∙mol-1
=-90.5 kJ∙mol-1Ⅲ.

 = +40.9 kJ∙mol-1
= +40.9 kJ∙mol-1回答下列问题:
(1)
 =
=(2)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CH3OH的平衡产率和CO2的平衡转化率随温度的变化关系分别为图甲和图乙所示。

已知:CO2的平衡转化率=
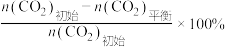 ,CH3OH的平衡产率=
,CH3OH的平衡产率=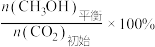
其中图甲中CH3OH的平衡产率随温度升高而下降的原因是
(3)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件_______(填标号)。
| A.高温、高压 | B.高温、低压 | C.低温、低压 | D.低温、高压 |
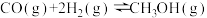
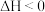 。T℃时,向体积为1L的密闭容器中通入1molCO(g)和2molH2(g),在催化剂作用下反应,10分钟后达到平衡,CO的平衡转化率为50%,则CO的反应速率为
。T℃时,向体积为1L的密闭容器中通入1molCO(g)和2molH2(g),在催化剂作用下反应,10分钟后达到平衡,CO的平衡转化率为50%,则CO的反应速率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】(1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___ kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
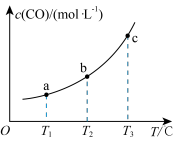
①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______ K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________ 。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:
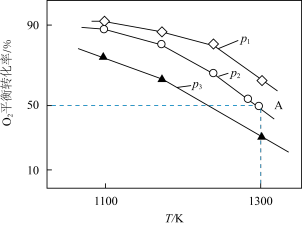
①p1、p2、p3的大小:_________ 。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________ (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
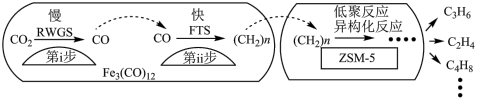
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______ 助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____ ;
②下列说法正确的是______ ;
a 第ⅰ步所反应为:CO2+H2 CO+H2O
CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)
 CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
①该反应△H
②若T1、T2时的平衡常数分别为K1、K2,则K1
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g)
 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①p1、p2、p3的大小:
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
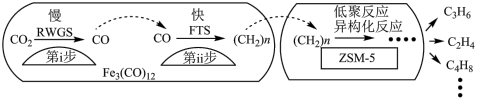
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
| 助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
| C2H4 | C3H6 | 其他 | ||
| Na | 42.5 | 35.9 | 39.6 | 24.5 |
| K | 27.2 | 75.6 | 22.8 | 1.6 |
| Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加
②下列说法正确的是
a 第ⅰ步所反应为:CO2+H2
 CO+H2O
CO+H2Ob 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
您最近一年使用:0次
【推荐3】研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
①可以判断该分解反应已经达到化学平衡的是___________ 。
A.2v(NH3)=c(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数:___________ 。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________ (填“增加”、“减小”或“不变”)。
④氨基甲酸铵分解反应的焓变△H___________ 0,熵变△S___________ 0(填>、<或=)。
(2)某温度下,等物质的量的碘和环戊烯( )在恒容容器内发生反应
)在恒容容器内发生反应 (g)+I2(g)
(g)+I2(g)
 (g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
(g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=_______ Pa。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是
A.2v(NH3)=c(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数:
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量
④氨基甲酸铵分解反应的焓变△H
(2)某温度下,等物质的量的碘和环戊烯(
 )在恒容容器内发生反应
)在恒容容器内发生反应 (g)+I2(g)
(g)+I2(g)
 (g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
(g)+2HI(g) ΔH=+89.3kJ·mol-1,起始总压为105Pa,平衡时总压增加了20%,该反应的压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】含磷化合物在生产生活中有着重要的应用。
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是_______ (填字母)。
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+ H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为________________ 。
(3)已知PCl5(g) PCl3(g)+Cl2(g) △H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g) △H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
①PCl5的分解率a1=_____ %。若达到兴衡后体系总压为1.4MPa,用平衡分压代替平衡浓度表示反应的平衡常数Kp=_________ 。
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1________ a2,温度T1___ T2(填“>”“<”或“=”)。
③达到平衡后,下列情况使PCl5分解率增大的是___________ (填字母)。
a.温度、体积不变,充入氩气b.体积不变,对体系加热
C.温度、体积不变,充入氯气d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH 将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是__________________ 。
②下图是不同条件对磷的沉淀回收率的影响图象。处理该厂废水需控制的工艺条件为______ 。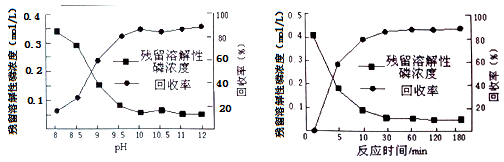
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+ H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为
(3)已知PCl5(g)
 PCl3(g)+Cl2(g) △H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g) △H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。①PCl5的分解率a1=
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1
③达到平衡后,下列情况使PCl5分解率增大的是
a.温度、体积不变,充入氩气b.体积不变,对体系加热
C.温度、体积不变,充入氯气d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH 将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是
②下图是不同条件对磷的沉淀回收率的影响图象。处理该厂废水需控制的工艺条件为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】丙烯腈是塑料、合成橡胶、合成纤维三大合成材料的重要原料,未来我国丙烯腈的出口量将进一步增加。合成丙烯腈的反应:
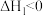 。
。
(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是_______ 。
(2)一定条件下,在2L恒容密闭容器中;通入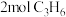 、
、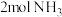 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为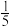 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。

①图中460℃前的产率_______ (填“是”或“否”)为平衡产率;理由是_______ 。
②若该反应达到A点所需的时间为t min,则理论上 的平均反应速率为
的平均反应速率为_______ 。
(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:
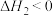 。
。
①其它条件不变时,压缩容器体积,副反应的平衡移动方向为_______ 。
②某温度下,向密闭容器中通入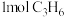 、
、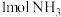 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为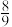 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为_______ kPa,该温度下副反应的
_______ 。
(4)己二腈 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
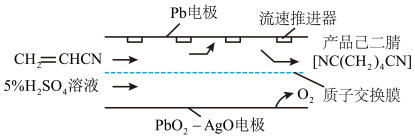
①阴极的电极反应式为_______ 。
②电解一段时间后,该装置产生的 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
_______ %。(假设装置中阳极上没有电子损失,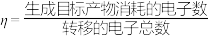 ×100%)
×100%)

 。
。(1)该反应中涉及的C、N、O三种元素原子的第一电离能由小到大的顺序是
(2)一定条件下,在2L恒容密闭容器中;通入
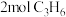 、
、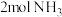 、15mol空气(
、15mol空气( 的体积分数为
的体积分数为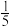 ),丙烯腈的产率与温度的关系如图所示。
),丙烯腈的产率与温度的关系如图所示。
①图中460℃前的产率
②若该反应达到A点所需的时间为t min,则理论上
 的平均反应速率为
的平均反应速率为(3)工业上在催化剂作用下,合成丙烯腈时还有副反应:

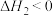 。
。①其它条件不变时,压缩容器体积,副反应的平衡移动方向为
②某温度下,向密闭容器中通入
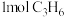 、
、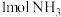 、7.5mol空气(
、7.5mol空气( 与
与 的体积比为1∶4),保持压强恒为99kPa,平衡时测得
的体积比为1∶4),保持压强恒为99kPa,平衡时测得 的转化率为90%,生成丙烯腈的选择性为
的转化率为90%,生成丙烯腈的选择性为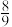 (选择性:生成丙烯腈的
(选择性:生成丙烯腈的 与共转化的
与共转化的 之比)。则生成丙烯腈的分压为
之比)。则生成丙烯腈的分压为
(4)己二腈
 是制造尼龙
是制造尼龙 的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
的原料。电解丙烯腈可制得己二腈,其装置如下图所示:
①阴极的电极反应式为
②电解一段时间后,该装置产生的
 在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
在标准状态下的体积为33.6L,生成了291.6g已二腈,则该装置的电流效率
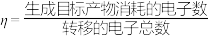 ×100%)
×100%)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】甲烷和水蒸气催化制氢主要有如下两个反应:
①
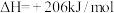
②

I.恒定压强时,将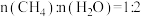 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
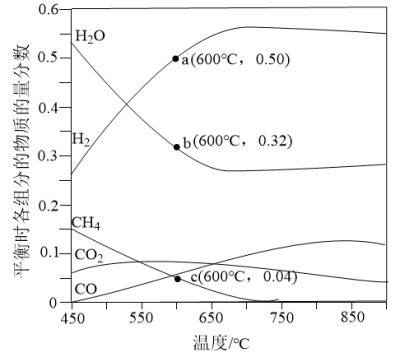
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
回答下列问题:
(1)已知在某种催化剂的作用下, 与
与 生成
生成 和CO的反应中,逆反应活化能
和CO的反应中,逆反应活化能 (逆)为
(逆)为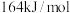 ,则该反应的
,则该反应的 (正)为
(正)为___________ kJ/mol。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是___________(填标号)。
(3)系统中 的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:___________ 。
(4)600℃时 的平衡转化率为
的平衡转化率为___________ %(精确到小数点后一位)。
Ⅱ.将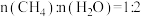 的混合气体投入恒温恒容的密闭容器中(压强为90KPa),发生反应①和②,容器内气体的压强随时间的变化如下表所示。
的混合气体投入恒温恒容的密闭容器中(压强为90KPa),发生反应①和②,容器内气体的压强随时间的变化如下表所示。
(5)用单位时间内气体分压的变化来表示反应速率,即 ,则反应①前150min内平均反应速率
,则反应①前150min内平均反应速率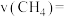
___________ kPa/min,250min末,测得氢气压强 为96kPa,
为96kPa, 为用气体分压表示的平衡常数,分压=总压×物质的量分数,则反应②平衡常数
为用气体分压表示的平衡常数,分压=总压×物质的量分数,则反应②平衡常数
___________ 。
①

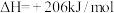
②


I.恒定压强时,将
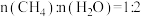 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
回答下列问题:
(1)已知在某种催化剂的作用下,
 与
与 生成
生成 和CO的反应中,逆反应活化能
和CO的反应中,逆反应活化能 (逆)为
(逆)为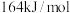 ,则该反应的
,则该反应的 (正)为
(正)为(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是___________(填标号)。
| A.恒温、恒压条件下,若反应容器中气体密度不变,即可判断反应已达平衡状态 |
| B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快 |
| C.恒容、绝热条件下,若反应容器中温度不变,即可判断反应已达平衡状态 |
D.恒压、绝热条件下,向平衡后的混合气体中加入稀有气体,再次平衡后 的物质的量会减少 的物质的量会减少 |
 的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
的含量,在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:(4)600℃时
 的平衡转化率为
的平衡转化率为Ⅱ.将
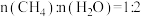 的混合气体投入恒温恒容的密闭容器中(压强为90KPa),发生反应①和②,容器内气体的压强随时间的变化如下表所示。
的混合气体投入恒温恒容的密闭容器中(压强为90KPa),发生反应①和②,容器内气体的压强随时间的变化如下表所示。| 时间/min | 0 | 50 | 100 | 150 | 200 | 250 | 300 |
| 压强/KPa | 90 | 111 | 123 | 132 | 139 | 144 | 144 |
 ,则反应①前150min内平均反应速率
,则反应①前150min内平均反应速率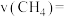
 为96kPa,
为96kPa, 为用气体分压表示的平衡常数,分压=总压×物质的量分数,则反应②平衡常数
为用气体分压表示的平衡常数,分压=总压×物质的量分数,则反应②平衡常数
您最近一年使用:0次



