硼及其化合物在工业中有很多用处。一些硼的卤化物的沸点如图所示:
(1)硼原子的核外共有_______ 种形状不同的电子云;溴原子的最外层电子排布式为_______ 。
(2)上表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为_______ 。 属于
属于_______ 分子(填“极性”或“非极性”)。
(3)解释表中三种卤化硼沸点存在差异的原因:_______ 。
硼酸是一种具有防腐作用的弱酸,其电高过程的微观图示如下:
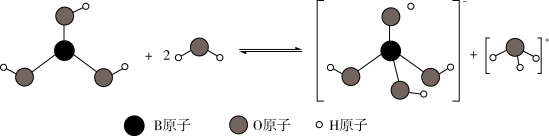
(4)向NaOH溶液中滴加少量硼酸,反应的离子方程式为_______ 。
(5)在氧化剂存在下,硼和强碱共熔发生如下反应: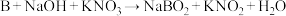 ,配平上述反应并标出电子转移的方向和数目
,配平上述反应并标出电子转移的方向和数目_______ 。该过程中被还原的元素是_______ ,写出该反应体系中属于弱电解质的物质的电子式:_______ ,属于碱类的电子式:_______ 。
| 卤化物 |  |  |  |
| 沸点 |  | 12.5 | 90 |
(2)上表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为
 属于
属于(3)解释表中三种卤化硼沸点存在差异的原因:
硼酸是一种具有防腐作用的弱酸,其电高过程的微观图示如下:

(4)向NaOH溶液中滴加少量硼酸,反应的离子方程式为
(5)在氧化剂存在下,硼和强碱共熔发生如下反应:
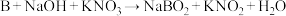 ,配平上述反应并标出电子转移的方向和数目
,配平上述反应并标出电子转移的方向和数目
更新时间:2022-04-20 08:12:17
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.含氨废水和废气对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4 mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:_____ NO3-+_______ Al+_______ H2O→_______ N2↑+______ Al(OH)3+________ OH-。
(2)上述反应中被还原的元素是____________ ,每生成2 mol N2转移_________ mol电子。
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为_________ g。
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:
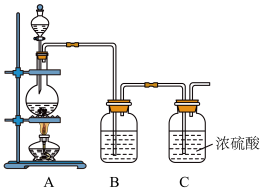
(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_________________________ 。
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为__________________________ 。
②如果不用装置E会引起什么后果:__________________ 。
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____________ ,为了充分吸收尾气,可将尾气与________________ 同时通入氢氧化钠溶液中。
(1)配平下列有关离子方程式:
(2)上述反应中被还原的元素是
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5 ℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:

(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为
②如果不用装置E会引起什么后果:
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下:

(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________ 。

(2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________ ;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于10−5 mol/L)______________ (列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×10−13、Ksp[Fe(OH)3]=2.6×10−39,Ksp[Sc(OH)3]=9.0×10−31)
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________ 。
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中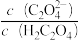 =
=_________________________ 。写出“沉钪”得到草酸钪(难溶于稀酸)的离子方程式___________________ [25℃时,草酸电离平衡常数为Ka1=5.0×10−2,Ka2=5.4×10−5]。
(5)草酸钪“灼烧”的化学方程式为_______________________ 。

(1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为

(2)加入氨水调节pH=3,过滤,滤渣主要成分是
(3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式
(4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中
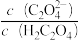 =
=(5)草酸钪“灼烧”的化学方程式为
您最近一年使用:0次
【推荐3】高浓度氨氮废水是造成河流及湖泊富营养化的主要因素。某氮肥厂处理氨氮废水的方案如图,回答下列问题:

(1)“pH调节池”加入“NaOH溶液”的目的是_____ 。
(2)“吹出塔”用热空气比用冷空气吹脱效果更好的原因是_____ 。
(3)“氧化池”中氨氮去除率与溶液pH的关系如图所示,则去除氨氮废水最适宜的pH_____ 。

(4)“排放池”中用活性炭除去水中残余的氯。这是利用活性炭的_____ 性。
(5)“硝化池”是在硝化菌的作用下实现NH →NO
→NO →NO
→NO 转化,在碱性条件下NH
转化,在碱性条件下NH 被氧气氧化成NO
被氧气氧化成NO 的总反应的离子方程式为
的总反应的离子方程式为_____ 。
(6)“反硝化池”是在一定条件下向废水中加入有机物如甲醇(CH3OH),实现HNO3→NO →N2转化,0.5molHNO3完全转化成N2转移电子的物质的量为
→N2转化,0.5molHNO3完全转化成N2转移电子的物质的量为_____ 。

(1)“pH调节池”加入“NaOH溶液”的目的是
(2)“吹出塔”用热空气比用冷空气吹脱效果更好的原因是
(3)“氧化池”中氨氮去除率与溶液pH的关系如图所示,则去除氨氮废水最适宜的pH

(4)“排放池”中用活性炭除去水中残余的氯。这是利用活性炭的
(5)“硝化池”是在硝化菌的作用下实现NH
 →NO
→NO →NO
→NO 转化,在碱性条件下NH
转化,在碱性条件下NH 被氧气氧化成NO
被氧气氧化成NO 的总反应的离子方程式为
的总反应的离子方程式为(6)“反硝化池”是在一定条件下向废水中加入有机物如甲醇(CH3OH),实现HNO3→NO
 →N2转化,0.5molHNO3完全转化成N2转移电子的物质的量为
→N2转化,0.5molHNO3完全转化成N2转移电子的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)写出元素m的一价离子的核外电子排布式:___________ 。
(2)在标号的主族元素中,电负性最大的是___________ (填元素符号)
(3)元素e、h、j的气志氢化物热稳定性由强到弱的顺序为:___________ (填化学式)。
(4)j元素最高价氧化物分子的中心原子的杂化轨道类型为___________ 。
(5)h的最简单氢化物的分子空间构型为___________ 。
(6)已知周期表中存在对角相似规则,如b与g在周期表中处于对角线位置则化学性质相似,b的氧化物、氢氧化物也有两性,写出b的氢氧化物与f的氢氧化物反应的化学方程式___________ 。
(7)m和n比较:第一电离能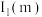
___________  (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
| a | |||||||||||||||||
| b | d | e | |||||||||||||||
| f | g | h | j | k | |||||||||||||
| m | n |
(1)写出元素m的一价离子的核外电子排布式:
(2)在标号的主族元素中,电负性最大的是
(3)元素e、h、j的气志氢化物热稳定性由强到弱的顺序为:
(4)j元素最高价氧化物分子的中心原子的杂化轨道类型为
(5)h的最简单氢化物的分子空间构型为
(6)已知周期表中存在对角相似规则,如b与g在周期表中处于对角线位置则化学性质相似,b的氧化物、氢氧化物也有两性,写出b的氢氧化物与f的氢氧化物反应的化学方程式
(7)m和n比较:第一电离能
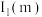
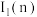 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】过渡元素铂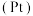 的单质是一种重要的催化剂,其化合物可用于医药领域。
的单质是一种重要的催化剂,其化合物可用于医药领域。
(1)基态 的价层电子排布式是
的价层电子排布式是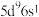 ,该元素在元素周期表中位于第
,该元素在元素周期表中位于第___________ 周期。
(2) 的晶胞示意图如下。
的晶胞示意图如下。___________ 。
②该晶体中,每个铂原子周围与它最近且等距离的铂原子有___________ 个。
(3)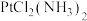 是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为
是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为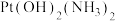 ,但只有甲的水解产物能与草酸
,但只有甲的水解产物能与草酸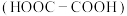 反应生成
反应生成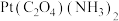 。
。
①根据相似相溶的规律,可推断___________ (填“甲”或“乙”)在水中的溶解度较大。
②依据上述信息:___________ ,可推断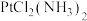 不是四面体结构。
不是四面体结构。
③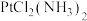 发生水解反应的化学方程式是
发生水解反应的化学方程式是___________ 。
④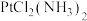 和
和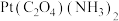 中铂的配体数不同,但配位数均为4,是由于每个
中铂的配体数不同,但配位数均为4,是由于每个 中有
中有___________ 个原子与铂配位。
⑤查阅资料可知,甲、乙均为平面结构。画出乙的水解产物的空间结构并推测其不能与草酸反应生成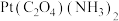 的原因:
的原因:___________ 。
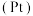 的单质是一种重要的催化剂,其化合物可用于医药领域。
的单质是一种重要的催化剂,其化合物可用于医药领域。(1)基态
 的价层电子排布式是
的价层电子排布式是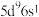 ,该元素在元素周期表中位于第
,该元素在元素周期表中位于第(2)
 的晶胞示意图如下。
的晶胞示意图如下。
②该晶体中,每个铂原子周围与它最近且等距离的铂原子有
(3)
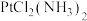 是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为
是铂的重要配位化合物。它有甲、乙两种同分异构体,其中甲为极性分子,乙为非极性分子。甲、乙的水解产物化学式均为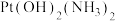 ,但只有甲的水解产物能与草酸
,但只有甲的水解产物能与草酸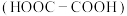 反应生成
反应生成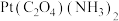 。
。①根据相似相溶的规律,可推断
②依据上述信息:
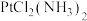 不是四面体结构。
不是四面体结构。③
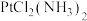 发生水解反应的化学方程式是
发生水解反应的化学方程式是④
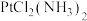 和
和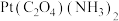 中铂的配体数不同,但配位数均为4,是由于每个
中铂的配体数不同,但配位数均为4,是由于每个 中有
中有⑤查阅资料可知,甲、乙均为平面结构。画出乙的水解产物的空间结构并推测其不能与草酸反应生成
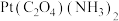 的原因:
的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】以软锰矿(主要成分为 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:
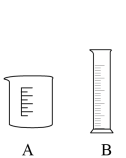
(1)为准确量取 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为_______ (填标号)。


(2)已知 的结构式如图所示:
的结构式如图所示: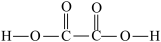 。
。
①0.1mol 分子中含有的σ键的数目为
分子中含有的σ键的数目为_______ 。
② 分子中有
分子中有_______ 种非极性键。
③有机物大多难溶于水,而 可与水互溶的原因为
可与水互溶的原因为_______
(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是_______ (元素填符号),基态原子有3个未成对电子的元素有_______ 种。
(4)该样品纯度的计算式为_______ (用含a、c、 、
、 、
、 的代数式表示)。
的代数式表示)。
 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:(1)为准确量取
 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为


(2)已知
 的结构式如图所示:
的结构式如图所示: 。
。①0.1mol
 分子中含有的σ键的数目为
分子中含有的σ键的数目为②
 分子中有
分子中有③有机物大多难溶于水,而
 可与水互溶的原因为
可与水互溶的原因为(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是
(4)该样品纯度的计算式为
 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料等方面都有应用。反应CHCl3+H2O2→COCl2+HCl+H2O可以制备光气。试回答:
(1)CH4和Cl2发生取代反应可以得到CH2Cl2、CHCl3和CCl4液体混合物,分离提纯的方法是______ 。
(2)H2O2的电子式为______ ,属于______ 分子(填极性或非极性)。
(3)光气的结构式为 中心原子C的杂化方式为
中心原子C的杂化方式为______ ,分子中含有______ 个σ键,______ 个π键。
(4)沸点:CHCl3______ H2O2(填“>”或“<”),原因是_____ 。
(1)CH4和Cl2发生取代反应可以得到CH2Cl2、CHCl3和CCl4液体混合物,分离提纯的方法是
(2)H2O2的电子式为
(3)光气的结构式为
 中心原子C的杂化方式为
中心原子C的杂化方式为(4)沸点:CHCl3
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
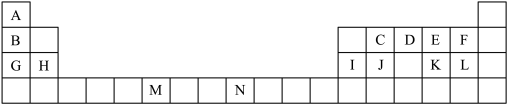
试回答下列问题:
(1)表中元素,电负性最强的是_______ (填元素符号),J的元素名称为_______ 。N基态原子核外能级上有_______ 未成对电子。
(2)D元素原子的价电子排布图为_______ ,核外有_______ 种不同运动状态的电子。该元素形成的常见单质分子中σ键和π键个数比为_______
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是_______ (填“极性”或“非极性”)分子。
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是_______ (填字母)。
a. b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH

试回答下列问题:
(1)表中元素,电负性最强的是
(2)D元素原子的价电子排布图为
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是
(4)C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是
a.
 b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
b.CH4 c.CH2=CHCH3 d.CH3CH2C≡CH
您最近一年使用:0次
【推荐3】镍(Ni)、钴(Co) 、钛(Ti)是重要的金属,在材料科学等领域应用广泛。
(1)Ni在元素周期表中的位置是_______ , 其价电子层中有______ 个未成对电子。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于______ ( 填“极性”“非极性”)分子,其立体构型为_______ 。
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有_ (填字母)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

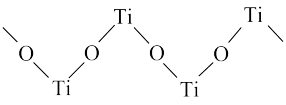
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为____ 。阴离子 中硫原子的杂化方式为
中硫原子的杂化方式为________ ,写出一种与 互为等电子体的分子:
互为等电子体的分子:_______ 。
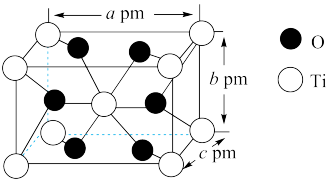
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=______ (用NA表示阿伏加 德罗常数的数值,用含M、a、b、c、NA的代数式表示)g·cm-3。
(1)Ni在元素周期表中的位置是
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属于
(3)铁、钴、镍三种元素并称铁系元素,它们的性质相似。某含镍化合物的结构如图所示,则分子内不可能含有
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键

(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式为
 中硫原子的杂化方式为
中硫原子的杂化方式为 互为等电子体的分子:
互为等电子体的分子:
(5)自然界的钛主要以金红石(主要成分为TiO2 )的形式存在。TiO2的晶胞属于四方晶系,其长方体结构如图所示,已知TiO2的摩尔质量为Mg·mol-1,阿伏加 德罗常数的数值为NA,根据图中所示数据可知该晶体的密度ρ=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,其中A是最轻的元素;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为 ;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
(1)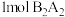 分子中有
分子中有_______  个
个 键、
键、_______  个
个 键。
键。
(2)比较熔沸点:BD_______ (填“高于”、“低于”或“等于”) 原因是
原因是_______ 。
(3)基态E原子中电子占据的最高能级的原子轨道形状为_______ ,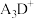 的立体构型为
的立体构型为_______ 。
(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为_______ ,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难的原因是
再失去一个电子更难的原因是_______ 。
 ;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:
;E元素的原子只有两种形状的电子云,最外层只有一种自旋方向的电子;F元素原子有5个未成对电子;G元素基态的正三价离子的3d轨道为半充满状态。请回答下列问题:(1)
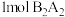 分子中有
分子中有 个
个 键、
键、 个
个 键。
键。(2)比较熔沸点:BD
 原因是
原因是(3)基态E原子中电子占据的最高能级的原子轨道形状为
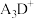 的立体构型为
的立体构型为(4)F是正常机体必需的微量元素之一,它构成体内若干种有重要作用的酶。F在元素周期表中的位置为
 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子更难的原因是
再失去一个电子更难的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
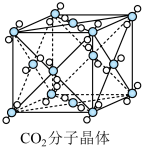
【推荐2】如图为干冰的晶胞结构:
(1)观察图形,确定在干冰中每个CO2分子周围有_______ 个与之紧邻且等距离的CO2分子,该结构单元平均占有_______ 个CO2分子。
(2)在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为_______ ,反应的化学方程式是_______ 。_______ CS2,填“>”或“<”),其原因是_______ 。
(4)在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是_______ 。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4molC—O键
(1)观察图形,确定在干冰中每个CO2分子周围有
(2)在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为
(4)在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4molC—O键
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)  nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________ ;2 min末时Y的浓度为______________ ;化学方程式中n的值是________ 。
(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________ kJ的能量。
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是______________ ,甲烷与水相比较稳定的是__________ ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:____ 。
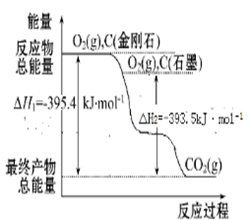
②碳有多种同素异形体,C60所属的晶体类型为__________ ,熔化时克服的作用力为 ____ ;金刚石属于____ 晶体,熔化时破坏的作用力是_________ ; 金刚石、石墨的能量关系如图所示,则金刚石和石墨相比,________ 更稳定。
 nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:
②碳有多种同素异形体,C60所属的晶体类型为

您最近一年使用:0次



