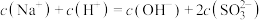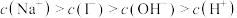醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1 mol/L醋酸钡溶液中粒子浓度的比较,其中不正确的是
| A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-) |
| C.c(H+)=c(OH-)-c(CH3COOH) |
| D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH) |
13-14高二上·福建三明·期末 查看更多[7]
(已下线)2012-2013学年福建省三明一中、二中高二上学期期末联考化学试卷(已下线)2013届上海市长宁、嘉定区高三下学期二模化学试卷2017届湖南师大附中高三上学期入学摸底考试化学试卷2017届贵州省凯里一中高三上第四次模拟化学试卷苏教版高三单元精练检测八化学试题重庆市第一中学2017-2018学年高二上学期期中考试化学试题步步为赢 高二化学寒假作业:作业十 离子浓度大小比较
更新时间:2016-12-09 04:13:51
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是A.向 的 的 溶液中滴加氨水至中性,铵根离子数为 溶液中滴加氨水至中性,铵根离子数为 |
B.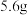 铁粉与标况下 铁粉与标况下 的 的 充分反应,转移的电子数目为 充分反应,转移的电子数目为 |
C.密闭容器中通入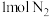 与足量 与足量 充分反应,生成的 充分反应,生成的 分子数目为 分子数目为 |
D.25℃,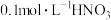 溶液 溶液 由水电离出的 由水电离出的 数目为 数目为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】室温下,将两种浓度均为0.1 mol/L的溶液等体积混合,若溶液混合引起的体积变化可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
A.NaHCO3-Na2CO3混合溶液(pH=10.30):c(Na+)>c(OH-)>c( )>c( )>c( ) ) |
B.氨水-NH4Cl混合溶液(pH=9.25):c( )+c(H+)=c(NH3∙H2O)+c(OH-) )+c(H+)=c(NH3∙H2O)+c(OH-) |
| C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+) |
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+ c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是


| A.a点溶液中,水电离出的c(H+)=1×10-10mol•L-1 |
| B.b点溶液中,水电离出的c(H+)=1×10-7mol•L-1 |
C.c点溶液中,c(Na+)>c(HCO )>c(CO )>c(CO ) ) |
D.d点溶液中,c(Na+)=2c(CO )+c(HCO )+c(HCO ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
| A.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CH3COO-) |
| C.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
您最近一年使用:0次

 溶液中:
溶液中: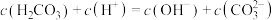
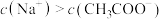
 溶液中:
溶液中: