元素周期表中第四周期元素形成的化合物性质丰富,回答下列问题:
(1)复兴号高铁车体材质用到 、
、 等元素。
等元素。 的一种配合物化学式为
的一种配合物化学式为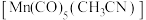 ,下列说法正确的是___________(填字母标号)。
,下列说法正确的是___________(填字母标号)。
(2)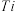 能形成化合物
能形成化合物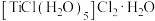 ,在该化合物中不含
,在该化合物中不含___________ (填字母标号)。
A. 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键
(3) 中
中 的键角比
的键角比 的键角
的键角___________ (填“大”或“小”)原因是___________ 。
(4)在 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃___________ 吡咯(填“高于”或“低于”),原因是___________ 。
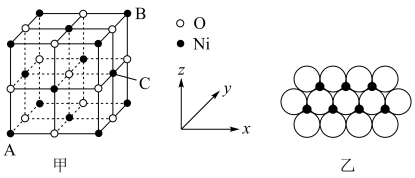
(5) 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为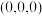 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为___________ 。一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为___________ g(用含a、 的代数式表示)。
的代数式表示)。
(1)复兴号高铁车体材质用到
 、
、 等元素。
等元素。 的一种配合物化学式为
的一种配合物化学式为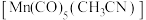 ,下列说法正确的是___________(填字母标号)。
,下列说法正确的是___________(填字母标号)。A. 与 与 原子配位时,提供孤电子对的是C原子 原子配位时,提供孤电子对的是C原子 |
B. 原子的配位数为6 原子的配位数为6 |
C. 中C原子的杂化类型为 中C原子的杂化类型为 |
D. 中 中 键与 键与 键数目之比为5∶2 键数目之比为5∶2 |
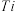 能形成化合物
能形成化合物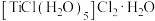 ,在该化合物中不含
,在该化合物中不含A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键(3)
 中
中 的键角比
的键角比 的键角
的键角(4)在
 催化作用下,呋喃(
催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( )。二者熔、沸点关系为:呋喃
)。二者熔、沸点关系为:呋喃(5)
 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为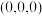 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为
,设阿伏加德罗常数值为 ,每平方米面积上具有该晶体的质量为
,每平方米面积上具有该晶体的质量为 的代数式表示)。
的代数式表示)。
更新时间:2022-07-10 17:02:32
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为__________ 。铁、钴、镍的基态原子核外未成对电子数最多的是________ 。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是_________ ,配体分子的价层电子对互斥模型________ 。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体____________ ,1mol Ni(CO)4含有的配位键数目为_______ 。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO__________ FeO(填“>”“<”或“=”),原因是_____________ 。
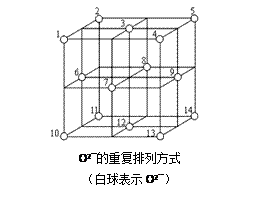
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为___________ ,有___________ %的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g/cm3,则该晶胞参数a = _______________ pm。(写出计算表达式)
(1)基态铁原子的价电子排布式为
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的 [Co(NH3)6]Cl3晶体。该配合物中中心离子是
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253 K,沸点为376 K,则Ni(CO)4固体属于晶体
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁系元素是人体必需的微量元素,Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________ 。
(2)与SCN−互为等电子体且为非极性分子的化学式为_____________ (任写一种)。
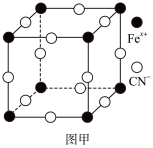
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________ 。
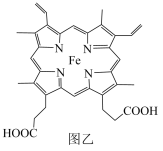
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________
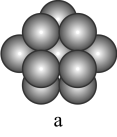
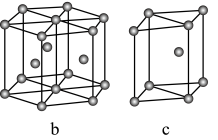
(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________ ;晶胞是图中的_________________ (填a、b或c);配位数是__________________ ;晶胞的体积是2acm3,镁单质的密度为ρg·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________ 。
(1)Fe3+的基态核外电子排布式为
(2)与SCN−互为等电子体且为非极性分子的化学式为
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为


(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷汉和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。
①基态Co原子核外价电子排布图为___ ;
②基态氧原子中,电子占据的最高能层符号为___ ;该能层能量最高的能级电子云在空间有___ 个伸展方向。
(2)[Co(NO3)4]2-的配体中N原子的杂化方式为___ ,写出一种与NO 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为___ ,1mol该配离子中含σ键数目为___ NA。
(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
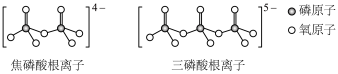
这类磷酸根离子的化学式可用通式表示为____ (用n代表P原子数)。
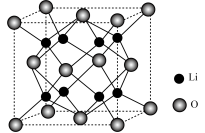
(4)①Li2O被广泛用作玻璃的组分,其熔点高于Na2O,原因是___ 。
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为anm,NA为阿伏加 德罗常数的值,则Li2O的密度为___ g·cm−3。
(1)LiCoO2、LiFePO4常用作锂离子电池的正极材料。
①基态Co原子核外价电子排布图为
②基态氧原子中,电子占据的最高能层符号为
(2)[Co(NO3)4]2-的配体中N原子的杂化方式为
 互为等电子体的阴离子化学式为
互为等电子体的阴离子化学式为(3)LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为
(4)①Li2O被广泛用作玻璃的组分,其熔点高于Na2O,原因是
②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为anm,NA为阿伏加 德罗常数的值,则Li2O的密度为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】高纯四氧化三锰是电子工业生产锰锌氧软磁材料重要原料之一,以菱锰矿(主要成分为 ,含
,含 和少量
和少量 等元素)为原料制备四氧化三锰工艺流程如图所示。
等元素)为原料制备四氧化三锰工艺流程如图所示。
(1)酸浸时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)滤渣2的主要成分为___________ (填化学式)。
(3)福美钠的化学式为 生成福美镍沉淀的结构为
生成福美镍沉淀的结构为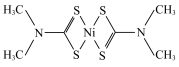 。则各原子之间的结合方式有下列中的
。则各原子之间的结合方式有下列中的___________ (填标号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键
(4)除钙镁时,若使 沉淀完全(浓度小于
沉淀完全(浓度小于 ),溶液中
),溶液中 最小为
最小为___________  。[已知:
。[已知:
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带___________ 电荷(填“正”或“负”)。
(6) 在空气中被氧化生成
在空气中被氧化生成 的化学方程式为
的化学方程式为___________ 。
(7) 可表示为
可表示为 ,温度高于
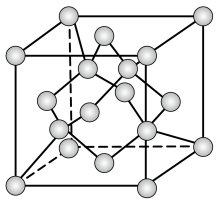
,温度高于 时属于立方晶体,其中
时属于立方晶体,其中 占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为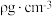 ,则晶胞棱长a=
,则晶胞棱长a=___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含 和少量
和少量 等元素)为原料制备四氧化三锰工艺流程如图所示。
等元素)为原料制备四氧化三锰工艺流程如图所示。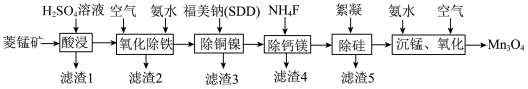
(1)酸浸时
 发生反应的离子方程式为
发生反应的离子方程式为(2)滤渣2的主要成分为
(3)福美钠的化学式为
 生成福美镍沉淀的结构为
生成福美镍沉淀的结构为 。则各原子之间的结合方式有下列中的
。则各原子之间的结合方式有下列中的A.离子键 B.金属键 C.氢键 D.配位键 E.极性键
(4)除钙镁时,若使
 沉淀完全(浓度小于
沉淀完全(浓度小于 ),溶液中
),溶液中 最小为
最小为 。[已知:
。[已知:
(5)除硅时,絮凝剂为阳离子型聚丙烯酰胺,可通过“吸附—电中和—架桥”使硅酸胶体絮凝沉淀,硅酸胶体粒子带
(6)
 在空气中被氧化生成
在空气中被氧化生成 的化学方程式为
的化学方程式为(7)
 可表示为
可表示为 ,温度高于
,温度高于 时属于立方晶体,其中
时属于立方晶体,其中 占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若
占据晶胞的顶点、面心及内部交错的4个小立方体的体心,与金刚石晶胞中碳原子占据的位置相似(金刚石晶胞如图所示)。若 晶体的密度为
晶体的密度为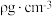 ,则晶胞棱长a=
,则晶胞棱长a= (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2•6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为___ 。
(2)NO 中氮原子轨道的杂化类型是
中氮原子轨道的杂化类型是__ 。
(3)与HNO2互为等电子体的一种阴离子的化学式为___ 。
(4)配合物[Mn(CH3OH)6]2+中配位原子是___ 。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有___ 。
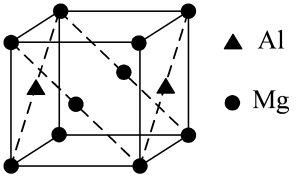
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___ ,该立方晶胞的晶胞的密度为dg·cm-3,设阿伏加德罗常数的值为NA,则该晶胞中镁铝之间的最近距离为___ pm。(列出计算式,可不化简)。
(1)Mn3+基态核外电子排布式为
(2)NO
 中氮原子轨道的杂化类型是
中氮原子轨道的杂化类型是(3)与HNO2互为等电子体的一种阴离子的化学式为
(4)配合物[Mn(CH3OH)6]2+中配位原子是
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】钴的化合物在工业中有重要用途。请回答下列问题:
(1) 中配体NH3为
中配体NH3为___________ (填“极性”或“非极性”)分子,NH3分子中N-H键的键角___________ (填“>”、“<”或“=”) 中N-H键的键角,原因为
中N-H键的键角,原因为___________ 。
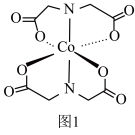
(2)Co的一种配合物结构如图1,其配位数为___________ ,C、N、O的第一电离能由大到小的顺序为___________ (填元素符号),其中C原子的杂化方式为___________ 。 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。___________ 。
②与O原子最近且等距离的O原子有___________ 个。
③该晶体的密度为___________ g·cm-3。
(1)
 中配体NH3为
中配体NH3为 中N-H键的键角,原因为
中N-H键的键角,原因为(2)Co的一种配合物结构如图1,其配位数为
 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。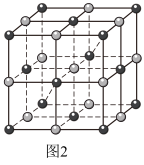
②与O原子最近且等距离的O原子有
③该晶体的密度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以废铜为原料(主要成分是Cu,含少量Fe2O3)制备胆矾和Fe2O3的工艺流程如图。回答下列问题:
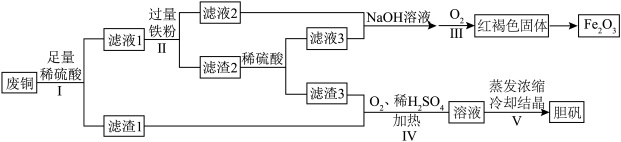
(1)“滤渣3”与浓硫酸反应的化学方程式是_______ 。
(2)早在1000多年前,我国就采用胆矾分解产生SO3,SO3再与水反应生产硫酸,随着生产力的发展,硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。
①下列说法正确的是_______ 。
A.高温下胆矾分解有可能产生四种气体(SO2、O2、SO3、H2O)
B.框图工艺中氧化亚铁可以替代过量铁粉,且得到的滤液2一定具有强酸性
C.现代工艺,制取发烟硫酸是用98.3%浓硫酸吸收SO3
D.工业出厂硫酸一般质量分数大于92%是厂家用92%的浓硫酸稀释发烟硫酸得到的
E.在彩画工程中红褐色固体和胆矾可分别作为红色和蓝色油漆
②步骤V用无水酒精洗涤胆矾的理由是_________ 。
③步骤Ⅳ在酸性条件下O2氧化性增强的原因是_________ 。
(3)设计实验鉴定滤液1中的金属阳离子:_________ 。

(1)“滤渣3”与浓硫酸反应的化学方程式是
(2)早在1000多年前,我国就采用胆矾分解产生SO3,SO3再与水反应生产硫酸,随着生产力的发展,硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。
①下列说法正确的是
A.高温下胆矾分解有可能产生四种气体(SO2、O2、SO3、H2O)
B.框图工艺中氧化亚铁可以替代过量铁粉,且得到的滤液2一定具有强酸性
C.现代工艺,制取发烟硫酸是用98.3%浓硫酸吸收SO3
D.工业出厂硫酸一般质量分数大于92%是厂家用92%的浓硫酸稀释发烟硫酸得到的
E.在彩画工程中红褐色固体和胆矾可分别作为红色和蓝色油漆
②步骤V用无水酒精洗涤胆矾的理由是
③步骤Ⅳ在酸性条件下O2氧化性增强的原因是
(3)设计实验鉴定滤液1中的金属阳离子:
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐2】一种多巴胺D封端的聚氨酯材料(L)可用作医用粘合剂,其合成路线如下:
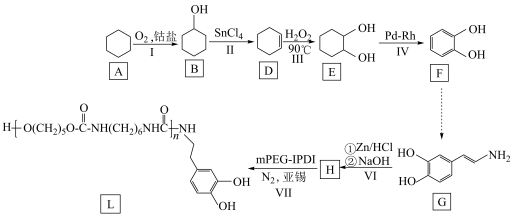
回答下列问题:
(1)化合物D所含的官能团名称是_____ 。
(2)反应Ⅲ的反应类型是_____ ,
(3)写出反应Ⅱ的化学方程式_____ 。
(4)相同条件下,E在水中的溶解度_____ (填“大于”或“小于”)环己烷在水中的溶解度,并说明原因_____ 。
(5)反应I的副产物 为环状化合物,环上的一氯代物有3种,该副反应产物的结构简式为
为环状化合物,环上的一氯代物有3种,该副反应产物的结构简式为_____ 。
(6)写出满足下列条件的G的同分异构体中的两种_____
A.与G具有相同官能团 B.苯环上只有两种类型的氢原子

回答下列问题:
(1)化合物D所含的官能团名称是
(2)反应Ⅲ的反应类型是
(3)写出反应Ⅱ的化学方程式
(4)相同条件下,E在水中的溶解度
(5)反应I的副产物
 为环状化合物,环上的一氯代物有3种,该副反应产物的结构简式为
为环状化合物,环上的一氯代物有3种,该副反应产物的结构简式为(6)写出满足下列条件的G的同分异构体中的两种
A.与G具有相同官能团 B.苯环上只有两种类型的氢原子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】砷化镓(GaAs)是优良的半导体材料,其晶体结构与单晶硅相似。
(1)基态Ga原子的价电子排布式为___________ ,其同周期元素中未成对电子数最多的是___________ (填元素符号)。
(2)GaAs可用 (常温下为无色液体)和
(常温下为无色液体)和 高温反应制得,同时生成另一种产物,写出反应方程式
高温反应制得,同时生成另一种产物,写出反应方程式___________ ,另一种产物中心原子的杂化类型为___________ 。
(3)沸点
___________  (填“>”、“<”、“=”),原因是
(填“>”、“<”、“=”),原因是___________ 。
(4)GaAs的晶胞结构如图所示,键角___________ ,若晶胞中距离最近的两个Ga原子距离为a nm,阿伏加德罗常数的值为 ,则GaAs的密度为
,则GaAs的密度为___________  。
。
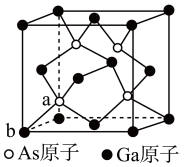
(1)基态Ga原子的价电子排布式为
(2)GaAs可用
 (常温下为无色液体)和
(常温下为无色液体)和 高温反应制得,同时生成另一种产物,写出反应方程式
高温反应制得,同时生成另一种产物,写出反应方程式(3)沸点

 (填“>”、“<”、“=”),原因是
(填“>”、“<”、“=”),原因是(4)GaAs的晶胞结构如图所示,键角
 ,则GaAs的密度为
,则GaAs的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
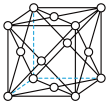
【推荐1】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)、Cr等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是_______ ,基态Cr原子的价电子的电子排布式为_______ 。
(2)C、N、O的第一电离能由大到小的顺序为_______ 。
(3)SO2分子的VSEPR构型为_______ ;SO3分子中心原子的杂化形式为_______ ;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_______ ,分子中的σ键和π键数目之比是_______ 。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键_______ (填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是_______ 。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为_______ ,属于_______ 晶体。
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为_______ g/cm3(列出计算式)。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是
(2)C、N、O的第一电离能由大到小的顺序为
(3)SO2分子的VSEPR构型为
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)YX 的立体构型是
的立体构型是____________ ;与YX 互为等电子体的一种分子为
互为等电子体的一种分子为________ (填化学式)。
(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为_______ ;1 mol RX(WH2)2分子中含有σ键数目为________ 。(H为氢元素,下同)
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为_______ 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于____ (填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为________ cm(只写计算式)(Z原子位于体对角线上)。
(1)YX
 的立体构型是
的立体构型是 互为等电子体的一种分子为
互为等电子体的一种分子为(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为
(3)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。

①该晶体的化学式为
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于
③已知该晶体的密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】(1)31Ga基态原子的核外电子排布式是___________ 。C、N、O三种元素第一电离能从大到小的顺序是____________ 。写出一种与 OH- 互为等电子体的分子为_________________ (填化学式)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_________ ;N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________ (填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
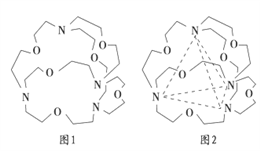
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________ (填标号)。
a. CF4 b. NH4+ c.CH4 d. H2O
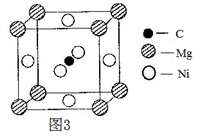
(3)最近发现,只含C、Mg和Ni三种元素的某种晶体具有超导性。该晶体的一个晶胞如图3所示,则该晶体的化学式为___________ 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是
②肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
③图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是
a. CF4 b. NH4+ c.CH4 d. H2O

(3)最近发现,只含C、Mg和Ni三种元素的某种晶体具有超导性。该晶体的一个晶胞如图3所示,则该晶体的化学式为

您最近一年使用:0次



