金属钪可用作宇航材料、火箭和飞机的制造材料;氧化钪可提高计算机记忆元件性能。铅土矿(主要成分Al2O3)经碱初步溶解后得到的赤泥含有丰富的钪元素,另含有CaO、Fe2O3、SiO2、Al2O3等氧化物。一种从赤泥中提取氧化钪的工艺流程如下图所示(P2O4是一种磷酸酯尽取剂)。
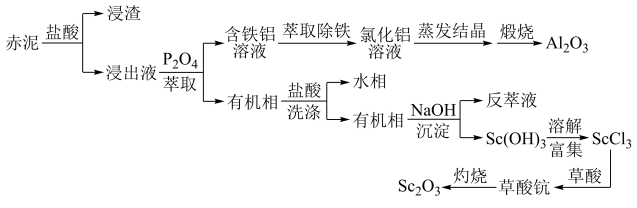
回答下列问题:
(1)写出钪原子的价电子排布式:___________ 。
(2)写出铝土矿经碱初步溶解时所发生的主要离子方程式:___________ 。
(3)写出赤泥经盐酸处理后所得“浸渣”的一种用途:___________ 。
(4)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时P2O4最佳浓度及料液温度分别为___________ 、___________ 。
P2O4浓度对萃取率的影响:
料液温度对分离系数的影响:

(5)AlCl3常以Al2Cl6分子存在,已知Al2Cl6分子中各个原子均达到8电子稳定结构,则Al2Cl6分子的结构式为___________ 。
(6)反萃取时,Sc3+完全沉淀(浓度为1.0×10-6mol/L)时,反萃液的pH为___________ 。(已知:Ksp[Sc(OH)3]=8.00×10-31,lg2=0.30,结果保留小数点后2位有效数字)
(7)草酸钪灼烧分解反应方程式为___________ 。
(8)在流程中可循环使用的物质有___________ 。

回答下列问题:
(1)写出钪原子的价电子排布式:
(2)写出铝土矿经碱初步溶解时所发生的主要离子方程式:
(3)写出赤泥经盐酸处理后所得“浸渣”的一种用途:
(4)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时P2O4最佳浓度及料液温度分别为
P2O4浓度对萃取率的影响:
| 试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1-1 | 1 | 分相快 | 90.76 | 15.82 |
| 1-2 | 2 | 分相容易 | 91.53 | 19.23 |
| 1-3 | 3 | 分相容易 | 92.98 | 13.56 |
| 1-4 | 4 | 有第三相 | 90.69 | 30.12 |
| 1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |

(5)AlCl3常以Al2Cl6分子存在,已知Al2Cl6分子中各个原子均达到8电子稳定结构,则Al2Cl6分子的结构式为
(6)反萃取时,Sc3+完全沉淀(浓度为1.0×10-6mol/L)时,反萃液的pH为
(7)草酸钪灼烧分解反应方程式为
(8)在流程中可循环使用的物质有
更新时间:2022-08-03 16:33:49
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】H2S在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为_____________ 。
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为________ 。
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=________ (溶液体积变化忽略不计)。
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g) H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
表中x=________ 。
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。

①随着温度升高,CO的平衡体积分数_____ (填“增大”或“减小”)。原因为_______
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为_____ ;反应ⅰ的平衡常数为_____ (保留两位有效数字)。
Ⅰ.工业上一种制备H2S的方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。
(1)该反应的化学方程式为
Ⅱ.H2S可用于检测和沉淀金属阳离子。
(2)H2S的第一步电离方程式为
(3)已知:25 ℃时,Ksp(SnS)=1.0×10-25,Ksp(CdS)=8.0×10-27。该温度下,向浓度均为0.1 mol·L-1的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=
Ⅲ.H2S是煤化工原料气脱硫过程的重要中间体。反应原理为
ⅰ.COS(g)+H2(g)
 H2S(g)+CO(g) ΔH=+7 kJ·mol-1;
H2S(g)+CO(g) ΔH=+7 kJ·mol-1;ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-42 kJ·mol-1。
CO2(g)+H2(g) ΔH=-42 kJ·mol-1。(4)已知:断裂1 mol分子中的化学键所需吸收的能量如表所示。
| 分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
| 能量/(kJ·mol-1) | 1 319 | 442 | x | 678 | 930 | 1 606 |
表中x=
(5)向10 L容积不变的密闭容器中充入1 mol COS(g)、1 mol H2(g)和1 mol H2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。

①随着温度升高,CO的平衡体积分数
②T1℃时,测得平衡时体系中COS的物质的量为0.80 mol。则该温度下,COS的平衡转化率为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】大苏打( )易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易变质。某实验小组用下列装置制备
)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易变质。某实验小组用下列装置制备 并探究其性质。
并探究其性质。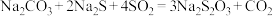 ;
;
② 中S元素的化合价为-2、+6。
中S元素的化合价为-2、+6。
回答下列问题:
(1)给装置A加热应选择_______ (填“水浴”或“酒精灯”)加热。
(2)为了保证 的产量,实验中通入的
的产量,实验中通入的 不能过量,需控制装置A中
不能过量,需控制装置A中 的生成速率,采取的措施是
的生成速率,采取的措施是_______ 。
(3)配制 和
和 混合溶液时,先将
混合溶液时,先将 固体溶于水配成溶液,再将
固体溶于水配成溶液,再将 固体溶于
固体溶于 溶液中,其目的是
溶液中,其目的是_______ 。
(4) 性质的探究。
性质的探究。
①称取一定量的样品,溶解,配成 溶液。
溶液。
②取4mL溶液,向其中加入1mL饱和氯水( ),溶液立即出现浑浊,经检验浑浊物为S。
),溶液立即出现浑浊,经检验浑浊物为S。
假设1:氧化剂氧化: 、HClO等含氯的氧化性微粒氧化了硫元素。
、HClO等含氯的氧化性微粒氧化了硫元素。
假设2:_______(不考虑空气中氧气氧化)。
设计实验方案:
①假设2是_______ 。
②第Ⅱ组实验中胶头滴管加入的试剂是_______ ,发生反应的离子方程式为_______ 。
③依据现象,产生S的主要原因可能是_______ 。
 )易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易变质。某实验小组用下列装置制备
)易溶于水,难溶于乙醇,在中性和碱性环境中稳定,在酸性环境中易变质。某实验小组用下列装置制备 并探究其性质。
并探究其性质。
 ;
;②
 中S元素的化合价为-2、+6。
中S元素的化合价为-2、+6。回答下列问题:
(1)给装置A加热应选择
(2)为了保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量,需控制装置A中
不能过量,需控制装置A中 的生成速率,采取的措施是
的生成速率,采取的措施是(3)配制
 和
和 混合溶液时,先将
混合溶液时,先将 固体溶于水配成溶液,再将
固体溶于水配成溶液,再将 固体溶于
固体溶于 溶液中,其目的是
溶液中,其目的是(4)
 性质的探究。
性质的探究。①称取一定量的样品,溶解,配成
 溶液。
溶液。②取4mL溶液,向其中加入1mL饱和氯水(
 ),溶液立即出现浑浊,经检验浑浊物为S。
),溶液立即出现浑浊,经检验浑浊物为S。
假设1:氧化剂氧化:
 、HClO等含氯的氧化性微粒氧化了硫元素。
、HClO等含氯的氧化性微粒氧化了硫元素。假设2:_______(不考虑空气中氧气氧化)。
设计实验方案:
| 实验组别 | 胶头滴管滴加试剂 | 现象 |
| 第I组 | 1mL饱和氯水 | 立即出现浑浊 |
| 第Ⅱ组 | _______ | 一段时间后出现浑浊,但浑浊度比第I组小,且有少量气泡生成 |
②第Ⅱ组实验中胶头滴管加入的试剂是
③依据现象,产生S的主要原因可能是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】 是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Mg等杂质)为原料生产 ,继而生产
,继而生产 的工艺流程如图:
的工艺流程如图:

已知:①
②当溶液中某离子浓度小于 时,可认为该离子已完全沉淀
时,可认为该离子已完全沉淀
③流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有___________ (写出两条即可)。
(2)加入 的目的是(用离子方程式表示)
的目的是(用离子方程式表示)___________ 。
(3)“除铁”时,控制溶液pH的范围为___________ 。
(4)滤渣B的主要成分的化学式为___________ 。
(5)在“沉镍”操作中,为确保镍沉淀完全,溶液中 浓度应大于
浓度应大于___________  。 (已知:
。 (已知: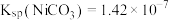 )。
)。
(6)“氧化”生成 的离子方程式为
的离子方程式为___________ 。生成的 需过滤,洗涤,干燥得到初产品,检验洗涤干净的操作是
需过滤,洗涤,干燥得到初产品,检验洗涤干净的操作是___________ 。
 是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Mg等杂质)为原料生产
是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Mg等杂质)为原料生产 ,继而生产
,继而生产 的工艺流程如图:
的工艺流程如图:
已知:①

②当溶液中某离子浓度小于
 时,可认为该离子已完全沉淀
时,可认为该离子已完全沉淀③流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有
(2)加入
 的目的是(用离子方程式表示)
的目的是(用离子方程式表示)(3)“除铁”时,控制溶液pH的范围为
(4)滤渣B的主要成分的化学式为
(5)在“沉镍”操作中,为确保镍沉淀完全,溶液中
 浓度应大于
浓度应大于 。 (已知:
。 (已知: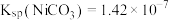 )。
)。(6)“氧化”生成
 的离子方程式为
的离子方程式为 需过滤,洗涤,干燥得到初产品,检验洗涤干净的操作是
需过滤,洗涤,干燥得到初产品,检验洗涤干净的操作是
您最近半年使用:0次
【推荐1】软锰矿的主要成分MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4•H2O的流程如图
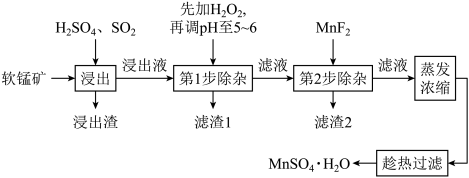
已知:部分金属阳离子完全沉淀时的pH如下表
(1)Mn的价层电子排布式为_______ 。
(2)“浸出”过程中MnO2转化为Mn2+的离子方程式为_______ 。
(3)第1步除杂中H2O2涉及的离子方程式_______ ;形成滤渣1的主要成分为_______ (填化学式),调pH至5~6所加的试剂,可选择_______ (填字母)。
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:_______ ,该反应的平衡常数为_______ (结果保留一位小数)(已知:MnF2的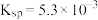 ;CaF2的
;CaF2的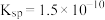 ;MgF2的
;MgF2的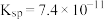 。)
。)
(5)取少量MnSO4∙H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是_______ (用离子方程式表示)。

已知:部分金属阳离子完全沉淀时的pH如下表
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Mg2+ |
| 完全沉淀时的pH | 3.2 | 5.2 | 10.4 | 12.4 |
(1)Mn的价层电子排布式为
(2)“浸出”过程中MnO2转化为Mn2+的离子方程式为
(3)第1步除杂中H2O2涉及的离子方程式
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:
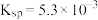 ;CaF2的
;CaF2的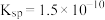 ;MgF2的
;MgF2的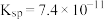 。)
。)(5)取少量MnSO4∙H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】已知NH4VO3在pH=7~8时溶解度最小。某工厂利用钒铬渣提取液(主要成分为NaVO3和Na2CrO4)制备Na2CrO4和NH4VO3晶体,流程如图:
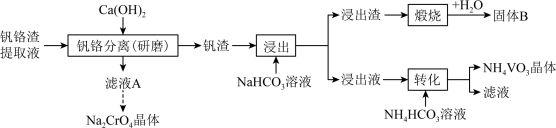
不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是____ 。
(2)从滤液A中获取Na2CrO4晶体时,应采用的结晶方法为____ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤,用Na2SO3溶液还原时,还原产物为Cr3+,则反应的离子方程式____ ;为了使c(Cr3+)不高于1×10-6mol·L-1,“沉降”时应调节pH____ [该温度下Cr(OH)3的Ksp近似为1×10-30]。
(3)“浸出”过程中生成NaVO3的离子方程式为____ 。

不同温度下相关物质的溶解度
| NaVO3 | Na2CrO4 | Ca3(VO4)2 | CaCrO4 | |
| 20℃ | 19.3 | 84.0 | 0.1 | 5.5 |
| 40℃ | 22.5 | 96.5 | 0.09 | 2.49 |
| 60℃ | 26.3 | 102 | 0.09 | 1.3 |
| A.研磨可防止生成的沉淀覆在Ca(OH)2表面,提高Ca(OH)2利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
| C.相对于20℃、40℃,工业上更宜选用60℃ |
| D.该过程发生了氧化还原反应 |
(3)“浸出”过程中生成NaVO3的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】研究从含锌资源中获取Zn的途径具有重要意义。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。
ⅰ.几种难溶电解质的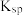
ⅱ.浸出液中主要金属阳离子浓度
(1)浸出渣的主要成分有 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是___________ 。
(2)加入试剂a的目的是___________ 。
(3)电解前,含 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于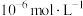 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)___________ 。
Ⅱ.实验室中氨浸提锌
ⅲ.

ⅳ.M的结构简式如图所示,R为 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是___________ 。
(5)M能与 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。
①补全图中X的结构并用“…”标出氢键_______ 。 的萃取,原因可能是
的萃取,原因可能是___________ 。
(6)从平衡移动的角度解释 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:___________ 。
Ⅰ.工业上酸浸提锌
氧化锌矿中含有ZnO、
 、FeO、PbO、
、FeO、PbO、 、CaO、
、CaO、 等。
等。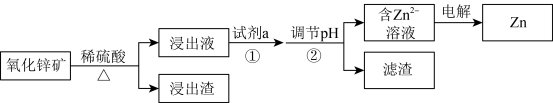
ⅰ.几种难溶电解质的
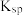
| 难溶电解质 |  |  |  |  |
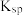 |  |  | 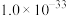 |  |
| 粒子 |  |  和Fe 和Fe | Al |
| 浓度(mol/L) | 0.3 | 0.1 | 0.1 |
(1)浸出渣的主要成分有
 、
、 和
和 。PbO和
。PbO和 反应的离子方程式是
反应的离子方程式是(2)加入试剂a的目的是
(3)电解前,含
 溶液中铁和铝的离子浓度均需小于
溶液中铁和铝的离子浓度均需小于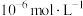 ,应调节pH的范围是(忽略①和②导致的体积变化)
,应调节pH的范围是(忽略①和②导致的体积变化)Ⅱ.实验室中氨浸提锌
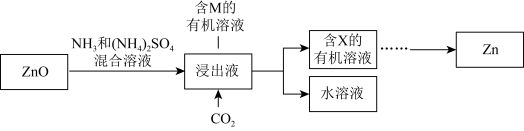
ⅲ.


ⅳ.M的结构简式如图所示,R为
 ,两个羟基中、酚羟基酸性较强。
,两个羟基中、酚羟基酸性较强。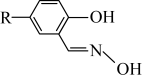
 浸取ZnO发生反应的离子方程式是
浸取ZnO发生反应的离子方程式是(5)M能与
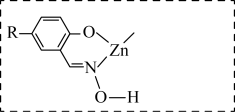
 形成稳定的配合物X,相关反应为
形成稳定的配合物X,相关反应为 。
。①补全图中X的结构并用“…”标出氢键
 的萃取,原因可能是
的萃取,原因可能是(6)从平衡移动的角度解释
 能提高有机溶液中X含量的原因:
能提高有机溶液中X含量的原因:
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】已知铜的配合物A的结构如图所示,请回答下列问题:
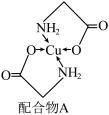
(1)基态Cu原子的价电子轨道表示式为_______ , 的稳定性
的稳定性____  (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是___________ 。
(2)A中所含H、C、N、O四种元素的电负性大小顺序为___________ ,其中氧原子的电子排布式为___________ 。
(3)配体氨基乙酸根(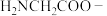 )受热分解可产生
)受热分解可产生 和
和 ,
, 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为___________ ;原子总数和价电子数相等的两种粒子互为等电子体,其中互为等电子体的粒子结构相似,COS与 互为等电子体,则COS的电子式为
互为等电子体,则COS的电子式为___________ 。
(4)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:

①已知晶胞参数为a pm,计算晶胞的密度为___________  (列出计算式)。
(列出计算式)。
②Sn原子周围与之距离最近且相等的Cu原子的数目___________ 个。

(1)基态Cu原子的价电子轨道表示式为
 的稳定性
的稳定性 (填“大于”或“小于”),原因是
(填“大于”或“小于”),原因是(2)A中所含H、C、N、O四种元素的电负性大小顺序为
(3)配体氨基乙酸根(
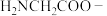 )受热分解可产生
)受热分解可产生 和
和 ,
, 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为 互为等电子体,则COS的电子式为
互为等电子体,则COS的电子式为(4)磷青铜是含少量锡、磷的铜合金,某磷青铜晶胞结构如图所示:

①已知晶胞参数为a pm,计算晶胞的密度为
 (列出计算式)。
(列出计算式)。②Sn原子周围与之距离最近且相等的Cu原子的数目
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】完成下列问题
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式___________ ;H、B、N中,原子半径最大的是___________ 。
② 分子中
分子中___________ (填“存在”或“不存在”)配位键。
③氨硼烷在一定条件下和水发生如下反应: ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由___________ 变为___________ ;反应涉及的N、B、O三种元素的第一电离能从大到小的顺序为___________ 。
(2) 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
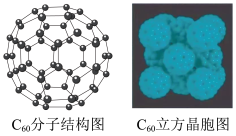
① 晶体属于
晶体属于___________ 晶体,每个 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为___________ 个;
②凸多面体中有欧拉定理:顶点+面-棱边=2,则 分子中的五边形数目为
分子中的五边形数目为___________ ,六边形的数目为___________ ;
(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为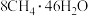 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,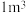 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下___________  甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式
②
 分子中
分子中③氨硼烷在一定条件下和水发生如下反应:
 ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由
(2)
 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
①
 晶体属于
晶体属于 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为②凸多面体中有欧拉定理:顶点+面-棱边=2,则
 分子中的五边形数目为
分子中的五边形数目为(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为
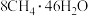 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,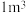 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下 甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
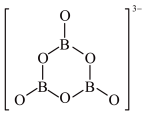
【推荐3】Ⅰ.主族元素能形成多种化合物,它们是探测器、激光器、微波器的重要材料。
(1)氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为___________ ,电子重排后的氧原子能量有所升高,原因是不符合___________ (填“泡利原理”或“洪特规则”)。
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是___________ 。
(3)NH3与BF3气体相遇发生反应生成F3B-NH3晶体
①F3B-NH3晶体中,B原子的杂化轨道类型为___________ 。
②F3B-NH3晶体中不存在的作用力有___________ 。
a.σ键 b.π键 c.离子键 d.配位键 e.范德华力
(4)已知:
解释表中物质之间沸点差异的原因___________ 。
Ⅱ.储氢合金能有效解决氢气的储存和运输,对大规模使用氢能具有重要意义。
(5)某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示。M是___________ (填元素符号),判断理由是___________ 。
(6)过渡金属Q与镧(La)形成的合金也是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1;该合金的晶胞结构和z轴方向的投影图如图所示。
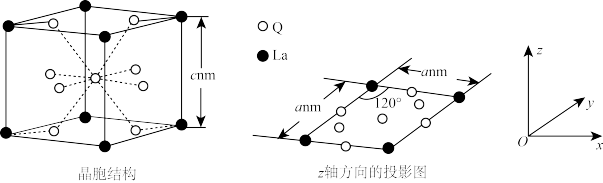
若阿伏加德罗常数的值为NA,则该合金的密度ρ=___________ g·cm-3(用含a、c、NA的代数式表示,列出计算式即可)。
(1)氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ·mol-1) | 389 | 561 | 293 |
①F3B-NH3晶体中,B原子的杂化轨道类型为
②F3B-NH3晶体中不存在的作用力有
a.σ键 b.π键 c.离子键 d.配位键 e.范德华力
(4)已知:
| 物质 | AsF3 | AsCl3 | BiF3 |
| 沸点/℃ | 62.8 | 130.2 | 900.0 |
Ⅱ.储氢合金能有效解决氢气的储存和运输,对大规模使用氢能具有重要意义。
(5)某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示。M是
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |

若阿伏加德罗常数的值为NA,则该合金的密度ρ=
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)FeS2的化学名称为___________ ,在___________ 矿中含量丰富。
(2)焙烧过程中产生SO2的化学方程式为___________ ,用足量NaOH溶液吸收SO2的离子方程式为___________ 。
(3)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
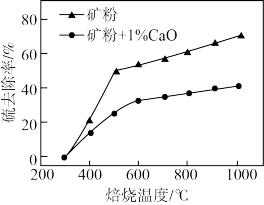
已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1- )×100%
)×100%
700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是___________ 。(用化学方程式解释)
(4)“碱浸”后的溶液中,铝元素存在的形式为___________ (填化学式),“过滤”所需的实验仪器有___________ 。
(5)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应生成的n(Fe3O4)∶n(SO2)=___________ 。

(1)FeS2的化学名称为
(2)焙烧过程中产生SO2的化学方程式为
(3)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃;硫去除率=(1-
 )×100%
)×100%700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(4)“碱浸”后的溶液中,铝元素存在的形式为
(5)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应生成的n(Fe3O4)∶n(SO2)=
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】我国是世界上最早制得和使用金属锌的国家,一种以含锌废料(主要含ZnO、PbO、CuO及少量FeO、MnO)生产锌及氧化锌的流程如图所示:
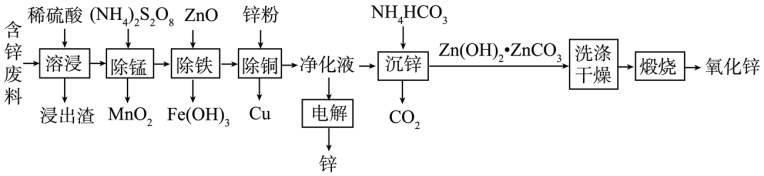
回答下列问题:
(1)“溶浸”时适当升温的目的是_______ ,浸出渣的主要成分为_______ (填化学式)
(2)“除锰”时,Mn2+被氧化生成MnO2,写出该反应的离子方程式。_______ 。
(3)“除铁”时,加入ZnO的作用为_______ 。
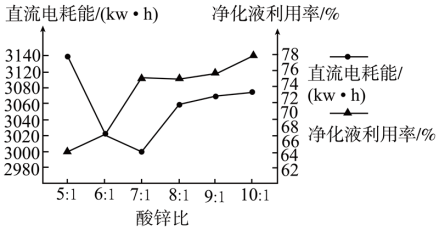
(4)下图是“电解”时不同酸锌比对净化液利用率和直流电耗能影响关系图,在净化废液时的最佳酸锌比为_______ ,电解后所得溶液可返回_______ 工序继续使用。
(5)“沉锌”时,反应的离子方程式为_______ 检验Zn(OH)2·ZnCO3已洗涤干净的方法是_______

回答下列问题:
(1)“溶浸”时适当升温的目的是
(2)“除锰”时,Mn2+被氧化生成MnO2,写出该反应的离子方程式。
(3)“除铁”时,加入ZnO的作用为
(4)下图是“电解”时不同酸锌比对净化液利用率和直流电耗能影响关系图,在净化废液时的最佳酸锌比为

(5)“沉锌”时,反应的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
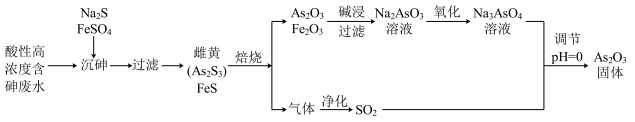
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________ ,“沉砷”中所用Na2S的电子式为_____________ 。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33- ;“沉砷”中FeSO4的作用是
2AsS33- ;“沉砷”中FeSO4的作用是___________________________ 。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________ 。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________ 。
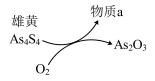
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________ 。(填化学式)
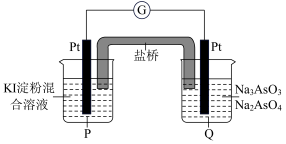
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________ 。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________ (举一例)。

回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33- ;“沉砷”中FeSO4的作用是
2AsS33- ;“沉砷”中FeSO4的作用是(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为


(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O
 AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为
您最近半年使用:0次



