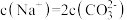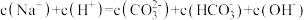常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl—)+c(ClO—)+c(OH—) |
| B.pH=8.3的某酸式盐NaHB的水溶液中:c(Na+)>c(HB—)>c(H2B)>c(B2—) |
| C.等物质的量浓度的Na2S和NaHS溶液中:c(Na+)=2c(S2—) +c(HS—) |
D.0.2 mol·L-1NaHCO3与0.1 mol·L-1KOH溶液等体积混合:c(Na+)=2c( )+c( )+c( ) +c(H2CO3) ) +c(H2CO3) |
更新时间:2022-04-11 10:13:15
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法不正确的是
A.浓度均为 的 的 和 和 混合溶液中: 混合溶液中: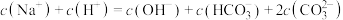 |
B.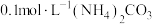 溶液中: 溶液中: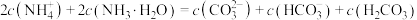 |
C.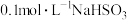 溶液(室温: 溶液(室温: )中: )中: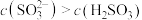 |
D.浓度均为 的 的 和 和 混合溶液中(室温: 混合溶液中(室温: ) )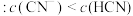 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】25℃时,用HCl气体调节0.1mol•L-1氨水的pH,系统中微粒浓度的对数值(lgc)与pH的关系如图1所示,反应物的物质的量之比[x= ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是
]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是
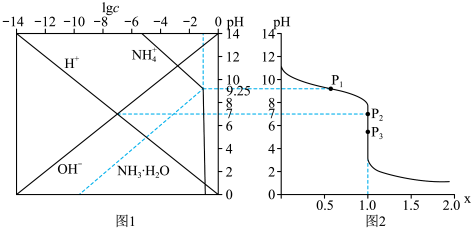
 ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是
]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是
| A.P1所示溶液:c(Cl-)=0.05mol•L-1 |
| B.P2所示溶液:c(NH3•H2O)>c(OH-)+c(Cl-) |
C.P3所示溶液:c( )+c(NH3•H2O)=c(Cl-)+c(H+) )+c(NH3•H2O)=c(Cl-)+c(H+) |
| D.25℃时,NH3•H2O的电离平衡常数为10-4.75 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】标准状况下,将2.24L NH3通入1L 0.1mol/L的甲酸溶液中,欲确定所得溶液中NH4+、HCOO-、H+和OH-浓度大小顺序,通过下列数据即可得出正确结论的是
①NH3·H2O和HCOOH的电离常数 ②NH3·H2O和HCOONH4的电离常数
③溶液的pH
①NH3·H2O和HCOOH的电离常数 ②NH3·H2O和HCOONH4的电离常数
③溶液的pH
| A.不需任何数据 |
| B.必需知道①、②、③三组数据 |
| C.只需知道①、③中的任一组数据 |
| D.只需知道①、②、③中的任一组数据 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在常温下,向0.1mol·L1HR酸溶液中滴加NaOH溶液。混合溶液中存在c(HR)+c(R)=0.1mol·L1,c(HR)、c(R)随溶液pH变化曲线如图所示。下列说法错误的是
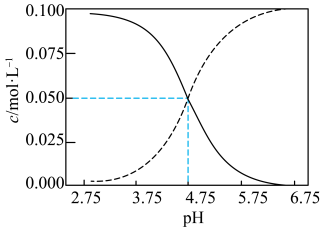

| A.pH=4对应溶液中存在:c(HR)>c(R)>c(H)>c(OH) |
| B.随着c(R)增大,水的电离程度逐渐增大 |
| C.在2L纯水中同时加入0.1molHR、0.1molNaR得到溶液pH=4.75 |
D.常温下,R的水解常数Kh(已知:Kh=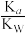 )的数量级为1010 )的数量级为1010 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】25 ℃时,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。下列说法错误的是( )
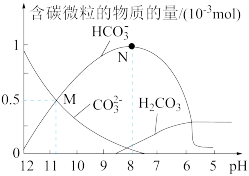

| A.HCl溶液滴加一半时,溶液pH>7 |
| B.H2CO3的Ka1的数量级为10-6 |
| C.pH=8时,溶液中NaHCO3的物质的量浓度为0.1 mol·L-1 |
D.在M点:c(Na+)>c(CO )=c(HCO )=c(HCO )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
您最近一年使用:0次

 溶液中,下列关系正确的是
溶液中,下列关系正确的是