在298K时,研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ、C2H6(g) C2H4(g)+H2(g)ΔH1=+136kJ·mol-1
C2H4(g)+H2(g)ΔH1=+136kJ·mol-1
Ⅱ、C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1
C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1
Ⅲ、C2H6(g)+2CO2(g) 4CO(g)+3H2(g)ΔH3=+430kJ·mol-1
4CO(g)+3H2(g)ΔH3=+430kJ·mol-1
Ⅳ、CO2(g)+H2(g) CO(g)+H2O(g)ΔH4
CO(g)+H2O(g)ΔH4
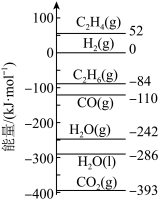
已知:298K时,相关物质的相对能量如图1所示。根据以上信息和数据进行回答下列问题。
(1)①根据相关物质的相对能量计算ΔH4=___________ kJ·mol-1。
②下列描述正确的是___________ (填字母)。
A.升高温度反应Ⅰ的反应速率和平衡常数均增大
B.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
C.恒温恒压下通入惰性气体,反应Ⅰ的平衡正向移动
D.反应Ⅳ中当压强恒定不变时,该反应达到平衡状态
E.以上四个反应中,ΔH不变时,以上反应均达到平衡状态
(2)CO2和C2H6按物质的量1∶1投料,在923K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如表:
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是___________ ,判断依据是___________ 。
(3)H2可以用碳和水蒸气反应制取,反应的热化学方程式为C(s)+H2O(g) CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
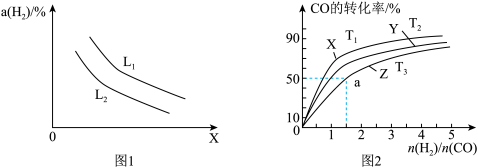
①X表示___________ (填“温度”或“压强”),L1___________ L2(填“>”“<”或“=”)。
②已知CO与H2能合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为
CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为___________ 。(KP表示生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压=总压强×该物质的物质的量分数)。

Ⅰ、C2H6(g)
 C2H4(g)+H2(g)ΔH1=+136kJ·mol-1
C2H4(g)+H2(g)ΔH1=+136kJ·mol-1Ⅱ、C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1
C2H4(g)+H2O(g)+CO(g)ΔH2=+177kJ·mol-1Ⅲ、C2H6(g)+2CO2(g)
 4CO(g)+3H2(g)ΔH3=+430kJ·mol-1
4CO(g)+3H2(g)ΔH3=+430kJ·mol-1Ⅳ、CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH4
CO(g)+H2O(g)ΔH4已知:298K时,相关物质的相对能量如图1所示。根据以上信息和数据进行回答下列问题。
(1)①根据相关物质的相对能量计算ΔH4=
②下列描述正确的是
A.升高温度反应Ⅰ的反应速率和平衡常数均增大
B.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
C.恒温恒压下通入惰性气体,反应Ⅰ的平衡正向移动
D.反应Ⅳ中当压强恒定不变时,该反应达到平衡状态
E.以上四个反应中,ΔH不变时,以上反应均达到平衡状态
(2)CO2和C2H6按物质的量1∶1投料,在923K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如表:
| 催化剂 | 转化率C2H6/% | 转化率CO2/% | 产率C2H4/% |
| 催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是
(3)H2可以用碳和水蒸气反应制取,反应的热化学方程式为C(s)+H2O(g)
 CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
CO(g)+H2(g)ΔH>0。一定条件下达到平衡时,温度、压强对H2产率的影响如图1所示。
①X表示
②已知CO与H2能合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为
CH3OH(g)。在恒压容器中,曲线X、Y、Z分别表示在T1、T2、T3三种温度下合成甲醇气体的过程,控制不同的原料投料比,CO的平衡转化率如图2所示:若温度为T3时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=3:2,则该反应的压强平衡常数KP的计算式为
更新时间:2022-09-01 16:52:54
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=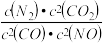 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ ;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________ 。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
①0~5min内,以CO2表示的该反应速率v(CO2)=______ ,该条件下的平衡常数K=________ 。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______ 移动(填“正向”“逆向”或“不”);最终达平衡时NO的转化率a=______________ 。
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____ 沉淀(填化学式),当两种沉淀共存时,溶液中c(Mg2+)/c(Cu2+)=__________ (已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)。
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=
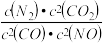 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
②第15 min后,温度调整到T2,数据变化如上表所示,则T1
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应
(3)在25 ℃下,向浓度均0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】丙烯是工业上合成精细化学品的原料,随者天然气和页岩气的可用性不断提高,丙烷脱氢和丙烷氧化脱氢受到人们越来越多的关注。
(1)已知 、丙烷(
、丙烷( )和丙烯(
)和丙烯( )的燃烧热分别是
)的燃烧热分别是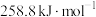 、
、 和
和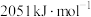 ,则丙烷脱氢反应的热化学方程式为
,则丙烷脱氢反应的热化学方程式为

_______ 。该反应在_______ (填“高温”“低温”或“任意温度”)时能自发进行。
(2)北京交通大学王熙教授团队制备了一种新型含氧硼氮纳米管( )用于高效丙烷氧化脱氢反应,其主要副产物是经
)用于高效丙烷氧化脱氢反应,其主要副产物是经 反应生成的乙烯(
反应生成的乙烯( )和甲烷(
)和甲烷( )。
)。
①一定温度下,向恒容容器中充入一定量 ,在BONNTs催化作用下,发生上述反应制备
,在BONNTs催化作用下,发生上述反应制备 ,下列情况表明反应达到平衡状态的是
,下列情况表明反应达到平衡状态的是_______ 。
A.气体密度不再改变
B.混合气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等
②T℃下,在2L容器中充入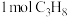 ,
, 后达到平衡状态时,
后达到平衡状态时, 转化率为50%,
转化率为50%, 选择性为80%,则
选择性为80%,则 的消耗速率
的消耗速率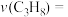
_______ ,丙烷脱氢反应的平衡常数K=_______ 。(已知 选择性
选择性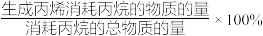 )
)
(3)①在BONNTs催化作用下,反应相同时间后, 和
和 产率与温度关系曲线如图所示,最佳反应温度是
产率与温度关系曲线如图所示,最佳反应温度是_______ ,理由是_______ 。
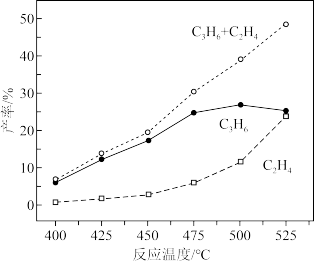
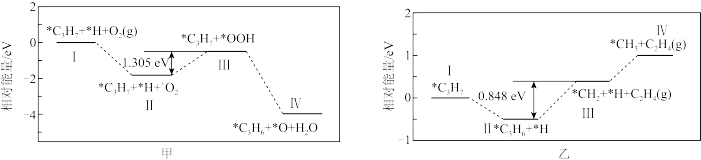
②温度高于T℃时,生成 和
和 的反应机理分别如下图甲和乙所示,则该温度范围内
的反应机理分别如下图甲和乙所示,则该温度范围内 选择性降低的原因是
选择性降低的原因是_______ 。
(1)已知
 、丙烷(
、丙烷( )和丙烯(
)和丙烯( )的燃烧热分别是
)的燃烧热分别是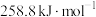 、
、 和
和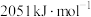 ,则丙烷脱氢反应的热化学方程式为
,则丙烷脱氢反应的热化学方程式为

(2)北京交通大学王熙教授团队制备了一种新型含氧硼氮纳米管(
 )用于高效丙烷氧化脱氢反应,其主要副产物是经
)用于高效丙烷氧化脱氢反应,其主要副产物是经 反应生成的乙烯(
反应生成的乙烯( )和甲烷(
)和甲烷( )。
)。①一定温度下,向恒容容器中充入一定量
 ,在BONNTs催化作用下,发生上述反应制备
,在BONNTs催化作用下,发生上述反应制备 ,下列情况表明反应达到平衡状态的是
,下列情况表明反应达到平衡状态的是A.气体密度不再改变
B.混合气体平均摩尔质量不再改变
C.体系压强不再改变
D.单位时间内消耗
 的物质的量与生成
的物质的量与生成 的物质的量相等
的物质的量相等②T℃下,在2L容器中充入
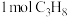 ,
, 后达到平衡状态时,
后达到平衡状态时, 转化率为50%,
转化率为50%, 选择性为80%,则
选择性为80%,则 的消耗速率
的消耗速率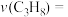
 选择性
选择性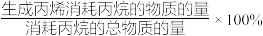 )
)(3)①在BONNTs催化作用下,反应相同时间后,
 和
和 产率与温度关系曲线如图所示,最佳反应温度是
产率与温度关系曲线如图所示,最佳反应温度是
②温度高于T℃时,生成
 和
和 的反应机理分别如下图甲和乙所示,则该温度范围内
的反应机理分别如下图甲和乙所示,则该温度范围内 选择性降低的原因是
选择性降低的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在工业生产中用N2和H2合成NH3“N2(g)+3H2(g) 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g) 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为__ 。
(2)合成NH3达到平衡后,某时刻改变下列条件__ (填字母),在达到新平衡的过程中正反应速率始终增大。
A.升温B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)
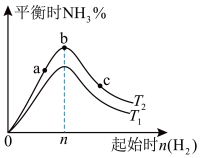
①图象中T2和T1的关系是:T2__ T1(填“>”“<”“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是__ (填字母)。
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为__ mol·L-1。
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
上表中a、b、80%三者的大小关系为___ 。(填“>”“=”“<”或“无法比较”)
 2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
2NH3(g) ΔH<0”,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=akJ·mol-1(a>0)
N2(g)+3H2(g)
 2NH3(g) ΔH2=-bkJ·mol-1
2NH3(g) ΔH2=-bkJ·mol-12H2(g)+O2(g)=2H2O(g) ΔH3=-ckJ·mol-1
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
(2)合成NH3达到平衡后,某时刻改变下列条件
A.升温B.加压
C.增大c(N2) D.降低c(NH3)
(3)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响。实验结果如图所示:(图中T表示温度,n表示起始时H2物质的量)

①图象中T2和T1的关系是:T2
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2、N2的转化率均为60%,则平衡时N2的物质的量浓度为
(4)一定温度下,将2molN2和4molH2置于1L的恒容密闭容器中反应,测得不同条件、不同时间段内合成NH3反应中N2的转化率,得到数据如下表:
| 时间 N2转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
您最近一年使用:0次
【推荐1】根据所学知识,回答下列问题;
I.在2L密闭容器内,800℃时反应 体系中,n(NO)随时间的变化如下表:
体系中,n(NO)随时间的变化如下表:
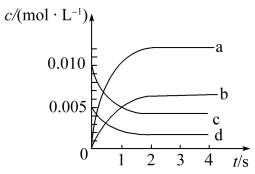
(1)图中表示 变化曲线的是
变化曲线的是_______ (填字母)。
(2)800℃,反应达到平衡时,NO的转化率是_______ 。
(3)用 表示0~2s内该反应的平均速率
表示0~2s内该反应的平均速率
_______ 。
(4)该反应进行到1s时放出的热量为akJ( ),则热化学方程式
),则热化学方程式

_______ 。
II.将一定量纯净的氨基甲酸铵( )置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: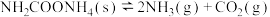
(5)只改变一个条件,能使该反应的速率增大的是_______(填标号,下同)。
(6)下列能判断该分解反应已经达到化学平衡状态的是_______ 。
①
②密闭容器中 的物质的量不变
的物质的量不变
③容器中 与
与 的物质的量之比保持不变
的物质的量之比保持不变
④ 的体积分数保持不变
的体积分数保持不变
III.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式:
负极反应: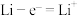
正极反应: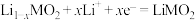
(7)该锂离子电池放电时,总反应的方程式为_______ 。
I.在2L密闭容器内,800℃时反应
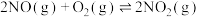 体系中,n(NO)随时间的变化如下表:
体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)图中表示
 变化曲线的是
变化曲线的是(2)800℃,反应达到平衡时,NO的转化率是
(3)用
 表示0~2s内该反应的平均速率
表示0~2s内该反应的平均速率
(4)该反应进行到1s时放出的热量为akJ(
 ),则热化学方程式
),则热化学方程式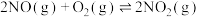

II.将一定量纯净的氨基甲酸铵(
 )置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: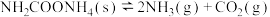
(5)只改变一个条件,能使该反应的速率增大的是_______(填标号,下同)。
A.及时分离出 气体 气体 | B.适当升高温度 |
C.再加入少量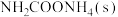 | D.选择高效催化剂 |
①

②密闭容器中
 的物质的量不变
的物质的量不变③容器中
 与
与 的物质的量之比保持不变
的物质的量之比保持不变④
 的体积分数保持不变
的体积分数保持不变III.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式:
负极反应:
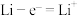
正极反应:
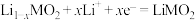
(7)该锂离子电池放电时,总反应的方程式为
您最近一年使用:0次
【推荐2】根据题意回答下列问题。
 .银作为催化剂,用途广泛,通过氨浸水合肼还原法可回收失效的银。
.银作为催化剂,用途广泛,通过氨浸水合肼还原法可回收失效的银。
(1)用氯化钠溶液沉淀银离子可以发生下列反应:
①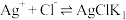
②
③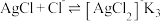
则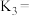
___________ (用 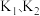 表示)。
表示)。
(2)常温下氨浸水合肼还原法浸取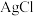 ,首先要用氨水溶解
,首先要用氨水溶解 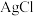 ,写出氨水溶解
,写出氨水溶解 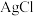 的离子方程式为
的离子方程式为___________ 。
II.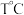 下,分别向体积均为
下,分别向体积均为 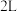 的恒温恒容密闭容器甲和绝热恒容密闭容器乙中加入
的恒温恒容密闭容器甲和绝热恒容密闭容器乙中加入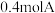 、0.8mol B,发生反应
、0.8mol B,发生反应  , 两容器中
, 两容器中  的转化率随时间的变化如图所示。
的转化率随时间的变化如图所示。___________ (填"甲“或”乙”)容器。
(4)a点的v正___________ b点的v逆(填“大于”、“小于”或“等于”)。
(5)下列能判断甲、乙两个装置均达到平衡状态的是___________ 。
①容器内压强保持不变
② 的浓度不变
的浓度不变
③容器内密度保持不变
④单位时间内生成 ,同时消耗
,同时消耗 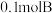
(6)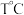 下,该反应的平衡常数
下,该反应的平衡常数 
___________ 。
 .银作为催化剂,用途广泛,通过氨浸水合肼还原法可回收失效的银。
.银作为催化剂,用途广泛,通过氨浸水合肼还原法可回收失效的银。(1)用氯化钠溶液沉淀银离子可以发生下列反应:
①
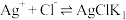
②

③
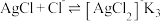
则
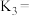
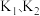 表示)。
表示)。(2)常温下氨浸水合肼还原法浸取
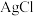 ,首先要用氨水溶解
,首先要用氨水溶解 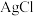 ,写出氨水溶解
,写出氨水溶解 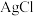 的离子方程式为
的离子方程式为II.
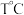 下,分别向体积均为
下,分别向体积均为 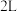 的恒温恒容密闭容器甲和绝热恒容密闭容器乙中加入
的恒温恒容密闭容器甲和绝热恒容密闭容器乙中加入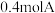 、0.8mol B,发生反应
、0.8mol B,发生反应  , 两容器中
, 两容器中  的转化率随时间的变化如图所示。
的转化率随时间的变化如图所示。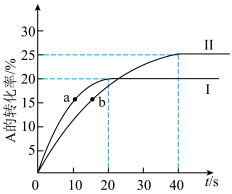
(4)a点的v正
(5)下列能判断甲、乙两个装置均达到平衡状态的是
①容器内压强保持不变
②
 的浓度不变
的浓度不变③容器内密度保持不变
④单位时间内生成
 ,同时消耗
,同时消耗 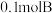
(6)
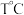 下,该反应的平衡常数
下,该反应的平衡常数 
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(一)环氧乙烷(EO)是一种重要的化工原料,可用于生产乙二醇、乙醇胺等化工产品,目前乙烯直接氧化法被广泛应用于环氧乙烷的生产并得到广泛关注。制备环氧乙烷工艺装置如图: ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:
主反应①:2CH2=CH2(g)+O2(g)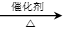 2
2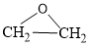 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:CH2=CH2(g)+3O2(g)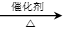 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2 (g)+5O2(g)
(g)+5O2(g) 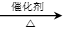 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;
副反应④: (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol
已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=______ kJ/mol;
(2)下列有关环氧乙烷制备说法不正确的是______
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛
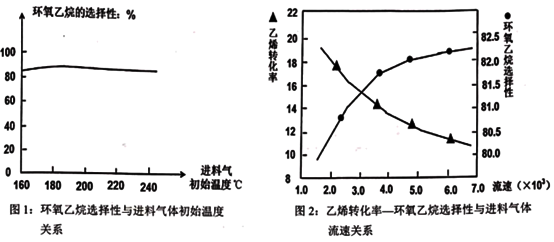
(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:
请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:______ 。
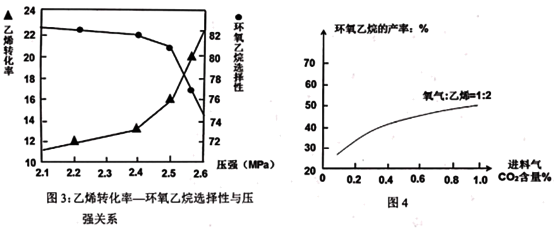
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线_______ 。
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:__________ ;
(2)写出b电极区域生成环氧丙烷的化学方程式:__________ 。
 ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:主反应①:2CH2=CH2(g)+O2(g)
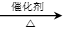 2
2 (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;副反应②:CH2=CH2(g)+3O2(g)
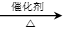 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;副反应③:2
 (g)+5O2(g)
(g)+5O2(g) 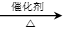 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;副反应④:
 (g)
(g) CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol 已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=
(2)下列有关环氧乙烷制备说法不正确的是
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛

(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:

请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。

(1)写出a电极的电极反应式:
(2)写出b电极区域生成环氧丙烷的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
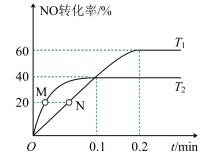
【推荐1】2023年7月1日我国开始实施“国六b”标准,研究汽车尾气中 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将NO氧化为高价态氮氧化物
将NO氧化为高价态氮氧化物 ,反应机理如下:
,反应机理如下:
i)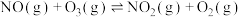
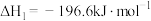
ii)
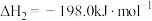
(1)已知反应i的正反应活化能为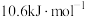 ,则其逆反应的活化能为
,则其逆反应的活化能为_______ 。
(2)在一恒温恒容的容器中发生上述反应i、ii,若增大 的浓度,NO的转化率
的浓度,NO的转化率_______ (填“增大”、“减小”或“不变”);保持恒温恒容,下列描述能说明反应已达到平衡的是_______ 。
A.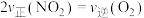
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将NO、 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为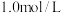 ,若只发生反应i,反应速率
,若只发生反应i,反应速率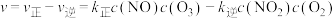 ,其中
,其中 、
、 只与温度及活化能有关,下图是温度为
只与温度及活化能有关,下图是温度为 、
、 时,
时,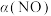 随时间变化图。
随时间变化图。 温度下,
温度下,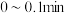 ,反应的平均速率
,反应的平均速率
_______ ,若加入正催化剂, 和
和 均
均_______ (填“变大”、“变小”或“不变”)。M点与N点对应的 的大小关系:M
的大小关系:M_______ N(填“>”、“<”或“=”),N点时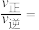
_______ 。
(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为_______ ;对于任何反应,当 时该反应为自发反应,已知该总反应的
时该反应为自发反应,已知该总反应的 ,则该反应在
,则该反应在_______ (填“高温”或“低温”)下能自发进行。
 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将NO氧化为高价态氮氧化物
将NO氧化为高价态氮氧化物 ,反应机理如下:
,反应机理如下:i)
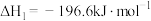
ii)

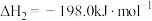
(1)已知反应i的正反应活化能为
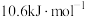 ,则其逆反应的活化能为
,则其逆反应的活化能为(2)在一恒温恒容的容器中发生上述反应i、ii,若增大
 的浓度,NO的转化率
的浓度,NO的转化率A.
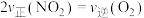
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与
 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将NO、
 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为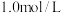 ,若只发生反应i,反应速率
,若只发生反应i,反应速率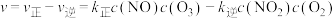 ,其中
,其中 、
、 只与温度及活化能有关,下图是温度为
只与温度及活化能有关,下图是温度为 、
、 时,
时,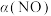 随时间变化图。
随时间变化图。 温度下,
温度下,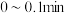 ,反应的平均速率
,反应的平均速率
 和
和 均
均 的大小关系:M
的大小关系:M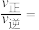

(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的
 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为 时该反应为自发反应,已知该总反应的
时该反应为自发反应,已知该总反应的 ,则该反应在
,则该反应在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.2021年1月7日,我国首个探明储量超千亿方的深层页岩气田——中国石化西南石油局威荣页岩气田一期项目全面建成,对促进成渝地区双城经济圈建设具有重要意义。回答下列问题:
(1)页岩气的主要成分是甲烷(CH4)。已知25℃,101 kPa时,一定质量的甲烷完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得200 g CaCO3沉淀。请写出表示甲烷燃烧热的热化学方程式:___________ 。
(2)用甲烷可以合成乙烯:2CH4(g) C2H4(g)+2H2(g) ΔH=+202 kJ·mol-1,该反应在
C2H4(g)+2H2(g) ΔH=+202 kJ·mol-1,该反应在___________ 下自发进行(填“高温”、“低温”或“任何温度”)。
II.在催化剂作用下由CO2和H2可直接合成乙烯:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH
C2H4(g)+4H2O(g) ΔH
(3)关于该反应,下列叙述正确的是___________(填字母序号)。
(4)在体积为2 L的恒容密闭容器中,加入2 mol CO2和6 mol H2,在催化剂作用下发生乙烯直接合成反应,测得温度对CO2的平衡转化率影响如图所示。

①已知在200℃下,10 min时反应达到平衡状态。则0—10 min内用H2表示的平均反应速率为___________ ;该温度下的平衡常数K=___________ (代入数据列出计算式即可,不用化简)
②若不使用催化剂,则200℃时CO2的平衡转化率位于图中的___________ 点(填“a”、“b”、“c”或“d”)。
(1)页岩气的主要成分是甲烷(CH4)。已知25℃,101 kPa时,一定质量的甲烷完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得200 g CaCO3沉淀。请写出表示甲烷燃烧热的热化学方程式:
(2)用甲烷可以合成乙烯:2CH4(g)
 C2H4(g)+2H2(g) ΔH=+202 kJ·mol-1,该反应在
C2H4(g)+2H2(g) ΔH=+202 kJ·mol-1,该反应在II.在催化剂作用下由CO2和H2可直接合成乙烯:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH
C2H4(g)+4H2O(g) ΔH(3)关于该反应,下列叙述正确的是___________(填字母序号)。
| A.恒温恒容下达到平衡状态时,再充入少量氦气,正逆反应速率不变 |
| B.当混合气体的平均摩尔质量不再发生变化时,反应达到平衡状态 |
| C.当反应达平衡状态时,3v正(H2)=2v逆(H2O) |
| D.其他条件不变,增大压强使容器体积缩小时,反应物浓度增大,反应物的活化分子百分数增大 |

①已知在200℃下,10 min时反应达到平衡状态。则0—10 min内用H2表示的平均反应速率为
②若不使用催化剂,则200℃时CO2的平衡转化率位于图中的
您最近一年使用:0次
【推荐3】工业合成氨反应为N2(g)+3H2(g) 2NH3(g),氨在工农业生产中应用广泛。
2NH3(g),氨在工农业生产中应用广泛。
(1)已知:键能是1mol化学键完全断裂形成气态原子所需要吸收的能量,部分化学键的键能如表格所示。计算每合成2mol 需要
需要___________ (填“放出”或“吸收”)___________ kJ的热量。
(2)实验室中模拟合成氨过程,将1mol 和2.7mol
和2.7mol 置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是
置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是___________ (填写字母序号)。
a.反应不再进行,已经停止 b.单位时间内生成nmol 的同时,消耗3nmol
的同时,消耗3nmol
c.3v正(H2)=2v逆(NH3) d. 、
、 和
和 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2
e.混合气体的压强不再改变 f.混合气体的密度不再改变
若5min时测得氢气浓度为1.05 mol∙L−1,则用氨气表示的0~5min内的平均化学反应速率为___________ ;5min时的体系总压强与初始时的总压强之比为___________ 。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池的工作原理如图所示。b电极的电极反应式是___________ 。

 2NH3(g),氨在工农业生产中应用广泛。
2NH3(g),氨在工农业生产中应用广泛。| 化学键 | H−H | N−H | N≡N |
键能( ) ) | 436 | 391 | 945.6 |
(1)已知:键能是1mol化学键完全断裂形成气态原子所需要吸收的能量,部分化学键的键能如表格所示。计算每合成2mol
 需要
需要(2)实验室中模拟合成氨过程,将1mol
 和2.7mol
和2.7mol 置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是
置于恒温、体积为2L的容器中反应。下列情况可说明该反应已经达到化学平衡状态的是a.反应不再进行,已经停止 b.单位时间内生成nmol
 的同时,消耗3nmol
的同时,消耗3nmol
c.3v正(H2)=2v逆(NH3) d.
 、
、 和
和 的物质的量浓度之比为1:3:2
的物质的量浓度之比为1:3:2e.混合气体的压强不再改变 f.混合气体的密度不再改变
若5min时测得氢气浓度为1.05 mol∙L−1,则用氨气表示的0~5min内的平均化学反应速率为
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池的工作原理如图所示。b电极的电极反应式是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
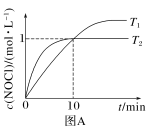
【推荐1】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)⇌2NOCl(g)。
(1)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:___________ mol·L-1·min-1。
②T2时该反应的平衡常数K=___________ 。
③T2时Cl2的平衡转化率为___________ 。
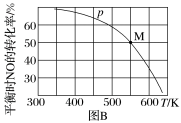
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:___________ (填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为___________ 。
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(1)在1L恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:
②T2时该反应的平衡常数K=
③T2时Cl2的平衡转化率为
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:
②在p压强条件下,M点时容器内NO的体积分数为
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】天然气作为最清洁的化石燃料一直被认为是实现碳平衡附件 中坚力量,将二氧化碳甲烷化可实现资源化利用。
(1)主反应:___________ 。
副反应Ⅰ:

副反应Ⅱ:
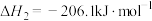
请写出主反应由 加氢直接生成
加氢直接生成 的热化学方程式:
的热化学方程式:___________ 。
(2)向某密闭容器中投入 和
和 ,在不同温度和压强条件下发生
,在不同温度和压强条件下发生 甲烷化反应,
甲烷化反应, 的平衡转化率如图所示:
的平衡转化率如图所示:
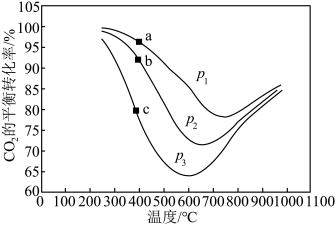
①a、b、c三点比较,主反应 的生成速率
的生成速率 、
、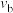 和
和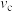 由大到小的顺序为
由大到小的顺序为___________ ,温度高于1000℃时,曲线汇于一点的原因是___________ 。
②已知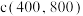 ,若此时
,若此时 的产率为70%,且
的产率为70%,且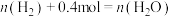 ,则此时
,则此时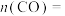
___________ ,副反应Ⅰ的
___________ [保留两位小数,对于反应 ,
,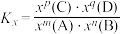 ,
, 为物质的量分数]。
为物质的量分数]。
(3) 甲烷化还可以通过电催化还原法制得。
甲烷化还可以通过电催化还原法制得。
①酸性条件下,以 为原料生成
为原料生成 的反应发生在电解池
的反应发生在电解池___________ 极,电极反应式为___________ 。
②在催化剂M和催化剂N表面发生 甲烷化反应历程如图所示,已知*代表催化剂,
甲烷化反应历程如图所示,已知*代表催化剂, 代表
代表 吸附在催化剂表面,下列说法错误的是
吸附在催化剂表面,下列说法错误的是___________ (填标号)。
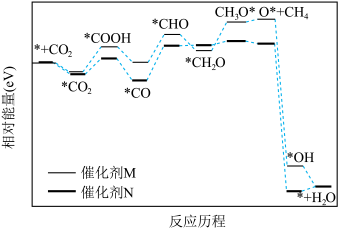
A. 吸附在催化剂表面时放出热量
吸附在催化剂表面时放出热量
B.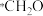 比
比 稳定
稳定
C.使用催化剂N时, 是决速步
是决速步
(1)主反应:
副反应Ⅰ:


副反应Ⅱ:

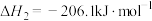
请写出主反应由
 加氢直接生成
加氢直接生成 的热化学方程式:
的热化学方程式:(2)向某密闭容器中投入
 和
和 ,在不同温度和压强条件下发生
,在不同温度和压强条件下发生 甲烷化反应,
甲烷化反应, 的平衡转化率如图所示:
的平衡转化率如图所示:
①a、b、c三点比较,主反应
 的生成速率
的生成速率 、
、 和
和 由大到小的顺序为
由大到小的顺序为②已知
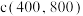 ,若此时
,若此时 的产率为70%,且
的产率为70%,且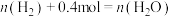 ,则此时
,则此时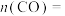

 ,
,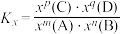 ,
, 为物质的量分数]。
为物质的量分数]。(3)
 甲烷化还可以通过电催化还原法制得。
甲烷化还可以通过电催化还原法制得。①酸性条件下,以
 为原料生成
为原料生成 的反应发生在电解池
的反应发生在电解池②在催化剂M和催化剂N表面发生
 甲烷化反应历程如图所示,已知*代表催化剂,
甲烷化反应历程如图所示,已知*代表催化剂,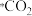 代表
代表 吸附在催化剂表面,下列说法错误的是
吸附在催化剂表面,下列说法错误的是
A.
 吸附在催化剂表面时放出热量
吸附在催化剂表面时放出热量B.
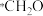 比
比 稳定
稳定C.使用催化剂N时,
 是决速步
是决速步
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化碳的资源化利用是科学家研究的重要课题。回答下列问题:
(1)用 化加氢可以制取乙烯:
化加氢可以制取乙烯:
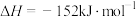
①已知与该反应相关的键能数据如表所示:
则表中H-H键的键能数据为___________ 。
②在恒容密闭容器中,反应温度、投料比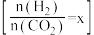 对
对 平衡转化率的影响如图1所示,则a
平衡转化率的影响如图1所示,则a___________ (填“>”“<”或“=”)3;M、N两点的化学平衡常数: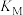
___________ (填“>”“<”或“=”)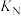 ,判断的理由是
,判断的理由是___________ 。
(2) 与
与 还可合成
还可合成 ,涉及的主要反应如下:
,涉及的主要反应如下:
反应1:
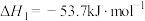
反应2:

①下列措施中,既能提高二氧化碳的平衡转化率又能提高 选择性的是
选择性的是___________ (填字母)。
A.加压 B.降温 C.及时移走甲醇 D.使用合适的催化剂
②当起始投料比 时,在不同条件下只发生反应1且达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下只发生反应1且达到平衡,设体系中甲醇的物质的量分数为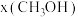 ,T=250 ℃时
,T=250 ℃时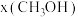 随压强(p)的变化关系及在
随压强(p)的变化关系及在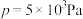 时
时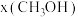 随温度(T)的变化关系如图2所示。
随温度(T)的变化关系如图2所示。
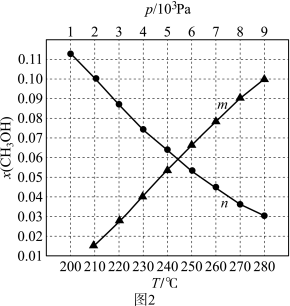
a.图中对应等压过程的曲线是___________ (填“m”或“n”),判断的理由是___________ 。
b.当T=250 ℃、 时,
时, 的平衡转化率α=
的平衡转化率α=___________ (结果精确到0.1%),此条件下该反应的
___________ 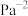 (结果保留3位有效数字,对于气相反应,
(结果保留3位有效数字,对于气相反应, 可以用分压表示,分压=总压×物质的量分数)。
可以用分压表示,分压=总压×物质的量分数)。
(1)用
 化加氢可以制取乙烯:
化加氢可以制取乙烯:
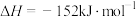
①已知与该反应相关的键能数据如表所示:
| 化学键 | C=O | H-H | C=C | C-H | H-O |
键能/( ) ) | 803 | 764 | 414 | 464 |
则表中H-H键的键能数据为
②在恒容密闭容器中,反应温度、投料比
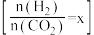 对
对 平衡转化率的影响如图1所示,则a
平衡转化率的影响如图1所示,则a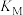
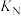 ,判断的理由是
,判断的理由是
(2)
 与
与 还可合成
还可合成 ,涉及的主要反应如下:
,涉及的主要反应如下:反应1:

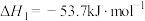
反应2:


①下列措施中,既能提高二氧化碳的平衡转化率又能提高
 选择性的是
选择性的是A.加压 B.降温 C.及时移走甲醇 D.使用合适的催化剂
②当起始投料比
 时,在不同条件下只发生反应1且达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下只发生反应1且达到平衡,设体系中甲醇的物质的量分数为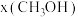 ,T=250 ℃时
,T=250 ℃时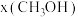 随压强(p)的变化关系及在
随压强(p)的变化关系及在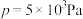 时
时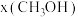 随温度(T)的变化关系如图2所示。
随温度(T)的变化关系如图2所示。
a.图中对应等压过程的曲线是
b.当T=250 ℃、
 时,
时, 的平衡转化率α=
的平衡转化率α=
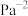 (结果保留3位有效数字,对于气相反应,
(结果保留3位有效数字,对于气相反应, 可以用分压表示,分压=总压×物质的量分数)。
可以用分压表示,分压=总压×物质的量分数)。
您最近一年使用:0次



