完成下列问题。
(1)向 水溶液中加入水,平衡
水溶液中加入水,平衡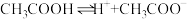 将向
将向_______ ((填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中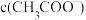 与原平衡时相比
与原平衡时相比____ (填“增大”、“减小”或“不变”),溶液中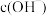 与原平衡时相比
与原平衡时相比____ (填“增大”、“减小”或“不变”)。
(2)25℃时,三种弱电解质的电离平衡常数如表:
①下列方法中,可以使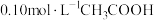 溶液中
溶液中 电离程度增大的是
电离程度增大的是_______ 。
a.通入少量HCl气体 b.加入少量冰醋酸 c.加入少量醋酸钠固体 d.加入少量水
②常温下, 的
的 溶液加水稀释过程,下列表达式的数据一定变小的是
溶液加水稀释过程,下列表达式的数据一定变小的是_______ 。
a.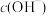 b.
b. c.
c.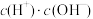 d.
d.
(1)向
 水溶液中加入水,平衡
水溶液中加入水,平衡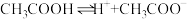 将向
将向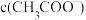 与原平衡时相比
与原平衡时相比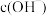 与原平衡时相比
与原平衡时相比(2)25℃时,三种弱电解质的电离平衡常数如表:
| 化学式 |  |  |  |
| 电离平衡常数 | 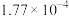 |  | 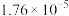 |
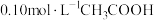 溶液中
溶液中 电离程度增大的是
电离程度增大的是a.通入少量HCl气体 b.加入少量冰醋酸 c.加入少量醋酸钠固体 d.加入少量水
②常温下,
 的
的 溶液加水稀释过程,下列表达式的数据一定变小的是
溶液加水稀释过程,下列表达式的数据一定变小的是a.
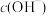 b.
b. c.
c.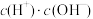 d.
d.
更新时间:2022-09-05 22:34:52
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】有下列物质的溶液①CH3COOH②HCl③H2SO4④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较___________ (用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小比较为___________ 。
(3)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为___________ ,经测定溶液中c(CH3COO-)为 ,此温度下醋酸的电离常数Ka=
,此温度下醋酸的电离常数Ka=___________ ,温度升高,Ka将___________ (填“变大”、“不变”或“变小”,下同),加入量CH3COONa后c(H+)___________ ,Ka___________ 。
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小比较为
(3)将6g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为
 ,此温度下醋酸的电离常数Ka=
,此温度下醋酸的电离常数Ka=
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】研究弱电解质的电离,有重要的实际意义。
Ⅰ.有机酸醋酸
(1)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
(2)将0.1 mol∙L−1CH3COOH溶液加水稀释,c(CH3COO-)/c(CH3COOH)的比值将___________ (填“变大”、“不变”或“变小”)。
Ⅱ.对比弱酸酸性相对强弱
(3)某些弱酸在25℃时的电离常数如下:
①下列反应可以发生的是___________ (填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL 1 mol∙L−1 CH3COOH溶液和20mL 1 mol∙L−1HSCN溶液分别与20mL 1 mol∙L−1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式 ___________ 。

Ⅰ.有机酸醋酸
(1)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
| A.c(CH3COO-) | B.c(H+) |
| C.c(OH-) | D.CH3COOH电离平衡常数 |
Ⅱ.对比弱酸酸性相对强弱
(3)某些弱酸在25℃时的电离常数如下:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电离常数 |  | 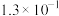 |  |  | 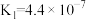 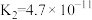 |
①下列反应可以发生的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL 1 mol∙L−1 CH3COOH溶液和20mL 1 mol∙L−1HSCN溶液分别与20mL 1 mol∙L−1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】常温下,有浓度均为0.1mol/L的下列4种溶液:
①NaCN溶液②NaOH溶液③ 溶液④
溶液④ 溶液
溶液
(1)这4种溶液pH由大到小的顺序是___________ (填序号)。
(2)①溶液中各离子 浓度由大到小的顺序是___________ 。将等浓度、等体积的 和
和 溶液混合,溶液中各微粒浓度由大到小的顺序是
溶液混合,溶液中各微粒浓度由大到小的顺序是___________ (不考虑水分子)
(3) 的
的 溶液中
溶液中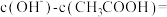
___________ (填数值)。
(4)常温时,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:___________ 。
(5)常温下,向0.1mol/L的 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是___________ 。(填字母)
A. B.
B. C.
C.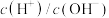 D.醋酸电离度 E.水电离出的
D.醋酸电离度 E.水电离出的
(6)结合所给的电离平衡常数解释,为什么 溶液呈碱性:
溶液呈碱性:___________ 。
①NaCN溶液②NaOH溶液③
 溶液④
溶液④ 溶液
溶液| HCN |  |  |
 |  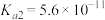 |  |
(2)①溶液中各
 和
和 溶液混合,溶液中各微粒浓度由大到小的顺序是
溶液混合,溶液中各微粒浓度由大到小的顺序是(3)
 的
的 溶液中
溶液中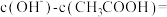
(4)常温时,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:
(5)常温下,向0.1mol/L的
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.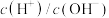 D.醋酸电离度 E.水电离出的
D.醋酸电离度 E.水电离出的
(6)结合所给的电离平衡常数解释,为什么
 溶液呈碱性:
溶液呈碱性:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】按要求回答下列问题:
(1)向CH3COOH水溶液中加入水,平衡CH3COOH H++CH3COO—将向
H++CH3COO—将向___________ ((填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH3COO-)与原平衡时相比___________ (填“增大”、“减小”或“不变”),溶液中c(OH-) 与原平衡时相比___________ (填“增大”、“减小”或“不变”)。
(1)向CH3COOH水溶液中加入水,平衡CH3COOH
 H++CH3COO—将向
H++CH3COO—将向
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】判断正误:
1.强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子。(_______)
2.氨气溶于水,当NH3·H2O电离出的c(OH-)=c( )时,表明NH3·H2O电离处于平衡状态。(_______)
)时,表明NH3·H2O电离处于平衡状态。(_______)
3.室温下,由0.1mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH=B++OH-。(_______)
4.电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。(_______)
5.25℃时,0.1mol·L-1CH3COOH加水稀释,各离子浓度均减小。(_______)
6.电离平衡向右移动,弱电解质的电离度一定增大。(_______)
7.电离平衡向右移动,电解质的分子浓度一定减小。(_______)
8.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同。(_______)
1.强电解质稀溶液中不存在溶质分子,弱电解质稀溶液中存在溶质分子。(_______)
2.氨气溶于水,当NH3·H2O电离出的c(OH-)=c(
 )时,表明NH3·H2O电离处于平衡状态。(_______)
)时,表明NH3·H2O电离处于平衡状态。(_______)3.室温下,由0.1mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH=B++OH-。(_______)
4.电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。(_______)
5.25℃时,0.1mol·L-1CH3COOH加水稀释,各离子浓度均减小。(_______)
6.电离平衡向右移动,弱电解质的电离度一定增大。(_______)
7.电离平衡向右移动,电解质的分子浓度一定减小。(_______)
8.Na2SO3溶液与NaHSO3溶液中所含微粒的种类一定相同。(_______)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】(1)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,请回答下列问题:
常温下,某Na2CO3溶液中滴入酚酞,溶液呈_____ 色,则该溶液呈 ______ 性,原因是 ______ (用离子方程式表示),若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是_________ ,
(2)已知在H2S溶液中存在下列平衡:H2S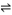 HS- + H+
HS- + H+
①向H2S溶液中加入NaOH固体时(不考虑温度变化),电离平衡向______ 移动(填“左”或“右”)
______ (填“增大”、“减小”或“不变”)。
②向H2S溶液中加入NaHS固体时,电离平衡向______ 移动(填“左”或“右”),pH ______ (填“增大”、“减小”或“不变”)。
常温下,某Na2CO3溶液中滴入酚酞,溶液呈
(2)已知在H2S溶液中存在下列平衡:H2S
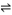 HS- + H+
HS- + H+①向H2S溶液中加入NaOH固体时(不考虑温度变化),电离平衡向

②向H2S溶液中加入NaHS固体时,电离平衡向
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】ⅰ.(1)氨气极易溶于水,氨气与水反应的化学方程式为_____________________ ;
氨水显碱性的原因是_____________________________ (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是____ (填字母,下同)。
②能使c(OH-)增大、c(NH4+)减少的是____ 。
③能使c(OH-)和c(NH4+)都增大的是____ 。
④能使c(OH-)和c(NH4+)都减少的是____ 。
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=________ ;该温度下向纯水中加盐酸使c(H+)=5×10-6 mol·L-1,则此时c(OH-)=______________________________ 。
氨水显碱性的原因是
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】Ⅰ. 醋酸是一种常见的弱酸,在0.1 mol·L-1醋酸中加入下列物质,醋酸的电离平衡及平衡时物质的浓度的变化:(填“正向”、“逆向”或“不移动”,“增大”、“减小”或“不变”,填“>”、“<”或“=”)
(1)向醋酸中加入醋酸钠固体,电离平衡向_____________ 移动,pH_____________ 。
(2)向醋酸中加入碳酸钙固体,电离平衡向_____________ 移动;
(3)向醋酸中加入大量的水,c(OH-)_____________ ,导电能力_____________ 。
(1)向醋酸中加入醋酸钠固体,电离平衡向
(2)向醋酸中加入碳酸钙固体,电离平衡向
(3)向醋酸中加入大量的水,c(OH-)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风,NaUr(s)  Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为_______
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=_______ 。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)_______ c(Ur−) (填“>”、“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程_______
(5)对于尿酸偏高的人群,下列建议正确的是_______ 。
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
 Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
Na+(aq)+Ur−(aq) ∆H >0。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,Ka(HUr) = 4×10−6,Kw = 2.4×10−14,Ksp(NaUr) = 6.4×10−5
②37℃时,模拟关节滑液pH =7.4,c(Ur-) =4.6×10−4 mol∙L−1
(1)尿酸电离方程式为
(2)Kh为盐的水解常数,37℃时,Kh(Ur−)=
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中c(Na+)
(4)37℃时,向模拟关节滑液中加入NaCl(s)至c(Na+) = 0.2 mol∙L−1时,通过计算判断是否有NaUr晶体析出,请写出判断过程
(5)对于尿酸偏高的人群,下列建议正确的是
a.加强锻炼,注意关节保暖 b.多饮酒,利用乙醇杀菌消毒
c.多喝水,饮食宜少盐、少脂 d.减少摄入易代谢出尿酸的食物
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】ⅰ.(1)氨气极易溶于水,氨气与水反应的化学方程式为_____________________ ;
氨水显碱性的原因是_____________________________ (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是____ (填字母,下同)。
②能使c(OH-)增大、c(NH4+)减少的是____ 。
③能使c(OH-)和c(NH4+)都增大的是____ 。
④能使c(OH-)和c(NH4+)都减少的是____ 。
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=________ ;该温度下向纯水中加盐酸使c(H+)=5×10-6 mol·L-1,则此时c(OH-)=______________________________ 。
氨水显碱性的原因是
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水 B.纯水 C.少量浓硫酸 D.少量NaOH固体 E.少量Al2(SO4)3固体
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是
ⅱ.某温度下纯水中c(H+)=2×10-7 mol·L-1,则此时c(OH-)=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
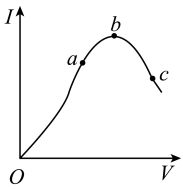
(1)“O”点处冰醋酸的导电能力为0的原因是_______________________ ;
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为________ (用字母表示);
(3)在a、b、c三点处,电离程度最大的是________ (用字母表示);
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①_____________ ;②______________ ;③____________ 。

(1)“O”点处冰醋酸的导电能力为0的原因是
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为
(3)在a、b、c三点处,电离程度最大的是
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________ 。
(2)溶液③的 pH=_________ 。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________ ②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________ 。
(5)常温下,下列关于溶液②的判断正确的是_________ 。
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
(1)用化学用语解释溶液①呈酸性的原因:
(2)溶液③的 pH=
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①
(4)溶液④加热后碱性增强,结合化学用语解释原因:
(5)常温下,下列关于溶液②的判断正确的是
a.c(CH3COO−) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO−) > c(OH −)
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
您最近一年使用:0次



