常温下,有浓度均为0.1mol/L的下列4种溶液:
①NaCN溶液②NaOH溶液③ 溶液④
溶液④ 溶液
溶液
(1)这4种溶液pH由大到小的顺序是___________ (填序号)。
(2)①溶液中各离子 浓度由大到小的顺序是___________ 。将等浓度、等体积的 和
和 溶液混合,溶液中各微粒浓度由大到小的顺序是
溶液混合,溶液中各微粒浓度由大到小的顺序是___________ (不考虑水分子)
(3) 的
的 溶液中
溶液中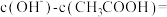
___________ (填数值)。
(4)常温时,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:___________ 。
(5)常温下,向0.1mol/L的 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是___________ 。(填字母)
A. B.
B. C.
C.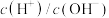 D.醋酸电离度 E.水电离出的
D.醋酸电离度 E.水电离出的
(6)结合所给的电离平衡常数解释,为什么 溶液呈碱性:
溶液呈碱性:___________ 。
①NaCN溶液②NaOH溶液③
 溶液④
溶液④ 溶液
溶液| HCN |  |  |
 |  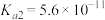 |  |
(2)①溶液中各
 和
和 溶液混合,溶液中各微粒浓度由大到小的顺序是
溶液混合,溶液中各微粒浓度由大到小的顺序是(3)
 的
的 溶液中
溶液中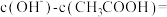
(4)常温时,向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:
(5)常温下,向0.1mol/L的
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.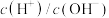 D.醋酸电离度 E.水电离出的
D.醋酸电离度 E.水电离出的
(6)结合所给的电离平衡常数解释,为什么
 溶液呈碱性:
溶液呈碱性:
更新时间:2024-02-20 08:04:25
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】弱电解质的电离平衡概念
(1)电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质分子电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征

①开始时,v(电离)_______________ ,而v(结合)为_______________ 。
②平衡的建立过程中,v(电离)_______________ v(结合)。
③当v(电离)_______________ v(结合)时,电离过程达到平衡状态。
(1)电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质分子电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征

①开始时,v(电离)
②平衡的建立过程中,v(电离)
③当v(电离)
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
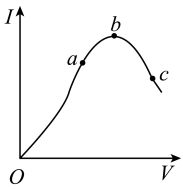
(1)“O”点处冰醋酸的导电能力为0的原因是_______________________ ;
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为________ (用字母表示);
(3)在a、b、c三点处,电离程度最大的是________ (用字母表示);
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①_____________ ;②______________ ;③____________ 。

(1)“O”点处冰醋酸的导电能力为0的原因是
(2)在a、b、c三点处,溶液中c(H+)由小到大的顺序为
(3)在a、b、c三点处,电离程度最大的是
(4)若使c点处的溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施有①
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】在一定温度下,有三种酸溶液:a、盐酸 b、硫酸 c、醋酸。
(1)若三者溶液pH相同时,溶质的物质的量浓度由大到小的顺序是___________ (用a、b、c填空,下同)。
(2)若三者溶液同体积、同物质的量浓度时,溶液中 由大到小的顺序是
由大到小的顺序是___________ ,中和上述三种酸,消耗NaOH的物质的量由大到小的顺序是___________ 。
(3)若将pH相同的三种酸均加水稀释至原来的100倍后, 由大到小的顺序是
由大到小的顺序是___________ 。
(4)在0.2 与0.1
与0.1 醋酸中,
醋酸中, 之比为
之比为___________ 2∶1(填>、<、=)。
(5)在0.1 醋酸溶液中,
醋酸溶液中,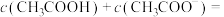
___________  (填数值)。
(填数值)。
(1)若三者溶液pH相同时,溶质的物质的量浓度由大到小的顺序是
(2)若三者溶液同体积、同物质的量浓度时,溶液中
 由大到小的顺序是
由大到小的顺序是(3)若将pH相同的三种酸均加水稀释至原来的100倍后,
 由大到小的顺序是
由大到小的顺序是(4)在0.2
 与0.1
与0.1 醋酸中,
醋酸中, 之比为
之比为(5)在0.1
 醋酸溶液中,
醋酸溶液中,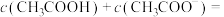
 (填数值)。
(填数值)。
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】按要求回答下列问题:
(1)KHSO4溶液显______ 性(填“酸”“碱”或“中”)。其原因是(用电离方程式表示):_______ 。
(2)KHCO3溶液显______ 性(填“酸”“碱”或“中”),其原因是(用离子方程式表示):_______ 。
(3)将上述两溶液混合,离子反应方程式为_______ 。
(1)KHSO4溶液显
(2)KHCO3溶液显
(3)将上述两溶液混合,离子反应方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】常温下,浓度均为0.1mol·L-1的两种溶液:①氨水 ②NH4Cl溶液。
(1)写出①氨水中NH3·H2O的电离方程式:_______ 。
(2)测得②溶液的pH<7,则溶液中c(NH )
)______ c(Cl-)(填“>”“<”或“=”),写出②溶液发生水解反应的化学方程式:_______ 。
(3)需要配制2L 0.1mol·L-1NH4Cl溶液,则用托盘天平称取的固体NH4Cl(M=53.5)为______ 克。
(1)写出①氨水中NH3·H2O的电离方程式:
(2)测得②溶液的pH<7,则溶液中c(NH
 )
)(3)需要配制2L 0.1mol·L-1NH4Cl溶液,则用托盘天平称取的固体NH4Cl(M=53.5)为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】I.已知:下表是25℃时某些弱酸的电离平衡常数。
(1)25℃时,体积相等的浓度均为0.1 mol∙L−1的NaClO溶液和CH3COONa溶液,两溶液中c(ClO-)________ c(CH3COO-)(填“>”“<”或“=”)。若要使两溶液的pH相等,应______ (填序号)
a.向NaClO溶液中加适量水
b.向NaClO溶液中加适量的NaOH固体
c.向CH3COONa溶液中加适量水
d.向CH3COONa溶液中加适量CH3COONa固体
(2)由表格中的数据判断下列离子方程式正确的是___________。
(3)在25℃时, 浓度相等的NH4Cl、CH3COONH4、NH4HSO4三种溶液,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol∙L−1),三者由大到小的顺序是
浓度相等的NH4Cl、CH3COONH4、NH4HSO4三种溶液,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol∙L−1),三者由大到小的顺序是___________ 。
(4)在25℃下,将a mol∙L−1的氨水与0.01 mol∙L−1的盐酸等体积混合,充分反应后溶液中c( )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=___________ 。
II.常温时,分别改变相同物质的量浓度的H2CO3和氨水的pH,H2CO3、 、
、 的物质的量分数(δ)及NH3·H2O、
的物质的量分数(δ)及NH3·H2O、 的物质的量分数(δ)如图所示(不考虑溶液中的CO2和NH3分子),已知:δ=
的物质的量分数(δ)如图所示(不考虑溶液中的CO2和NH3分子),已知:δ=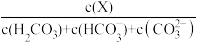 、δ=
、δ=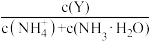 ,根据图象回答下列问题:
,根据图象回答下列问题:
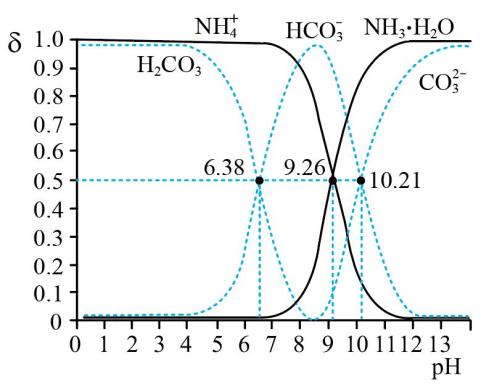
(5)NH4HCO3溶液显___________ 性(填“酸”“碱”或“中”)。
(6)计算反应 +NH3·H2O=
+NH3·H2O= +
+ +H2O的lgK=
+H2O的lgK=___________ 。
| 化学式 | CH3COOH | NH3·H2O | HClO | H2CO3 | H2SO3 |
| Ka | Ka=1.8×10−5 | Kb=1.8×10−5 | Ka=3.0×10−8 | Ka1=4.1×10−7 Ka2=5.6×10−11 | Ka1=1.54×10−2 Ka2=1.02×10−7 |
a.向NaClO溶液中加适量水
b.向NaClO溶液中加适量的NaOH固体
c.向CH3COONa溶液中加适量水
d.向CH3COONa溶液中加适量CH3COONa固体
(2)由表格中的数据判断下列离子方程式正确的是___________。
A.2 +SO2= +SO2= +2CO2+H2O +2CO2+H2O |
B.ClO-+CO2+H2O=HClO+ |
C.ClO-+SO2+H2O=HClO+ |
D.CH3COO-+SO2+H2O=CH3COOH+ |
 浓度相等的NH4Cl、CH3COONH4、NH4HSO4三种溶液,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol∙L−1),三者由大到小的顺序是
浓度相等的NH4Cl、CH3COONH4、NH4HSO4三种溶液,其对应溶液中溶质的物质的量浓度分别为a、b、c(单位为mol∙L−1),三者由大到小的顺序是(4)在25℃下,将a mol∙L−1的氨水与0.01 mol∙L−1的盐酸等体积混合,充分反应后溶液中c(
 )=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=
)=c(Cl-),用含a的代数式表示NH3·H2O的电离常数Kb=II.常温时,分别改变相同物质的量浓度的H2CO3和氨水的pH,H2CO3、
 、
、 的物质的量分数(δ)及NH3·H2O、
的物质的量分数(δ)及NH3·H2O、 的物质的量分数(δ)如图所示(不考虑溶液中的CO2和NH3分子),已知:δ=
的物质的量分数(δ)如图所示(不考虑溶液中的CO2和NH3分子),已知:δ=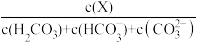 、δ=
、δ=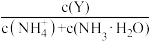 ,根据图象回答下列问题:
,根据图象回答下列问题:
(5)NH4HCO3溶液显
(6)计算反应
 +NH3·H2O=
+NH3·H2O= +
+ +H2O的lgK=
+H2O的lgK=
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】25℃时0.1mol•L-1的H2S水溶液中,用氢氧化钠来调节溶液pH,得到含有H2S、HS-、S2-三种微粒的溶液。
(1)当溶液的pH=7时,c(Na+)=__________ (填微粒间量的关系)。
(2)当c(Na+)=c(S2-)+c(HS-)+c(H2S)时溶液为____ 溶液(填物质的化学式)。
(1)当溶液的pH=7时,c(Na+)=
(2)当c(Na+)=c(S2-)+c(HS-)+c(H2S)时溶液为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】回答下列问题
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①写出该混合溶液中存在的电荷守恒关系式_______ 。
②向其中加入少量KOH溶液时,发生反应的离子方程式是_______ 。
③现将 溶液和
溶液和 溶液等体积混合,得到缓冲溶液。
溶液等体积混合,得到缓冲溶液。
a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)_______ c(CN-) (填“<”、“=”或“>”)。
b.若HA为 ,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是_______ 。
(2)常温下,向 溶液中逐滴加入
溶液中逐滴加入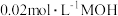 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

①常温下一定浓度的MCl稀溶液的pH_______ (填“>”“<”或“=”)7,用离子方程式表示其原因_______ 。
②K点对应的溶液中,c(M+)+c(MOH)_______ (填“>”“<”或“=”)2c(Cl-)
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①写出该混合溶液中存在的电荷守恒关系式
②向其中加入少量KOH溶液时,发生反应的离子方程式是
③现将
 溶液和
溶液和 溶液等体积混合,得到缓冲溶液。
溶液等体积混合,得到缓冲溶液。a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)
b.若HA为
 ,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是
,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是(2)常温下,向
 溶液中逐滴加入
溶液中逐滴加入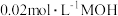 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
①常温下一定浓度的MCl稀溶液的pH
②K点对应的溶液中,c(M+)+c(MOH)
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】已知:相同温度时,一元弱酸HA的Ka比一元弱酸HB的Ka大。试比较相同温度相同体积的下列两溶液中离子数目的多少。(填“=”、“ >”、“<”、“无法确定”)
(1)物质的量浓度相等的NaA溶液(n1)与NaB溶液(n2),n1_______ n2
(2)pH相等的NaA溶液(n1)与NaB溶液(n2),n1_______ n2
(3)c(A-)与c(B-)相等的NaA溶液(n1)与NaB溶液(n2),n1_______ n2
(1)物质的量浓度相等的NaA溶液(n1)与NaB溶液(n2),n1
(2)pH相等的NaA溶液(n1)与NaB溶液(n2),n1
(3)c(A-)与c(B-)相等的NaA溶液(n1)与NaB溶液(n2),n1
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】常温下,将0.1000 molL-1 NaOH溶液滴入20.00 mL 0.1000 molL-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如图所示。
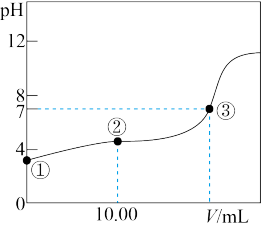
(1)HA与NaOH溶液反应的离子方程式是___________ 。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是___________ (填序号)。
a.c(Na+)= c(HA)+c(A-) b.c(Na+)+c(H+)=c(A-)+c(OH-) c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V___________ 20.00 mL(填“>”、“<”或“=”)。

(1)HA与NaOH溶液反应的离子方程式是
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是
a.c(Na+)= c(HA)+c(A-) b.c(Na+)+c(H+)=c(A-)+c(OH-) c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】I.25℃时,部分物质的电离平衡常数如表所示:
(1)0.1 mol·L−1 NH4ClO溶液中离子浓度由大到小的顺序是_____________________ 。
(2)等浓度的Na2SO3、NaClO、Na2CO3、NaHCO3溶液,pH由大到小的顺序是________ 。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验,发现两种溶液混合后产生大量的白色胶状沉淀。出现上述现象的原因是____________________ (请用反应的离子方程式表示)。
II.用沉淀滴定法快速测定NaI溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
i.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
ii.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
f.数据处理。
回答下列问题:
(4)滴定应在pH<0.5的条件下进行,其原因是____________________________ 。
(5)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,会导致c(I-)测定结果___________ (填“偏高”、“偏低”或“不影响”)。
(6)测得c(I-) =_____________ mol·L−1。
弱酸或弱碱 | 电离常数 |
NH3·H2O | Kb=2×10−5 |
HClO | Ka=3×10−8 |
H2CO3 | Ka1=4×10−7 Ka2=4×10−11 |
H2SO3 | Ka1=1.3×10−2 Ka2=6.3×10−8 |
(1)0.1 mol·L−1 NH4ClO溶液中离子浓度由大到小的顺序是
(2)等浓度的Na2SO3、NaClO、Na2CO3、NaHCO3溶液,pH由大到小的顺序是
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验,发现两种溶液混合后产生大量的白色胶状沉淀。出现上述现象的原因是
II.用沉淀滴定法快速测定NaI溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
i.准备标准溶液
a.准确称取AgNO3基准物4.2468 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.1000 mol·L−1 NH4SCN标准溶液,备用。
ii.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.1000 mol·L−1 AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.1000 mol·L−1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗NH4SCN标准溶液体积/mL | 10.24 | 10.02 | 9.98 |
f.数据处理。
回答下列问题:
(4)滴定应在pH<0.5的条件下进行,其原因是
(5)若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,会导致c(I-)测定结果
(6)测得c(I-) =
您最近一年使用:0次

 )-c(K+)-3c(Al3+)=
)-c(K+)-3c(Al3+)=  )(填“>”“<”“=”)
)(填“>”“<”“=”)


