0.1mol/L醋酸溶液中存在电离平衡CH3COOH CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是
 CH3COO-+H+,下列叙述不正确的是
CH3COO-+H+,下列叙述不正确的是| A.升高温度,平衡正向移动,醋酸的电离常数Ka增大 |
| B.溶液加水稀释,溶液中c(H+)减小,c(OH-)增大 |
| C.CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动 |
| D.室温下,加入0.1mol/L盐酸溶液平衡逆向移动c(H+)减小 |
更新时间:2022-09-20 12:33:29
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L。x与y的关系如图所示,下列说法正确的是
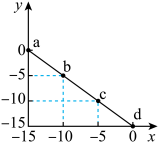

| A.该温度高于25℃ |
| B.图中a点溶液呈碱性 |
| C.该温度下,0.01mol·L-1的HCl溶液的pH≠2 |
| D.该温度下,0.01mol·L-1的NaOH溶液的pH=12 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】升高温度,下列数据不一定增大的是
| A.化学反应速率v | B.化学平衡常数K |
| C.盐类的水解常数Kb | D.水的离子积常数Kw |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知室温时,0.1 molL-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是
| A.该溶液的pH=4 |
| B.此溶液中,HA约有0.1%发生电离 |
| C.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
| D.加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】某温度下,向1L纯水中不断通入氨气至饱和,溶液中下列各量的值始终保持减小的是
| A.c(NH3·H2O) | B.c(NH4+) | C.c(H+) | D.c(OH-) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】下列说法中不正确的是
A.某温度Ksp(Ag2S)=6 10-50(mol·L-1)3,Ksp(AgCl)=2 10-50(mol·L-1)3,Ksp(AgCl)=2 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ⇌Ag2S(s)+2Cl-(aq)的平衡常数约为6.7 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ⇌Ag2S(s)+2Cl-(aq)的平衡常数约为6.7 1037mol·L-1 1037mol·L-1 |
| B.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<① |
| C.pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1 |
| D.一定浓度的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S) |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】已知H3R是一种三元中强酸。25℃时,向某浓度H3R溶液中逐滴加入NaOH溶液(保持温度不变),各种含R微粒的物质的量分数δ随溶液pH的变化曲线及交点的pH如图所示。下列说法正确的是
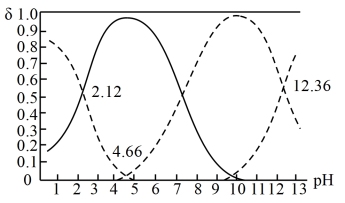

| A.pH=7.15时,c(H2R-)>c(HR2-) |
| B.随着NaOH溶液的加入,c(R3-)逐渐增大,水的电离程度逐渐增大 |
C.25℃时,HR2-的水解平衡常数为Kh2,则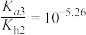 |
| D.滴加过程中c(H3R)+c(H2R-)+c(HR2-)+c(R3-)保持不变 |
您最近半年使用:0次
单选题
|
适中
(0.65)
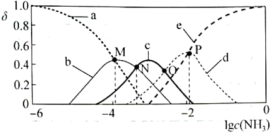
【推荐2】Cu2+与NH3可结合生成多种络合产物, 在水溶液中存在如下平衡:
在水溶液中存在如下平衡: 。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得Cu2+、
。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得Cu2+、 、
、 、
、 、
、 的物质的量分布分数(
的物质的量分布分数( )与溶液中游离氨的
)与溶液中游离氨的 关系如图所示。下列说法错误的是
关系如图所示。下列说法错误的是
 在水溶液中存在如下平衡:
在水溶液中存在如下平衡: 。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得Cu2+、
。向某浓度的硫酸铜溶液中滴加浓氨水,实验测得Cu2+、 、
、 、
、 、
、 的物质的量分布分数(
的物质的量分布分数( )与溶液中游离氨的
)与溶液中游离氨的 关系如图所示。下列说法错误的是
关系如图所示。下列说法错误的是
A.曲线b表示 |
B. |
C. 时, 时, |
D. 时, 时,  |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、 和
和 的物种分布分数α(X)=
的物种分布分数α(X)= 与pH的关系如图所示:
与pH的关系如图所示:
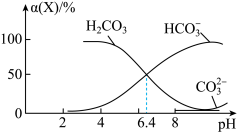
下列说法正确的是
 和
和 的物种分布分数α(X)=
的物种分布分数α(X)= 与pH的关系如图所示:
与pH的关系如图所示:
下列说法正确的是
A.pH=8时溶液中有:c( )>c( )>c( ) ) |
B.反应  H++ H++ 的lgK= -6.4 的lgK= -6.4 |
| C.NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)=c(Cl-) |
D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应: +OH-= +OH-= +H2O +H2O |
您最近半年使用:0次
【推荐1】下列说法不正确 的是
| A.已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJ·mol-1。假设每摩尔水中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键 |
| B.实验检测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键 |
C.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka= 。若加入少量CH3COONa固体,则电离平衡CH3COOH⇌CH3COO-+H+向左移动,α减小,Ka变小 。若加入少量CH3COONa固体,则电离平衡CH3COOH⇌CH3COO-+H+向左移动,α减小,Ka变小 |
| D.“水”电池是一种能利用淡水与海水之间含盐量差别进行发电的装置,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。则每生成1molNa2Mn5O10转移2mol电子 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列关于盐酸与醋酸两种稀溶液的说法正确的是
| A.相同浓度的两溶液中c(H+)相同 |
| B.pH=3的两溶液稀释100倍,pH都为5 |
| C.两溶液中分别加入少量对应的钠盐固体,c(H+)均明显减小 |
| D.100 mL 0.1 mol/L的两种溶液能中和等物质的量的氢氧化钠 |
您最近半年使用:0次

 CH3COO- + H+,对于该平衡,下列叙述正确的是
CH3COO- + H+,对于该平衡,下列叙述正确的是

