某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
| A.该温度下,0.31 mol·L-1的HF溶液的pH=2 |
| B.升高温度或增大浓度,HF的电离平衡常数都将增大 |
| C.两溶液混合不会产生沉淀 |
| D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小 |
2013·河南郑州·一模 查看更多[3]
(已下线)2013届河南省郑州市高三第一次模拟考试化学试卷夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶度积常数及相关计算【懂做原理题】2020届高三化学选修4二轮专题练——沉淀溶解平衡常数及相关计算【精编25题】
更新时间:2016-12-09 04:39:10
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是( )
A.向含有相等物质的量的 、ClO-、 、ClO-、 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 、ClO-、 、ClO-、 |
| B.向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+ |
D.向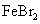 溶液中滴加少量氯水,再加入 溶液中滴加少量氯水,再加入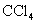 溶液振荡,静置,有机层呈橙色 溶液振荡,静置,有机层呈橙色 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】相同温度下,根据三种酸的电离常数,下列判断正确的是
| 酸 | HX | HY | HZ |
| 电离常数K/(mol·L-1) | 9×10-7 | 9×10-6 | 1×10-2 |
| A.三种酸的强弱关系:HX>HY>HZ |
| B.反应HZ+Y-=HY+Z-不能够发生 |
C.V升HY溶液,加入水使溶液体积为2V,则Q= K(HY),平衡正向移动,促进HY电离 K(HY),平衡正向移动,促进HY电离 |
D.0.1mol·L-1HX溶液加水稀释, 值变小 值变小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温时,下列说法正确的是
| A.pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为1×10-11mol/L |
| B.分别把100mLpH=11的NaOH溶液和pH=11的氨水加水稀释至1L,所得溶液pH均为10 |
C.向氨水中加入等pH的NaOH溶液,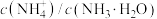 变小 变小 |
| D.分别向1mLpH=3的盐酸和pH=3的CH3COOH溶液中加入少量CH3COONa固体,两溶液的pH均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列实验操作和事实与对应结论描述正确的是
| 选项 | 实验操作和事实 | 结论 |
| A | 将C和 的固体混合物高温加热 的固体混合物高温加热 | 氧化性: |
| B | 用洁净铁丝蘸取溶液进行焰色试验,火焰呈黄色 | 溶液中存在 ,不存在 ,不存在 |
| C | 室温下,向浓度均为0.01 的 的 和 和 混合溶液中滴加 混合溶液中滴加 溶液出现白色沉淀 溶液出现白色沉淀 | 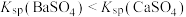 |
| D | 向溶有 的 的 溶液中通入气体X,出现白色沉淀 溶液中通入气体X,出现白色沉淀 | X可能是 或 或 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】向 溶液中滴加氨水至过量,下列叙述正确的是
溶液中滴加氨水至过量,下列叙述正确的是
 溶液中滴加氨水至过量,下列叙述正确的是
溶液中滴加氨水至过量,下列叙述正确的是| A.先出现蓝色沉淀,后沉淀溶解变为无色溶液 |
B.蓝色沉淀变为溶液的化学方程式为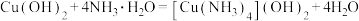 |
C. 的空间构型为正四面体形 的空间构型为正四面体形 |
D.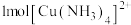 中含共价键12 mol 中含共价键12 mol |
您最近一年使用:0次
【推荐1】某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是


| A.a点对应的Ksp大于b点对应的Ksp |
| B.该温度下将CuSO4溶液中加入MnS后,Ksp(MnS)不变 |
| C.在含有CuS和MnS固体的溶液中,c(Cu2+):c(Mn2+)=(2×10-23):1 |
| D.该温度下,Ksp(CuS)小于Ksp(MnS) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温下,进行下列实验,根据实验操作和现象所得的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 少量Zn粉加到1.0mol·L-1Fe2(SO4)3溶液,溶液颜色变浅 | 金属Zn比Fe活泼 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】难溶盐 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 气体调节
气体调节 浊液的
浊液的 ,测得体系中
,测得体系中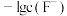 或
或 与
与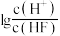 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
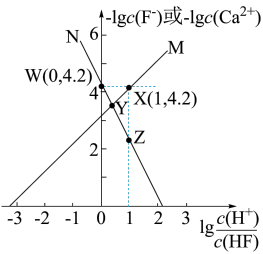
 可溶于盐酸,常温下,用
可溶于盐酸,常温下,用 气体调节
气体调节 浊液的
浊液的 ,测得体系中
,测得体系中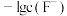 或
或 与
与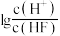 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是
A.曲线 代表 代表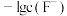 随 随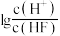 的变化趋势 的变化趋势 |
B. 点溶液中存在 点溶液中存在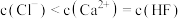 |
C.难溶盐 的溶度积常数 的溶度积常数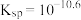 |
D.其他条件不变的情况下,无论增大 浓度或减小 浓度或减小 浓度, 浓度, 的 的 均不变 均不变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列离子方程式书写正确的是
A. 溶液与 溶液与 溶液混合: 溶液混合: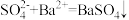 |
B.稀盐酸中滴入少量偏铝酸钠溶液: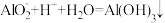 |
C.少量 溶于浓 溶于浓 溶液: 溶液: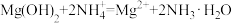 |
D. 溶液中加入 溶液中加入 粉末: 粉末: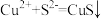 |
您最近一年使用:0次

 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑ =S↓+SO2↑+H2O
=S↓+SO2↑+H2O (aq)+CaSO4(s)
(aq)+CaSO4(s) (aq)
(aq)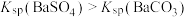
 溶液,产生白色沉淀
溶液,产生白色沉淀 溶液,
溶液, 溶液和
溶液和 溶液的pH,后者pH更大
溶液的pH,后者pH更大 比
比 更容易结合
更容易结合


