砷化镓( )是一种性能优良的半导体材料,工业上可通过如下的两个反应制取:
)是一种性能优良的半导体材料,工业上可通过如下的两个反应制取: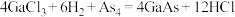 或
或 。
。
(1)基态砷原子的价层电子排布图为_______。氯元素的下列几种微粒中,若再失去一个电子,需要的能量最多的是_______(填标号)。
(2) 的中心原子轨道杂化类型为
的中心原子轨道杂化类型为_______ , 中的三个碳原子和中心原子镓原子构成的空间构型是
中的三个碳原子和中心原子镓原子构成的空间构型是_______ ,写出一种与甲烷互为等电子体的离子的化学式:_______ 。
(3)上述反应涉及的几种元素中,电负性最大的元素是_______ ,砷可形成多种卤化物,其中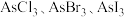 的沸点由低到高的原因为
的沸点由低到高的原因为_______ 。
(4) 晶胞图及部分原子的分数坐标如下:
晶胞图及部分原子的分数坐标如下:
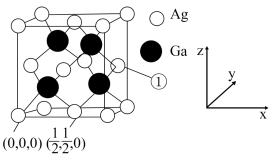
则①处原子的分数坐标为_______ ,已知紧邻的 原子之间的距离为
原子之间的距离为 ,紧邻的
,紧邻的 原子之间的距离为
原子之间的距离为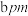 ,则
,则
_______ b,该晶胞的密度为_______  (用含a、阿伏加德罗常数
(用含a、阿伏加德罗常数 的式子表示)。
的式子表示)。
 )是一种性能优良的半导体材料,工业上可通过如下的两个反应制取:
)是一种性能优良的半导体材料,工业上可通过如下的两个反应制取: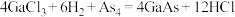 或
或 。
。(1)基态砷原子的价层电子排布图为_______。氯元素的下列几种微粒中,若再失去一个电子,需要的能量最多的是_______(填标号)。
A.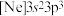 | B. | C.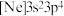 | D.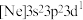 |
 的中心原子轨道杂化类型为
的中心原子轨道杂化类型为 中的三个碳原子和中心原子镓原子构成的空间构型是
中的三个碳原子和中心原子镓原子构成的空间构型是(3)上述反应涉及的几种元素中,电负性最大的元素是
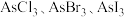 的沸点由低到高的原因为
的沸点由低到高的原因为(4)
 晶胞图及部分原子的分数坐标如下:
晶胞图及部分原子的分数坐标如下:
则①处原子的分数坐标为
 原子之间的距离为
原子之间的距离为 ,紧邻的
,紧邻的 原子之间的距离为
原子之间的距离为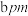 ,则
,则
 (用含a、阿伏加德罗常数
(用含a、阿伏加德罗常数 的式子表示)。
的式子表示)。
更新时间:2022-11-21 19:30:59
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铍由于重量轻、弹性模数高和热稳定性好,已成为引人注目的飞机和导弹结构材料。回答下列问题:
(1)最重要的含铍矿物是绿柱石,含2%铬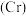 的绿柱石即为祖母绿。基态
的绿柱石即为祖母绿。基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为___________ 。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有___________(字母)。
(3)氯化铍在气态时存在 分子(a)和二聚分子
分子(a)和二聚分子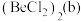 ,固态时为链状结构(c)。
,固态时为链状结构(c)。
①a分子空间结构为___________ 。
②二聚分子 中
中 原子的杂化方式相同,且所有原子都在同一平面上,则b的结构式为
原子的杂化方式相同,且所有原子都在同一平面上,则b的结构式为___________ (用“→”标出配位键)。
③c的结构如下图所示:

则,c中 的杂化方式为
的杂化方式为___________ ,其 模型为
模型为___________ 。
(4) 立方晶胞如下图所示:
立方晶胞如下图所示:
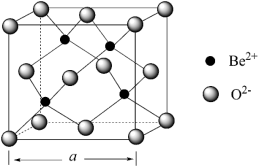
若 晶胞的边长为
晶胞的边长为 ,则晶胞的密度
,则晶胞的密度
___________  。(
。( 表示阿伏加德罗常数)
表示阿伏加德罗常数)
(1)最重要的含铍矿物是绿柱石,含2%铬
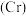 的绿柱石即为祖母绿。基态
的绿柱石即为祖母绿。基态 原子价电子的轨道表示式为
原子价电子的轨道表示式为(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有___________(字母)。
| A.都属于p区主族元素 | B.电负性都比镁大 |
| C.第一电离能都比镁大 | D.氯化物的水溶液 均小于7 均小于7 |
 分子(a)和二聚分子
分子(a)和二聚分子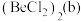 ,固态时为链状结构(c)。
,固态时为链状结构(c)。①a分子空间结构为
②二聚分子
 中
中 原子的杂化方式相同,且所有原子都在同一平面上,则b的结构式为
原子的杂化方式相同,且所有原子都在同一平面上,则b的结构式为③c的结构如下图所示:

则,c中
 的杂化方式为
的杂化方式为 模型为
模型为(4)
 立方晶胞如下图所示:
立方晶胞如下图所示:
若
 晶胞的边长为
晶胞的边长为 ,则晶胞的密度
,则晶胞的密度
 。(
。( 表示阿伏加德罗常数)
表示阿伏加德罗常数)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Na、Fe、Ni、Cu等是重要的金属元素。回答下列问题:
(1)基态Cu原子的电子排布式为______ 。
(2)基态Fe原子价层电子的轨道表示式为______ 。在实验室中配制FeCl3溶液的方法是将氯化铁晶体溶于较浓盐酸中,然后再加水稀释到所需的浓度。配制时溶于盐酸的目的是______ 。
(3)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为2NaCl(s)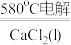 2Na(l)+Cl2(g),加入CaCl2的目的是
2Na(l)+Cl2(g),加入CaCl2的目的是______ 。
(4)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
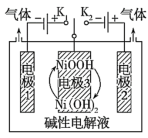
①制H2时,连接开关______ 。产生H2的电极反应式是______ 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3在使用中的优点:______ 。
(1)基态Cu原子的电子排布式为
(2)基态Fe原子价层电子的轨道表示式为
(3)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式为2NaCl(s)
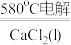 2Na(l)+Cl2(g),加入CaCl2的目的是
2Na(l)+Cl2(g),加入CaCl2的目的是(4)可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接开关
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3在使用中的优点:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】镍铜合金由60%镍、33%铜、6.5%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,无磁性,是制造行波管和其他电子管较好的结构材料。还可作为航空发动机的结构材料。
(1)基态铜原子的价层电子的轨道表示式为_______ ,Cu与Fe的第二电离能分别为:ICu=1959kJ·mol-1,IFe=1562kJ·mol-1,结合价层电子排布式解释Fe的第二电离能较小的原因是_______ 。
(2)向4mL0.1mol/LCuSO4溶液中滴加氨水可形成[Cu(NH3)4]SO4溶液,再向溶液中加入8mL95%的乙醇,并用玻璃棒摩擦器壁析出深蓝色晶体Cu(NH3)4]SO4·H2O。
①NH3中心原子的轨道杂化类型为_______ 。NH3的沸点高于CH4的沸点,其原因是_______ 。
②简单说明加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因_______ 。
(3)某镍铜合金的立方晶胞结构如图所示。
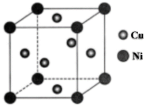
①在该晶胞中镍原子与铜原子的数量比为_______ 。
②若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=_______ g·cm-3(NA表示阿伏加德罗常数,列出计算式)。
(1)基态铜原子的价层电子的轨道表示式为
(2)向4mL0.1mol/LCuSO4溶液中滴加氨水可形成[Cu(NH3)4]SO4溶液,再向溶液中加入8mL95%的乙醇,并用玻璃棒摩擦器壁析出深蓝色晶体Cu(NH3)4]SO4·H2O。
①NH3中心原子的轨道杂化类型为
②简单说明加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因
(3)某镍铜合金的立方晶胞结构如图所示。

①在该晶胞中镍原子与铜原子的数量比为
②若该晶胞的棱长为anm(1nm=1×10-7cm),ρ=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+ 原子核外有3层电子且M层3d轨道电子全充满。请回答:
(1)E元素基态原子的电子排布式为_________ 。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为____ (填元素符号)
(3)D元素与氟元素相比,电负性:D______ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是_______ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为______ ,它的晶体中含有多种化学键,但一定不含有的化学键是______ (填选项序号)。
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含 键
键______ mol。
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物,其电子式为
A.极性键 B.非极性键 C.离子键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含
 键
键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,原理为:2XCl+2CO+ 2H2O==X2Cl2·2CO·2H2O
(1)X原子基态核外电子排布式为_________ ;
(2)C、H、O三种元素的电负性由大到小的顺序为________ ;
(3)H2O中氧原子的轨道杂化类型为__________ ;
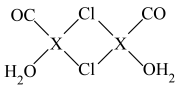
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键__ 。CO与N2分子的结构相似,则1molX2Cl2·2CO·2H2O含有δ键的数目为__ 。
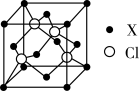
(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为________ 。
(1)X原子基态核外电子排布式为
(2)C、H、O三种元素的电负性由大到小的顺序为
(3)H2O中氧原子的轨道杂化类型为
(4)X2Cl2·2CO·2H2O是一种配合物,结构如图所示,每个X原子能与其他原子形成3个配位键,在图中用“→"标出相应的配位键

(5)化合物XCl晶体的晶胞如图所示,距离每个X离子最近的Cl的个数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】实验室用邻二氮菲(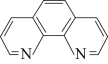 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:

(1)Fe元素在周期表中的位置为__________ ,该配合物中心离子的配位数为__________ 。
(2)该配合离子所含元素的电负性最大的是__________ ,C原子的杂化方式为__________ 。
(3)该配合离子存在的化学键类型有__________ 。
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析, 易被氧化成
易被氧化成 的原因是
的原因是__________ 。
(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为__________ 。
(6)铁晶体中的原子堆积方式如图3所示, 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为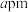 ,若晶胞密度为
,若晶胞密度为 ,则
,则
__________ (列出表达式)。
 )与
)与 形成的红色配合离子(图1)测定
形成的红色配合离子(图1)测定 的浓度。回答下列问题:
的浓度。回答下列问题:
(1)Fe元素在周期表中的位置为
(2)该配合离子所含元素的电负性最大的是
(3)该配合离子存在的化学键类型有
a.离子键 b.配位键 c.极性键 d.非极性键 e.金属键 f.氢键
(4)从结构角度分析,
 易被氧化成
易被氧化成 的原因是
的原因是(5)合成氨反应中铁催化剂表面吸附氮原子,图2为氮原子在铁的晶面上的单层附着局部示意图,图中铁原子与氮原子的个数比为
(6)铁晶体中的原子堆积方式如图3所示,
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为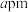 ,若晶胞密度为
,若晶胞密度为 ,则
,则
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a是组成物质种类最多的元素,c是地壳中含量最多的元素,d与a同族,e2+离子3d轨道中有9个电子。回答下列问题:
(1)d原子的基态原子电子排布式为____________
(2)晶体d、晶体da、晶体ac2的熔点由高到低的顺序为__________ (用化学式表示,下同),a、b、c三种元素的第一电离能由大到小的顺序为________________________ 。
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为____________ ,bc3-离子的空间构型为____________ 。
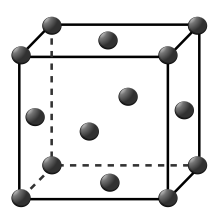
(4)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为_________ g·cm-3。(用含NA、r的表达式表示)
(1)d原子的基态原子电子排布式为
(2)晶体d、晶体da、晶体ac2的熔点由高到低的顺序为
(3)元素b、c形成两种常见阴离子bc2-和bc3-,其中bc2-离子的中心原子杂化轨道类型为
(4)e单质的晶胞结构如图所示,e原子半径为rpm,e晶体密度的计算式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮、磷、硫、氯元素在科研与生产中有许多重要的用途。请回答下列问题:
(1)磷原子在成键时,能将一个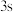 轨道上的电子激发进入
轨道上的电子激发进入 轨道而参与成键,则该激发态原子的核外电子排布式为
轨道而参与成键,则该激发态原子的核外电子排布式为______ 。
(2) 能形成离子晶体,则
能形成离子晶体,则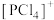 的空间结构为
的空间结构为______ 。
(3)联氨( )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:______ 。
(4)已知一定条件下发生反应: ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为______ 。
(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为 ,则
,则 中的大π键应表示为
中的大π键应表示为______ 。
(1)磷原子在成键时,能将一个
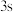 轨道上的电子激发进入
轨道上的电子激发进入 轨道而参与成键,则该激发态原子的核外电子排布式为
轨道而参与成键,则该激发态原子的核外电子排布式为(2)
 能形成离子晶体,则
能形成离子晶体,则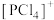 的空间结构为
的空间结构为(3)联氨(
 )为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:
)为二元弱碱,在水中的电离与氨相似,写出联氨在水中第一步电离的离子方程式:(4)已知一定条件下发生反应:
 ,该反应过程中破坏和形成的化学键类型为
,该反应过程中破坏和形成的化学键类型为(5)多原子分子中各原子若在同一平面内,且有互相平行的p轨道,则p电子可在多个原子间运动,形成离域π键,可用符号正表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。如苯分子中的大π键可表示为
 ,则
,则 中的大π键应表示为
中的大π键应表示为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E、F、G、H 是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
(1) A 元素的名称是_______________ ;A 元素和 F 元素形成的最简单化合物的分子构型为_______________ ,该分子是_______________ 分子。(填“极性”或“非极性”)
(2) B 元素形成的单质分子中σ键与π键数目之比为_______________ 。
(3) G 元素的低价阳离子的离子结构示意图是_______________ 。
(4) G 的高价阳离子的溶液与 H 单质反应的离子方程式为___________________________________
| 元素 | 相关信息 |
| A | 原子核外有 6 种不同运动状态的电子 |
| C | 基态原子中 s 电子总数与p 电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为 3s23p1 |
| F | 基态原子的最外层 p 轨道有两个电子的自旋方向与其他电子的自 旋方向相反 |
| G | 基态原子核外有 7 个能级且能量最高的能级上有 6 个电子 |
| H | 是我国使用最早的合金中的最主要金属元素 |
(1) A 元素的名称是
(2) B 元素形成的单质分子中σ键与π键数目之比为
(3) G 元素的低价阳离子的离子结构示意图是
(4) G 的高价阳离子的溶液与 H 单质反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】第三代永磁体材料——钕铁硼(NdFeB)因其优异的综合磁性能,被广泛应用于计算机、通信信息等高科技产业。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为_______ ,熔沸点:NiO_____ FeO(填“<”“>”或“=”)。
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是______________________ 。
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取_________ 杂化。
②氨硼烷晶体中存在的作用力有范德华力、极性键、_______ 和_________ 。
(4)氨硼烷受热析氢的过程之一如图1所示。
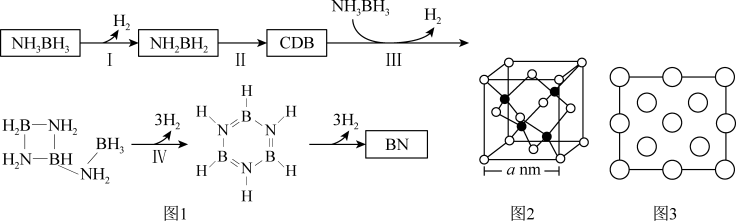
①NH2BH2的氮硼键键能大于NH3BH3,其原因为__________________________ 。
②CDB的结构简式为___________________________ 。
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏加 德罗常数值为NA,该晶体的密度为_______ g·cm-3(用含a和NA的最简式表示)。图3是立方氮化硼晶胞的俯视投影图,请在图中用“●”标明B原子的相对位置_______ 。
(1)铁、钴、镍元素性质非常相似,原子半径接近但依次减小,NiO、FeO的晶体结构类型与氯化钠相同。基态钴原子价电子轨道表示式为
(2)FeSO4·(NH4)2SO4·6H2O俗称摩尔盐,相对于FeSO4·7H2O而言,摩尔盐不易失水,不易被空气氧化,在化学分析实验中常用于配制Fe(Ⅱ)的标准溶液,硫酸亚铁铵晶体中亚铁离子稳定存在的原因是
(3)新型储氢材料氨硼烷(NH3BH3)常温下以固体稳定存在,极易溶于水。
①氨硼烷分子中B原子采取
②氨硼烷晶体中存在的作用力有范德华力、极性键、
(4)氨硼烷受热析氢的过程之一如图1所示。

①NH2BH2的氮硼键键能大于NH3BH3,其原因为
②CDB的结构简式为
③立方氮化硼(BN)晶体的晶胞结构如图2所示。阿伏加 德罗常数值为NA,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】经过半个多世纪的发展,硅基材料的半导体性能已经接近其物理极限,以氮化镓、碳化硅等为代表的第二代半导体材料或成当今热点。
(1)基态Ga原子的核外电子排布式为_______ 。
(2)氮族元素的气态氢化物NH3、PH3、AsH3的还原性由强到弱的顺序为_______ ,键 角由大到小的顺序为_______ 。
(3)碳元素能形成多种同素异形体。石墨的晶体类型为_______ 。金刚石可由Na和CCl4在937K、Ni﹣Co催化条件下人工合成,该反应的化学方程式为_______ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中 各原子的位置,称作原子分数坐标。β﹣SiC 为立方晶 系晶体,晶胞参数为apm。如图所示为沿 y 轴投 影的晶胞中其中一种原子的分布图和原子分数坐标,且另一种原子均位于晶胞的顶点和面心。请据此画出 从β﹣SiC 立方晶胞任一对角线的视角观察,一维空间 上 C、Si 原子的分布规律图_______ 。(注意原子的半径大小和 相对位置,标清原子的符号,至少画出一个周期)。

(1)基态Ga原子的核外电子排布式为
(2)氮族元素的气态氢化物NH3、PH3、AsH3的还原性由强到弱的顺序为
(3)碳元素能形成多种同素异形体。石墨的晶体类型为
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中 各原子的位置,称作原子分数坐标。β﹣SiC 为立方晶 系晶体,晶胞参数为apm。如图所示为沿 y 轴投 影的晶胞中其中一种原子的分布图和原子分数坐标,且另一种原子均位于晶胞的顶点和面心。请据此画出 从β﹣SiC 立方晶胞任一对角线的视角观察,一维空间 上 C、Si 原子的分布规律图

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】IIIA族元素及其化合物在材料化学中具有广泛的应用。回答下列问题:
(1)基态硼原子核外价电子的轨道表示式为___________ 。
(2)氨硼烷( )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。 所含元素电负性由大到小的顺序为
所含元素电负性由大到小的顺序为___________ ;还原性:
___________  (填“>”或“<”),
(填“>”或“<”), 中
中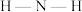 键角
键角___________  (填“>”或“<”)。以下物质之间可能形成双氢键的是
(填“>”或“<”)。以下物质之间可能形成双氢键的是___________ 填标号)。
a、 和
和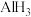 b、
b、 和
和 c、
c、 和
和
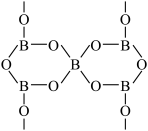
(3)硼酸盐常用于制作光学玻璃。一种无限网状结构的多聚硼酸根离子,其结构单元如图,若该硼酸根离子表示为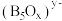 ,则
,则
___________ ,
___________ 。
(4)砷化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图为沿y轴投影的砷化镓晶胞中所有原子的分布图。
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图为沿y轴投影的砷化镓晶胞中所有原子的分布图。
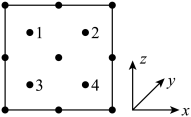
晶胞中离 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有___________ 个。若原子1的原子分数坐标为(0.25,0.75,0.75),原子1、4之间的距离为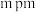 ,则原子4的原子分数坐标为
,则原子4的原子分数坐标为___________ ,晶胞参数为___________  。
。
(1)基态硼原子核外价电子的轨道表示式为
(2)氨硼烷(
 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键。 所含元素电负性由大到小的顺序为
所含元素电负性由大到小的顺序为
 (填“>”或“<”),
(填“>”或“<”), 中
中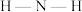 键角
键角 (填“>”或“<”)。以下物质之间可能形成双氢键的是
(填“>”或“<”)。以下物质之间可能形成双氢键的是a、
 和
和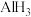 b、
b、 和
和 c、
c、 和
和
(3)硼酸盐常用于制作光学玻璃。一种无限网状结构的多聚硼酸根离子,其结构单元如图,若该硼酸根离子表示为
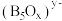 ,则
,则


(4)砷化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被
 原子代替,顶点和面心的碳原子被
原子代替,顶点和面心的碳原子被 原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图为沿y轴投影的砷化镓晶胞中所有原子的分布图。
原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图为沿y轴投影的砷化镓晶胞中所有原子的分布图。
晶胞中离
 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有 ,则原子4的原子分数坐标为
,则原子4的原子分数坐标为 。
。
您最近一年使用:0次



