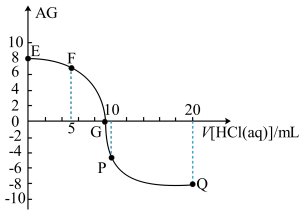
常温下,向体积均为20 mL、浓度均为0.1 mol/L的NaOH溶液和氨水中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是
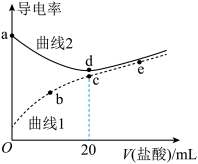

| A.pH的相对大小:c>d |
| B.在b、c、e三点中,水的电离程度最大的点是e |
C.b 点溶液:c(H+)+c(NH )=c(OH-) )=c(OH-) |
D.c 点溶液:c(Cl-)>c(NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
更新时间:2022-12-09 09:50:26
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】25℃时,对于浓度均为0.1 mol/L的三种溶液:①醋酸、②氢氧化钠、③醋酸钠溶液,下列说法错误 的是
| A.c(CH3COO-):③>① |
| B.水电离出的c(H+):③>①>② |
C.25℃时,①和②等体积混合后的溶液: |
D.25℃时,①和③等体积混合后的溶液: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是( )
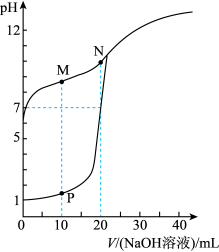

| A.HX为弱酸 |
| B.M点c(HX)—c(X-)﹥c(OH-)—c(H+) |
| C.将P点和N点的溶液混合,呈酸性 |
| D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】已知:H2A为二元弱酸,25℃时,在0.1mol•L-150mL的H2A溶液中,H2A、HA-、A2-的物质的量浓度随溶液pH变化的关系如图所示。下列说法不正确 的是


| A.H2A的Ka1=10-1.3 |
| B.pH在0~7中,c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 |
| C.在pH3→6的过程中,主要发生反应HA-+OH-=A2-+H2O |
| D.在pH=4.3时,c(Na+)+c(H+)=c(OH-)+2c(HA-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】硼酸 在水溶液中存在电离平衡:
在水溶液中存在电离平衡: 。用
。用 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 ,混合溶液的
,混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
 在水溶液中存在电离平衡:
在水溶液中存在电离平衡: 。用
。用 溶液分别滴定体积均为
溶液分别滴定体积均为 的
的 硼酸溶液、
硼酸溶液、 硼酸和甘露醇混合溶液,滴定过程中硼酸溶液
硼酸和甘露醇混合溶液,滴定过程中硼酸溶液 ,混合溶液的
,混合溶液的 随加入的
随加入的 溶液体积的变化如图。
溶液体积的变化如图。
已知:
| A.加入甘露醇不利于硼酸的准确滴定 |
B.从 滴定到 滴定到 ,混合溶液的 ,混合溶液的 比硼酸溶液的 比硼酸溶液的 大 大 |
C.P点: |
D.W点: |
您最近一年使用:0次

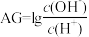 )与盐酸体积(V)之间的关系如图所示
)与盐酸体积(V)之间的关系如图所示