近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”),其判断理由是_______ 。
(2)Fe成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______ 。
(3)比较离子半径:F-______ O2-(填“大于”“等于”或“小于”)。
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
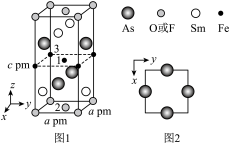
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为_______ 、_______ 。
(1)元素As与N同族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)比较离子半径:F-
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
更新时间:2022-12-18 15:43:35
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表为元素周期表中的短周期元素部分,A~L分别为短周期元素。

(1)元素B的名称是_______ ,元素F在周期表的位置为_______ 。
(2)F、G、H三种元素的原子半径最小的是_______ (填元素名称);元素G、K形成的简单气态氢化物中,稳定性较强的是_______ (填氢化物化学式)。
(3)A~L元素中金属性最强元素的是_______ (填元素符号),请画出该单质在氧气中完全燃烧所得产物的电子式_______ 。
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为_______ 。
(5)现拟用如下装置,证明元素的非金属性强弱: ,请选用合适的试剂完成实验。
,请选用合适的试剂完成实验。


(1)元素B的名称是
(2)F、G、H三种元素的原子半径最小的是
(3)A~L元素中金属性最强元素的是
(4)已知I、J的最高价氧化物的水化物能相互反应,其离子方程式为
(5)现拟用如下装置,证明元素的非金属性强弱:
 ,请选用合适的试剂完成实验。
,请选用合适的试剂完成实验。
| 实验试剂 | 甲: |
| 可得出结论的实验现象 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】Ⅰ.A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)B为_______ ,D的最高价氧化物对应的水化物是______ ,简单离子半径大小B_______ (填“>”“<”或“=”)C。
(2)写出A、B的化合物与E反应的化学方程式:_______ 。
(3)A、B两元素形成的化合物属于______ (填“离子”或“共价”)化合物。
Ⅱ.随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示。

回答下列问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为________ ,B的分子式为_________ 。
(2)比较e、f两种元素对应离子的半径大小______ (用元素离子符号表示);非金属性g_____ (填“强于”或“弱于”)h,用一个化学方程式证明你的判断________ 。
(1)B为
(2)写出A、B的化合物与E反应的化学方程式:
(3)A、B两元素形成的化合物属于
Ⅱ.随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如图所示。

回答下列问题:
(1)A、B均为以上某两种元素组成的分子,A中有四个原子核和10个电子,B中有6个原子核和18个电子,则A的分子式为
(2)比较e、f两种元素对应离子的半径大小
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】卤族元素在自然界中主要以卤化物形式存在,完成下列填空:
(1)工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
①铝土矿中 的晶体类型
的晶体类型_______ ;
②比较 的简单离子半径大小
的简单离子半径大小_______ ;
③ 最外层电子的电子云形状为
最外层电子的电子云形状为_______ 。
(2)从海水中获取的 主要用于氯碱工业,写出阳极的电极反应
主要用于氯碱工业,写出阳极的电极反应_______ 。
(3)采用“空气吹出法”从浓海水中吹出 ,并用纯碱吸收。纯碱吸收
,并用纯碱吸收。纯碱吸收 的主要反应为:
的主要反应为: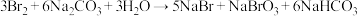 ,吸收
,吸收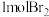 时,转移电子为
时,转移电子为_______ mol。
(4)工业生产纯碱的方法是:向饱和食盐水中通入 和
和 ,即有
,即有 晶体析出。结合速率与平衡理论解释
晶体析出。结合速率与平衡理论解释 析出的原因
析出的原因_______ 。
(5)向碘水溶液中通入过量的 ,发生反应:
,发生反应: ,配平上述方程式
,配平上述方程式_______ 。
(1)工业电解铝以铝土矿(Al2O3)为原料,冰晶石(Na3AlF4)为助熔剂。
①铝土矿中
 的晶体类型
的晶体类型②比较
 的简单离子半径大小
的简单离子半径大小③
 最外层电子的电子云形状为
最外层电子的电子云形状为(2)从海水中获取的
 主要用于氯碱工业,写出阳极的电极反应
主要用于氯碱工业,写出阳极的电极反应(3)采用“空气吹出法”从浓海水中吹出
 ,并用纯碱吸收。纯碱吸收
,并用纯碱吸收。纯碱吸收 的主要反应为:
的主要反应为: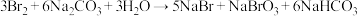 ,吸收
,吸收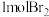 时,转移电子为
时,转移电子为(4)工业生产纯碱的方法是:向饱和食盐水中通入
 和
和 ,即有
,即有 晶体析出。结合速率与平衡理论解释
晶体析出。结合速率与平衡理论解释 析出的原因
析出的原因(5)向碘水溶液中通入过量的
 ,发生反应:
,发生反应: ,配平上述方程式
,配平上述方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、B、C、D、E为短周期元素且它们的原子序数依次增大,A的核外电子总数与其所在周期序数相同;D原子的L层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的L层中未成对电子数与D相同,但有空轨道;D与E同族。请回答下列问题:
(1)A与B、C、D、E元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为_______ ,其中心原子的杂化方式为_______ ;A分别与B、C、D形成的共价化合物中既含有极性键,又含有非极性键的是_______ (填化学式,任意写出三种)。
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的是_______ (写两种即可);酸根离子呈三角锥形的是_______ 。
(3)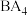 分子的空间结构为
分子的空间结构为_______ ;根据原子轨道重叠方式的不同,该分子中共价键的类型为_______ 。
(4)B的一种氢化物的相对分子质量是26,其分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
(1)A与B、C、D、E元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的化学式为
(2)这些元素形成的含氧酸根离子中,其中心原子的价层电子对数为3的是
(3)
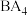 分子的空间结构为
分子的空间结构为(4)B的一种氢化物的相对分子质量是26,其分子中
 键与
键与 键的数目之比为
键的数目之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni、Cu等元素。回答下列问题:
(1)写出基态 的电子排布式:
的电子排布式:_______ 。
(2)P元素第一电离能大于S,原因为_______ 。
(3)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(4)氮化硼(BN)晶体存在如下图所示的两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。
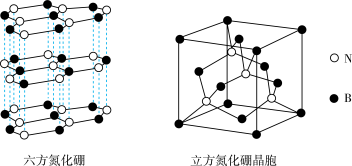
六方氮化硼的晶体类型为_______ ;立方氮化硼晶胞的密度为ρ g·cm ,晶胞的边长为acm。则阿伏加德罗常数的表达式为
,晶胞的边长为acm。则阿伏加德罗常数的表达式为_______ 。
(5)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是_______(填标号)。
(1)写出基态
 的电子排布式:
的电子排布式:(2)P元素第一电离能大于S,原因为
(3)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是(4)氮化硼(BN)晶体存在如下图所示的两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。

六方氮化硼的晶体类型为
 ,晶胞的边长为acm。则阿伏加德罗常数的表达式为
,晶胞的边长为acm。则阿伏加德罗常数的表达式为(5)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是_______(填标号)。
A. | B. |
C. | D. |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W、R、Q为元素周期表中前四周期的六种元素。
回答下列问题:
(1)R在周期表中的位置为___________ ,基态Q原子价电子轨道表示式为___________ 。
(2)WX3的电子式为___________ ,其中W的轨道杂化方式为___________ ,分子的空间构型为___________ 。
(3)X、Y、Z、W的电负性由大到小顺序为___________ (用元素符号表示)。
(4)Y、Z、W三者简单氢化物的键角由大到小的顺序为___________ (用化学式表示)。
(5)W的简单氢化物极易溶于水,原因是___________ 。
| X | 元素的非金属性最强 |
| Y | 核外有三个能级,每个能级的电子数相等 |
| Z | 原子2p轨道上成对电子数等于未成对电子数 |
| W | 第二周期中单电子数最多 |
| R | 核外电子占据9个轨道,有2个未成对电子 |
| Q | 原子序数等于Z与R二种元素原子序数之和 |
回答下列问题:
(1)R在周期表中的位置为
(2)WX3的电子式为
(3)X、Y、Z、W的电负性由大到小顺序为
(4)Y、Z、W三者简单氢化物的键角由大到小的顺序为
(5)W的简单氢化物极易溶于水,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】铁在史前就为人们所知,铁及其化合物推动了人类文明的发展。回答下列问题:
(1)Fe元素位于元素周期表的_______ 区,基态Fe2+的核外电子排布式为_______ 。
(2)复盐NH4Fe(SO4)2·12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素第一电离能由小到大的顺序是_______ ,阴离子的空间构型为_______ 。 的键角比NH3的键角
的键角比NH3的键角_______ (填“大”或“小”)。
(3)三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为_______ , 过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:①dsp2、 ②sp3d、③sp3d2,该二聚体中Fe采取的杂化类型为_______ (填标号)。

(4)三种化合物的熔点如下表所示:
试解释其熔点差异的原因:_______ 。
(5)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为_______ g·cm-3 (设NA为阿伏加德罗常数的值,写出表达式),Cu完全替代该晶体中b位置Fe,形成Cu替代型产物Fe(x-n)CunNy, n:y=_______ 。

(1)Fe元素位于元素周期表的
(2)复盐NH4Fe(SO4)2·12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素第一电离能由小到大的顺序是
 的键角比NH3的键角
的键角比NH3的键角(3)三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为

(4)三种化合物的熔点如下表所示:
| 化合物 | FeCl3 | NaCl | MgO |
| 熔点/℃ | 308 | 801 | 2852 |
试解释其熔点差异的原因:
(5)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答下列问题:
(1)基态镓原子的价电子排布式为:______ ,它位于元素周期表的位置是______ 。
(2)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是______ (填序号)。
(3)上述材料所涉及的四种元素中,原子半径最小的是______ (填元素符号,下同),第一电离能I1最大的是______ 。
(4)原硅酸根SiO 的空间构型是
的空间构型是______ ,其中Si的杂化轨道类型为______ 。
(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为_______ ,若晶体的密度为ρg•cm-3,阿伏加德罗常数为NA,则距离最近的Si原子与C原子之间的距离为_______ cm。(用ρ和NA的式子表示)

(1)基态镓原子的价电子排布式为:
(2)①金刚石、②晶体硅、③碳化硅,三者熔点由低到高的顺序是
(3)上述材料所涉及的四种元素中,原子半径最小的是
(4)原硅酸根SiO
 的空间构型是
的空间构型是(5)碳化硅(SiC)的结构与金刚石类似,碳化硅的硬度仅次于金刚石,其晶胞结构如图所示。则Si原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】硼及其化合物是用途广泛的化工原料,可以应用于新型材料的制备。回答下列问题:
(1)基态硼原子的价电子排布式为___________ ;与硼同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________ 。
(2)碳化硼(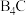 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于___________ 晶体。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)自然界中含硼钠盐是一种天然矿藏,其化学式为 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填标号)。
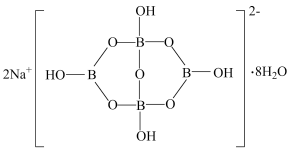
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4) 的空间构型为
的空间构型为___________ , 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因___________ 。
(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有___________ ,组成该有机物的第二周期元素电负性由大到小的顺序为___________ 。

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为___________ (填标号)。

②若晶胞的边长为apm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
(1)基态硼原子的价电子排布式为
(2)碳化硼(
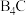 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)自然界中含硼钠盐是一种天然矿藏,其化学式为
 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)
 的空间构型为
的空间构型为 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为

②若晶胞的边长为apm,阿伏加德罗常数的值为
 ,则晶体的密度为
,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】“物质的性质、性能,不仅与组成有关,还与晶体结构有关。完成如下有关的问题。
(1)原子中电子有两种自旋状态,可分别用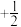 和
和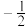 表示,称为电子的自旋磁量子数。则
表示,称为电子的自旋磁量子数。则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为________ ;从结构上分析基态 、
、 ,
,_______ 更稳定,原因是___________ 。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为______ ,其中Fe的配位数为_________ 。
(3)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。
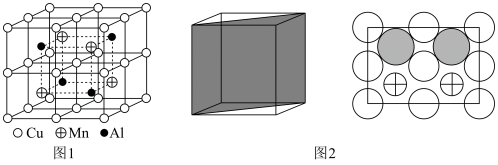
将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是________。(填字母序号)
(1)原子中电子有两种自旋状态,可分别用
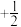 和
和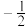 表示,称为电子的自旋磁量子数。则
表示,称为电子的自旋磁量子数。则 中电子自旋磁量子数的代数和为
中电子自旋磁量子数的代数和为 、
、 ,
,(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(3)Cu-Mn-Al合金的晶胞如图1所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,如图2是沿立方格子对角面取得的截图。

将Cu-Mn-Al合金晶胞沿棱投影于垂直面的是________。(填字母序号)
A.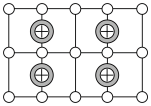 | B. | C.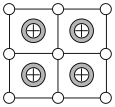 | D.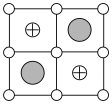 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】如图所示是金刚石的晶胞结构,除顶点和面心上有碳原子外,体内还有4个碳原子。回答下列问题: 的分数坐标分别为
的分数坐标分别为 ,则原子
,则原子 的分数坐标为
的分数坐标为___________ 。若金刚石的晶胞参数为 ,则碳原子的半径约为
,则碳原子的半径约为___________  (用含
(用含 的代数式表示)。
的代数式表示)。
(2)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是___________ ;下图是立方氮化硼晶胞沿 轴的投影图,请在图中圆球上涂“●”和画“
轴的投影图,请在图中圆球上涂“●”和画“ ”分别标明
”分别标明 与
与 的相对位置
的相对位置___________ ;硼原子周围等距且最近的硼原子数为___________ ; 原子的杂化方式为
原子的杂化方式为___________ 。设 为阿伏加德罗常数的值,若立方氮化硼的晶体密度为
为阿伏加德罗常数的值,若立方氮化硼的晶体密度为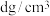 ,则晶胞参数a=
,则晶胞参数a=___________ nm。

 的分数坐标分别为
的分数坐标分别为 ,则原子
,则原子 的分数坐标为
的分数坐标为 ,则碳原子的半径约为
,则碳原子的半径约为 (用含
(用含 的代数式表示)。
的代数式表示)。(2)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是
 轴的投影图,请在图中圆球上涂“●”和画“
轴的投影图,请在图中圆球上涂“●”和画“ ”分别标明
”分别标明 与
与 的相对位置
的相对位置 原子的杂化方式为
原子的杂化方式为 为阿伏加德罗常数的值,若立方氮化硼的晶体密度为
为阿伏加德罗常数的值,若立方氮化硼的晶体密度为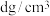 ,则晶胞参数a=
,则晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】在我国南海300~500m海底深处沉积物中存在着大量的“可燃冰”,其主要成分为甲烷水合物。在常温、常压下它会分解成水和甲烷,因而得名。请回答下列问题:

(1)甲烷晶体的晶胞结构如图所示,下列说法正确的是__ (填序号)。
A.甲烷晶胞中的球只代表一个C原子
B.晶体中1个CH4分子中有12个紧邻的CH4分子
C.CH4熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
E.CH4是非极性分子
(2)水在不同的温度和压强条件下可以形成多种不同结构的晶体,冰晶体结构有多种。其中冰Ⅶ的晶体结构如图所示。

①水分子的立体结构是___ 形,在酸性溶液中,水分子容易得到一个H+,形成水合氢离子(H3O+),水分子能与H+形成配位键,其原因是在氧原子上有__ ,应用价层电子对互斥理论(或模型)推测H3O+的形状为___ 。
②上述冰晶体中每个水分子与周围___ 个水分子以氢键结合,该晶体中1mol水形成___ mol氢键。
③实验测得冰中氢键的作用能为18.5kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,这说明___ 。

(1)甲烷晶体的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的球只代表一个C原子
B.晶体中1个CH4分子中有12个紧邻的CH4分子
C.CH4熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
E.CH4是非极性分子
(2)水在不同的温度和压强条件下可以形成多种不同结构的晶体,冰晶体结构有多种。其中冰Ⅶ的晶体结构如图所示。

①水分子的立体结构是
②上述冰晶体中每个水分子与周围
③实验测得冰中氢键的作用能为18.5kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,这说明
您最近一年使用:0次



