CrO 和Cr2O
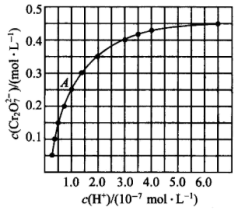
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
(1)向黄色的K2CrO4溶液中滴加稀硫酸,溶液变为橙色,用离子方程式表示该转化反应:_____ 。
(2)下列可判断转化反应达到平衡的是_____ (填标号)。
a.溶液的pH不再变化 b.v(H+)=2v(Cr2O )
)
c.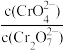 不再变化 d.c(CrO
不再变化 d.c(CrO )=0.45mol/L
)=0.45mol/L
(3)由图可知,溶液酸性增强,CrO 的平衡转化率
的平衡转化率_____ (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为_____ 。
(4)升高温度,溶液中CrO 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H____ 0(填“>”“<”或“=”)。
 和Cr2O
和Cr2O 在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O
在溶液中可相互转化。室温下,初始浓度为1.0mol/L的K2CrO4溶液中,c(Cr2O )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
(1)向黄色的K2CrO4溶液中滴加稀硫酸,溶液变为橙色,用离子方程式表示该转化反应:
(2)下列可判断转化反应达到平衡的是
a.溶液的pH不再变化 b.v(H+)=2v(Cr2O
 )
)c.
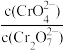 不再变化 d.c(CrO
不再变化 d.c(CrO )=0.45mol/L
)=0.45mol/L(3)由图可知,溶液酸性增强,CrO
 的平衡转化率
的平衡转化率(4)升高温度,溶液中CrO
 的平衡转化率减小,则该反应的△H
的平衡转化率减小,则该反应的△H
更新时间:2023-01-10 20:00:49
|
相似题推荐
【推荐1】“低碳经济”备受关注,CO2的有效开发利用成为科学家研究的重要课题。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳,反应方程式为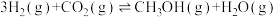 ΔH<0,一定温度下,于恒容密闭容器中充入
ΔH<0,一定温度下,于恒容密闭容器中充入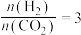 ,反应开始进行。
,反应开始进行。
(1)下列能说明该反应已经达到平衡状态的是_______(填字母代号)。
(2)上述投料在不同条件下达到平衡,设体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p变化曲线、在p=5×105Pa下的x(CH3OH)~t变化曲线如图所示。
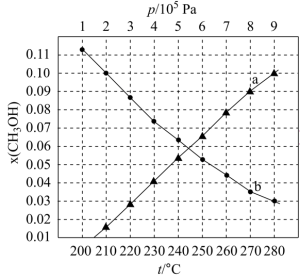
①图中对应等压过程的曲线是_______ 。
②当x(CH3OH)=0.10时,CO2的平衡转化率α=_______ ,反应条件可能为_______ 。
(3)温度为T时,向密闭恒容容器中充入3molH2和1molCO2的混合气体,此时容器内压强为4P,当CO2的转化率为50%时该反应达到平衡,则该温度下,此反应的平衡常数Kp=_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
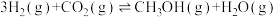 ΔH<0,一定温度下,于恒容密闭容器中充入
ΔH<0,一定温度下,于恒容密闭容器中充入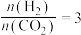 ,反应开始进行。
,反应开始进行。(1)下列能说明该反应已经达到平衡状态的是_______(填字母代号)。
| A.c(CH3OH)与c(CO2)比值不变 |
| B.容器中混合气体的密度不变 |
| C.3v正(H2)=v逆(CH3OH) |
| D.容器中混合气体的平均摩尔质量不变 |

①图中对应等压过程的曲线是
②当x(CH3OH)=0.10时,CO2的平衡转化率α=
(3)温度为T时,向密闭恒容容器中充入3molH2和1molCO2的混合气体,此时容器内压强为4P,当CO2的转化率为50%时该反应达到平衡,则该温度下,此反应的平衡常数Kp=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】有科研工作者研究利用H2S废气制取H2,反应原理2H2S(g) 2H2(g)+S2(g)。在2L的恒容密闭容器中,H2S的起始物质的量均为1mol,控制不同温度进行此反应。实验过程中测得H2S的转化率如图所示。
2H2(g)+S2(g)。在2L的恒容密闭容器中,H2S的起始物质的量均为1mol,控制不同温度进行此反应。实验过程中测得H2S的转化率如图所示。

【注】曲线a表示H2S的平衡转化率与温度的关系;曲线b表示不同温度下反应经过相同时间时H2S的转化率。
完成下列填空:
(1)写出该反应的平衡常数表达式:K=___ 。下列能作为判断其达到平衡状态的标志是___ (选填编号)。
①2v正(H2S)=v逆(S2)
②[H2S]:[H2]:[S2]=2:2:1
③[H2S]、[H2]、[S2]各自不再变化
④容器内气体密度不再变化
⑤容器内气体平均摩尔质量不再变化
(2)下列关于正反应方向反应热效应的推断合理的是___ (选填字母)。
a.根据曲线a可知为吸热反应b.根据曲线a可知为放热反应
c.根据曲线b可知为吸热反应d.根据曲线b可知为放热反应
(3)985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则5s内反应速率v(S2)=___ mol·L-1·s-1。
(4)随着温度升高,曲线b向a逐渐靠近,说明对于该反应,不改变其他条件的情况下,升温能够__ (选填字母)。
a.仅加快正反应速率b.仅加快逆反应速率
c.提高H2S的分解率d.缩短达到平衡所需的时间
(5)H2S尾气可用硫酸铜溶液吸收,写出反应的离子方程式___ 。
 2H2(g)+S2(g)。在2L的恒容密闭容器中,H2S的起始物质的量均为1mol,控制不同温度进行此反应。实验过程中测得H2S的转化率如图所示。
2H2(g)+S2(g)。在2L的恒容密闭容器中,H2S的起始物质的量均为1mol,控制不同温度进行此反应。实验过程中测得H2S的转化率如图所示。
【注】曲线a表示H2S的平衡转化率与温度的关系;曲线b表示不同温度下反应经过相同时间时H2S的转化率。
完成下列填空:
(1)写出该反应的平衡常数表达式:K=
①2v正(H2S)=v逆(S2)
②[H2S]:[H2]:[S2]=2:2:1
③[H2S]、[H2]、[S2]各自不再变化
④容器内气体密度不再变化
⑤容器内气体平均摩尔质量不再变化
(2)下列关于正反应方向反应热效应的推断合理的是
a.根据曲线a可知为吸热反应b.根据曲线a可知为放热反应
c.根据曲线b可知为吸热反应d.根据曲线b可知为放热反应
(3)985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则5s内反应速率v(S2)=
(4)随着温度升高,曲线b向a逐渐靠近,说明对于该反应,不改变其他条件的情况下,升温能够
a.仅加快正反应速率b.仅加快逆反应速率
c.提高H2S的分解率d.缩短达到平衡所需的时间
(5)H2S尾气可用硫酸铜溶液吸收,写出反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
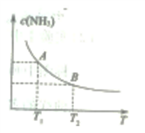
【推荐3】一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的气体物质的量为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是_______
(2)N2的转化率α%=_______
(3)该温度下,反应的化学平衡常数K=_______ 。
(1)能判断该反应达到平衡状态的依据是_______
| A.断开3molH-H键的同时断开2molN-H键 | B.c(N2):c(H2):c(NH3)=1:3:2 |
| C.混合气体的平均相对分子质量不变 | D.容器内密度不变 |
(3)该温度下,反应的化学平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
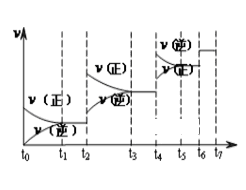
(1)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是______________________ ;图中表示平衡混合物中CO的含量最高的一段时间是____________ 。
(2)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是__________________ (提示:272 = 729)。
 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)(1)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是
(2)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硫酸工业中SO2转化为SO3是重要的反应之一,常压和催化剂作用下在2L恒容的密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的平衡转化率随温度的变化如下表所示:
2SO3(g),SO2的平衡转化率随温度的变化如下表所示:
(1)由表中数据判断该反应逆反应的ΔH________ 0(填“>”、“=”或“<”)。
(2)能判断该反应达到平衡状态的是___________ 。
A.容器的压强不变
B.混合气体的密度不变
C.c(SO2)=c(SO3)
D.混合气体中SO3的浓度不变
E.v正(SO2)=v正(SO3)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为____________________________ 。
②此时的温度为_________ 。
③此温度下的平衡常数为_____________ (用最简化的分数表示)。
(4)硫酸工业上该反应采用450℃的高温,但没有使用高压,其理由是_________________________________________________________________________________________ 。
 2SO3(g),SO2的平衡转化率随温度的变化如下表所示:
2SO3(g),SO2的平衡转化率随温度的变化如下表所示:| 温度(℃) | 450 | 500 | 550 | 600 |
| SO2的平衡转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
(1)由表中数据判断该反应逆反应的ΔH
(2)能判断该反应达到平衡状态的是
A.容器的压强不变
B.混合气体的密度不变
C.c(SO2)=c(SO3)
D.混合气体中SO3的浓度不变
E.v正(SO2)=v正(SO3)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol·L-1。
①0-2min之间,O2的反应速率为
②此时的温度为
③此温度下的平衡常数为
(4)硫酸工业上该反应采用450℃的高温,但没有使用高压,其理由是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某化学反应2A⇌B+D在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20min时间内平均速率为___________ mol·(L·min)-1。
(2)在实验2中A的初始浓度C2=___________ mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是___________ 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3___________ v1(填“>”“=”或“<”=,且C3___________ 1.0mol·L-1(填“>”“=”或“<”=)。
(4)比较实验4和实验1,可推测该反应是___________ 反应(选填“吸热”或“放热”),理由是___________ 。
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1,反应在10至20min时间内平均速率为
(2)在实验2中A的初始浓度C2=
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3
(4)比较实验4和实验1,可推测该反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
【推荐1】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的
_______ 0(填写“>”、“<”、“=”。
(2)前2s内的平均反应速率v(N2)=_____________ 。
(3)在该温度下,反应的平衡常数K=______________ 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是_____ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①请在上表格中填入剩余的实验条件数据________________ 。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________________ 。
2NO+2CO
 2CO2+N2
2CO2+N2为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
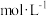 | 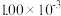 | 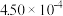 | 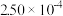 | 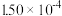 | 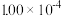 | 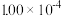 |
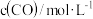 | 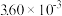 | 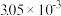 | 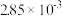 | 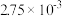 | 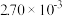 | 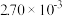 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的

(2)前2s内的平均反应速率v(N2)=
(3)在该温度下,反应的平衡常数K=
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | NO初始浓度 mol•L-1 | CO初始浓度 mol•L-1 | 催化剂的比表面积 ㎡  g-1 g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】近年来,有机液体氢化物储氢技术已被认为是长距离、大规模氢能输送的有效手段。其中某制氢、储氢系统包括以下三个阶段。回答下列问题:
释氢
一定条件下,环己烷的气相脱氢反应为: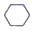 (g)
(g)
 (g)+3H2(g)△H>0。
(g)+3H2(g)△H>0。
①恒压下, 起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。
起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。
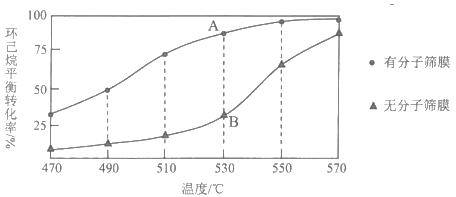
环己烷平衡转化率随温度升高而增大的原因是___ 。A点环己烷平衡转化率高于B点的原因为___ 。
②某温度下,恒容密闭容器中,若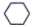 的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=
的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=___ (mol▪L-1)3(用含a、b的代数式表示)。
释氢
一定条件下,环己烷的气相脱氢反应为:
 (g)
(g)
 (g)+3H2(g)△H>0。
(g)+3H2(g)△H>0。①恒压下,
 起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。
起始浓度相同时,该反应在有、无分子筛膜时环己烷的平衡转化率随温度的变化如图所示,其中分子筛膜能选择性分离出H2。
环己烷平衡转化率随温度升高而增大的原因是
②某温度下,恒容密闭容器中,若
 的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=
的起始物质的量浓度为amol▪L-1,达到平衡时,H2的产率为b,则该温度下反应的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol。
(1)写出合成氨的热反应方程式__________ 。生成1 mol NH3需要吸收或放出_______ kJ的热量。
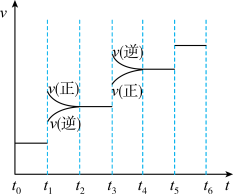
(2)当合成氨反应达到平衡后,改变某一外界条件 不改变N2、H2和NH3的量
不改变N2、H2和NH3的量 ,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是
,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是_______ 。其中表示平衡混合物中NH3的含量最高的一段时间是________ 。
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为_________ 。
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得c(N2)=1 mol/L,c(H2)=3 mol/L,c(NH3)=2 mol/L,此时可逆反应_________ 。
A.向正方向进行 B.向逆方向进行 C处于平衡状态
(1)写出合成氨的热反应方程式
(2)当合成氨反应达到平衡后,改变某一外界条件
 不改变N2、H2和NH3的量
不改变N2、H2和NH3的量 ,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是
,反应速率与时间的关系如图所示图中t1时引起平衡移动的条件可能是
(3)温度为T℃时,将2a molH2和a molN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为
(4)已知373K时,可逆反应平衡常数为K=0.12,若某时刻时,测得c(N2)=1 mol/L,c(H2)=3 mol/L,c(NH3)=2 mol/L,此时可逆反应
A.向正方向进行 B.向逆方向进行 C处于平衡状态
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在一定条件下,反应A(g)+B(g) ⇋ C(g),∆H < 0,达到平衡后,根据下列图像判断:
(1)升温,达到新的平衡的是( ) ;
(2)降压,达到新的平衡的是( ) ;
(3)减少C的量,移向新平衡的是( ) ;
(4)增加A的量,移向新平衡的是( ) ,此时B的转化率___________ (填“增大”或“减小”或“不变”,下空同);
(5)使用催化剂,达到平衡的是( ) ,C的质量分数_________ 。

(1)升温,达到新的平衡的是
(2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是
(4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)已知:N N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式_______________________________ ;该反应的熵变△S___ 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为_________ 。
②当温度由T1变化到T2(T2>T1)时(如图),平衡常数KA_________ KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1mol。当反应达到平衡时,与起始时比较,___________________ (填化学式)的物质的量增加。
 N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为
②当温度由T1变化到T2(T2>T1)时(如图),平衡常数KA

③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1mol。当反应达到平衡时,与起始时比较,
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】根据所学知识回答下列问题:
I.用纯净的锌粒与稀盐酸反应制取氢气,请回答:

(1)实验过程如图所示,化学反应速率最快的是_______
A.OE段 B.EF段 C.FG段
(2)请解释图中曲线变化的原因:_______ 。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质少许,可行的是_______。
II.在温度为373K时,将0.100mol N2O4气体通入1L的恒容密闭容器中,发生反应N2O4(g) 2NO2(g)。下图是测定到的N2O4的浓度变化曲线图。
2NO2(g)。下图是测定到的N2O4的浓度变化曲线图。

(4)计算在20至40秒时间内,NO2的平均生成速率为_______ 。
(5)该反应的化学平衡常数表达式为_______ 。
(6)下表是不同温度下测定得到的该反应的化学平衡常数。
据此可推测该反应(生成NO2)是_______ 反应(选填“吸热”或“放热”)。
(7)反应达平衡后再加入0.100mol的N2O4气体,推测反应重新达到平衡后N2O4的转化率_______ (选填“增大”、“不变”或“减小”)
I.用纯净的锌粒与稀盐酸反应制取氢气,请回答:

(1)实验过程如图所示,化学反应速率最快的是
A.OE段 B.EF段 C.FG段
(2)请解释图中曲线变化的原因:
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质少许,可行的是_______。
| A.NaCl溶液 | B.硫酸铜溶液 | C.浓盐酸 | D.CH3COONa固体 |
II.在温度为373K时,将0.100mol N2O4气体通入1L的恒容密闭容器中,发生反应N2O4(g)
 2NO2(g)。下图是测定到的N2O4的浓度变化曲线图。
2NO2(g)。下图是测定到的N2O4的浓度变化曲线图。
(4)计算在20至40秒时间内,NO2的平均生成速率为
(5)该反应的化学平衡常数表达式为
(6)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/K | 323 | 373 |
| K值 | 0.022 | 0.36 |
(7)反应达平衡后再加入0.100mol的N2O4气体,推测反应重新达到平衡后N2O4的转化率
您最近一年使用:0次



