物质的制备、分离、检验、性质的探究均离不开化学实验。回答下列问题:
(1)下列实验说明乙酸是弱酸,理由最充分的是_______。
(2)只用一种试剂可以区分乙醇、乙醛、乙酸和甲酸,该试剂可以是_______。
(3)下列实验方案可行的是_______。
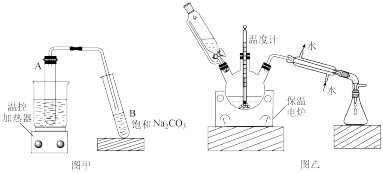
为研究乙酸与乙醇的反应,并制备乙酸乙酯,某研究小组参照图甲,设计了图乙的装置(部分夹持仪器略),其中保温电炉既可以使受热均匀,又可以控制加热温度。
实验前,他们还查阅了一些数据,见下表:
他们还查得制备乙酸乙酯温度70~80℃最佳,乙酸丁酯115~125℃最佳
实验方案如下:在三颈瓶(也称“三口烧瓶”)内将过量的乙醇与少量浓硫酸混合,加入少量沸石(或碎瓷片),然后经恒压滴液漏斗边滴加冰醋酸边加热蒸馏,得到含乙醇、醋酸和水的乙酸乙酯粗产品。
回答下列问题:
(4)图甲采用水浴加热的优点是_______ ,如果制备乙酸丁酯则不可以采用水浴加热,原因是_______ 。用图甲装置一段时间后,试管B中出现的现象是_______ ,实验结束后将试管B充分振荡,发生反应的离子方程式是_______ 。
(5)请结合勒夏特列原理解释,用恒压滴液漏斗边滴加冰醋酸边加热蒸馏的好处是_______ 。
(6)若用图乙装置制备乙酸丁酯,也用同样的操作则不可行,原因是_______ 。
(7)同位素示踪是化学上研究反应原理的重要手段,为研究乙醇与乙酸酯化脱水的反应原理,可将乙酸或乙醇中的O用18O代替,下列替换的物质没有意义的是_______ (填字母序号)。
a. b.
b.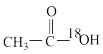 c.CH3CH218OH
c.CH3CH218OH
制得粗产品中含乙酸乙酯、乙酸和乙醇,该小组采取下图步骤分离并回收乙酸乙酯、乙酸和乙醇。

回答下列问题:
(8)试剂I是饱和Na2CO3溶液,不用饱和NaOH的原因可能是_______ 。
(9)实验室完成分离方法I需要的玻璃仪器除烧杯(或锥形瓶)外,还需要_______ 。
(10)试剂II是_______ ,分离方法II和分离方法III均是_______ 。
(1)下列实验说明乙酸是弱酸,理由最充分的是_______。
| A.乙酸溶液中滴入石蕊试液,溶液显红色 |
| B.常温下,测得0.1mol·L-1乙酸溶液的pH约为3 |
| C.乙酸能与NaOH溶液反应 |
| D.乙酸溶液滴入Na2CO3固体,会产生气泡 |
| A.新制氢氧化铜悬浊液 | B.银氨溶液 | C.水 | D.Na2CO3溶液 |
| A.用浓溴水将苯中混有的苯酚沉淀除去 |
| B.用溴水检验CH2=CHCH2CHO中存在碳碳双键 |
| C.用席夫试剂检验乙醇氧化产物是否含醛 |
| D.用苯酚的酒精溶液验证苯酚可与金属钠反应 |
为研究乙酸与乙醇的反应,并制备乙酸乙酯,某研究小组参照图甲,设计了图乙的装置(部分夹持仪器略),其中保温电炉既可以使受热均匀,又可以控制加热温度。

实验前,他们还查阅了一些数据,见下表:
| 物质的结构简式 | CH3COOC2H5 | C2H5OH | CH3COOH | CH3(CH2)3OH | CH3COOC4H9 |
| 物质的名称 | 乙酸乙酯 | 乙醇 | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 沸点(℃) | 77.1 | 78.3 | 118 | 117.2 | 126.3 |
实验方案如下:在三颈瓶(也称“三口烧瓶”)内将过量的乙醇与少量浓硫酸混合,加入少量沸石(或碎瓷片),然后经恒压滴液漏斗边滴加冰醋酸边加热蒸馏,得到含乙醇、醋酸和水的乙酸乙酯粗产品。
回答下列问题:
(4)图甲采用水浴加热的优点是
(5)请结合勒夏特列原理解释,用恒压滴液漏斗边滴加冰醋酸边加热蒸馏的好处是
(6)若用图乙装置制备乙酸丁酯,也用同样的操作则不可行,原因是
(7)同位素示踪是化学上研究反应原理的重要手段,为研究乙醇与乙酸酯化脱水的反应原理,可将乙酸或乙醇中的O用18O代替,下列替换的物质没有意义的是
a.
 b.
b. c.CH3CH218OH
c.CH3CH218OH制得粗产品中含乙酸乙酯、乙酸和乙醇,该小组采取下图步骤分离并回收乙酸乙酯、乙酸和乙醇。

回答下列问题:
(8)试剂I是饱和Na2CO3溶液,不用饱和NaOH的原因可能是
(9)实验室完成分离方法I需要的玻璃仪器除烧杯(或锥形瓶)外,还需要
(10)试剂II是
更新时间:2023-01-20 16:13:43
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】氧化铋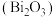 俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋(
俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:
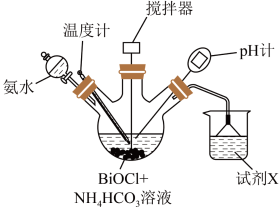
步骤1:准确称取 ,先与
,先与 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 下搅拌
下搅拌 可得前驱体(
可得前驱体( (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得 。
。
回答下列问题:
(1) 的原子序数为83,则
的原子序数为83,则 位于元素周期表第
位于元素周期表第_____ 周期,第_____ 族。
(2)试剂 的作用为
的作用为_____ 。
(3)步骤1中生成(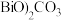 的化学方程式为
的化学方程式为_____ 。
(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至 ,取
,取 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用
溶液作指示剂,再用 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。
①分离前驱体的操作名称是_____ ;盛装标准 溶液应选用
溶液应选用_____ (填“酸式”或“碱式”)滴定管。
②若消耗 标准液的平均体积为
标准液的平均体积为 的摩尔质量为
的摩尔质量为 ,则脱氯率为
,则脱氯率为_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(5)灼烧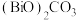 时用到的硅酸盐制品有
时用到的硅酸盐制品有_____ 、_____ 、酒精灯、玻璃棒,发生反应的化学方程式为_____ 。
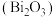 俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋(
俗称铋黄,是制作防火纸的材料之一、以白色难溶物氯氧化铋( )为原料转型脱氯制备氧化铋的方法如下:
)为原料转型脱氯制备氧化铋的方法如下:步骤1:准确称取
 ,先与
,先与 脱氯剂
脱氯剂 溶液混合,加入氨水至
溶液混合,加入氨水至 下搅拌
下搅拌 可得前驱体(
可得前驱体( (难溶于水),反应装置如图所示(加热装置已略去);
(难溶于水),反应装置如图所示(加热装置已略去);
步骤2:将前驱体干燥后灼烧,可得
 。
。回答下列问题:
(1)
 的原子序数为83,则
的原子序数为83,则 位于元素周期表第
位于元素周期表第(2)试剂
 的作用为
的作用为(3)步骤1中生成(
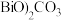 的化学方程式为
的化学方程式为(4)反应后,分离出三颈烧瓶的前驱体,用蒸馏水洗涤前驱体2-3次,将滤液和洗涤液合并,稀释至
 ,取
,取 于锥形瓶中,滴入2滴
于锥形瓶中,滴入2滴 溶液作指示剂,再用
溶液作指示剂,再用 标准
标准 溶液滴定,平行测定三组。
溶液滴定,平行测定三组。①分离前驱体的操作名称是
 溶液应选用
溶液应选用②若消耗
 标准液的平均体积为
标准液的平均体积为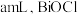 的摩尔质量为
的摩尔质量为 ,则脱氯率为
,则脱氯率为 (用含
(用含 的代数式表示)。
的代数式表示)。(5)灼烧
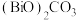 时用到的硅酸盐制品有
时用到的硅酸盐制品有
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】电解质溶液中存在着众多的化学平衡。已知室温下,电离平衡常数如下表
(1)室温下,有浓度均为 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH由大到小 的顺序为_______ (填序号)。
(2)根据以上的电离平衡常数,判断下列说法正确的是_______。
(3)根据以上的电离平衡常数,25℃时,浓度均为 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
_______ (填“>”“<”或“=”) 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可_______ (填序号)。
A.向 溶液中加适量水
溶液中加适量水
B.向 溶液中加适量NaOH固体
溶液中加适量NaOH固体
C.向 溶液中加
溶液中加 固体
固体
D.向 溶液中加适量的水
溶液中加适量的水
(4)草酸 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入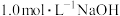 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为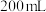 。测得溶液中微粒的
。测得溶液中微粒的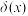 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。
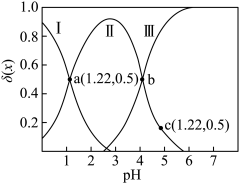
①当加入NaOH溶液的体积为 时,
时,
_______ (写关系式)。
②c点,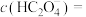
_______  。
。
| 物质 |  |  |  |  |  |
 |  | 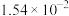 |  |  |  |
 | 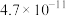 |  | —— | —— | —— |
 的五种溶液①
的五种溶液① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,溶液的pH
,溶液的pH(2)根据以上的电离平衡常数,判断下列说法正确的是_______。
A.相同条件下,同浓度的 溶液和 溶液和 溶液的碱性,前者更强 溶液的碱性,前者更强 |
B. 溶液中通入少量 溶液中通入少量 : : |
C. 溶液中通入少量 溶液中通入少量 : :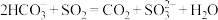 |
D.向氯水中分别加入等浓度的 和 和 溶液,均可提高氯水中 溶液,均可提高氯水中 的浓度 的浓度 |
 的
的 溶液和
溶液和 溶液,两溶液中
溶液,两溶液中
 。若要使两溶液的pH相等,可
。若要使两溶液的pH相等,可A.向
 溶液中加适量水
溶液中加适量水B.向
 溶液中加适量NaOH固体
溶液中加适量NaOH固体C.向
 溶液中加
溶液中加 固体
固体D.向
 溶液中加适量的水
溶液中加适量的水(4)草酸
 是二元弱酸。室温下,向
是二元弱酸。室温下,向 溶液中加入
溶液中加入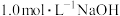 溶液调节pH,加水控制溶液体积为
溶液调节pH,加水控制溶液体积为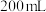 。测得溶液中微粒的
。测得溶液中微粒的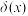 随pH变化曲线如图所示,
随pH变化曲线如图所示, ,x代表微粒
,x代表微粒 、
、 或
或 。
。
①当加入NaOH溶液的体积为
 时,
时,
②c点,
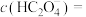
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
(1)下列不能说明HNO2是弱电解质的是_____ 。
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____ (填“酸性”、“碱性”或“中性”);298K时,将10mL pH=3的亚硝酸溶液与10mL pH=11氨水混合,所得溶液为_____ (填“酸性”、“碱性”或“中性”)。
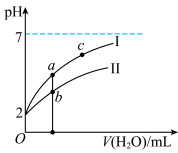
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______ (填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是_______ (用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是__________ 。
(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为___________________ 。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________ 。
| HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
| K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
a.常温下0.1 mol·L-1 NaNO2溶液的pH>7
b.用一定浓度HNO2溶液做导电实验,灯泡很暗
c.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
d.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为

(4)依据提供数据回答下列问题。
①NaH SO3在水溶液中的电离方程式为
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
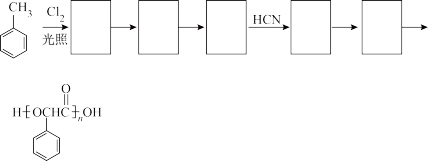
解答题-有机推断题
|
较难
(0.4)
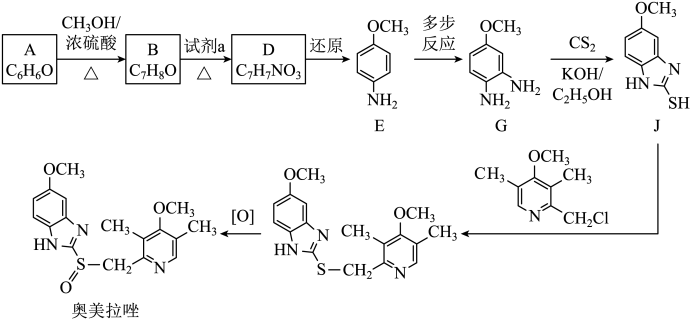
【推荐1】奥美拉唑可用于治疗十二指肠溃疡等疾病,其合成路线如图。
已知:R-NO2 R-NH2
R-NH2
(1)A能与FeCl3溶液作用显紫色,A的名称是______ 。
(2)A→B的化学方程式是______ 。
(3)试剂a是______ 。
(4)满足下列条件的E的同分异构有______ 种。
i.苯环上有两个取代基
ii.能与NaOH溶液发生反应
(5)E→G的过程:
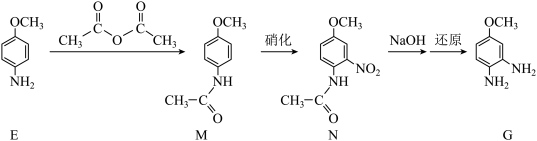
①M中含有的官能团有醚键、______ (写名称)。
②N与NaOH反应的化学方程式是______ 。
(6)合成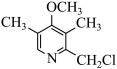 的路线如图。
的路线如图。
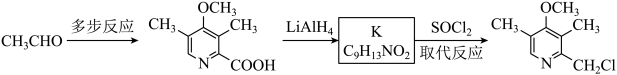
①CH3CHO可由CH≡CH与______ (填化学式)反应得到。
②已知SOCl2的结构简式为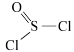 ,K转化为
,K转化为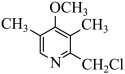 为取代反应,该反应的化学方程式是
为取代反应,该反应的化学方程式是______ 。

已知:R-NO2
 R-NH2
R-NH2(1)A能与FeCl3溶液作用显紫色,A的名称是
(2)A→B的化学方程式是
(3)试剂a是
(4)满足下列条件的E的同分异构有
i.苯环上有两个取代基
ii.能与NaOH溶液发生反应
(5)E→G的过程:

①M中含有的官能团有醚键、
②N与NaOH反应的化学方程式是
(6)合成
 的路线如图。
的路线如图。
①CH3CHO可由CH≡CH与
②已知SOCl2的结构简式为
 ,K转化为
,K转化为 为取代反应,该反应的化学方程式是
为取代反应,该反应的化学方程式是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐2】聚甲基丙烯酸酯纤维广泛用于制作光导纤维。已知A为某种聚甲基丙烯酸酯纤维的单体,其转化关系如下:
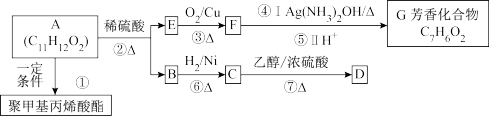
请按要求回答下列问题:
(1)反应①、②的反应类型分别为__________ 、_________ 。
(2)B所含官能团的结构简式:______________________ ;检验其官能团所用化学试剂有______________ 。
(3)H是C的同系物,比C的相对分子质量大14,其核磁共振氢谱仅有2个吸收峰,H的名称(系统命名)为_________________ 。
(4)写出下列反应的化学方程式:④:________________ ⑦:_______________
(5)写出同时符合下列条件的B的同分异构体的结构简式:____________________ 。
①能与NaOH水溶液反应;
②能发生银镜反应;
③核磁共振氢谱有三组吸收峰,且峰面积之比为1:1:4
(6)已知: ;
;
请以甲苯为原料(其它原料任选)合成聚酯G即 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂____________________ 。

请按要求回答下列问题:
(1)反应①、②的反应类型分别为
(2)B所含官能团的结构简式:
(3)H是C的同系物,比C的相对分子质量大14,其核磁共振氢谱仅有2个吸收峰,H的名称(系统命名)为
(4)写出下列反应的化学方程式:④:
(5)写出同时符合下列条件的B的同分异构体的结构简式:
①能与NaOH水溶液反应;
②能发生银镜反应;
③核磁共振氢谱有三组吸收峰,且峰面积之比为1:1:4
(6)已知:
 ;
;
请以甲苯为原料(其它原料任选)合成聚酯G即
 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
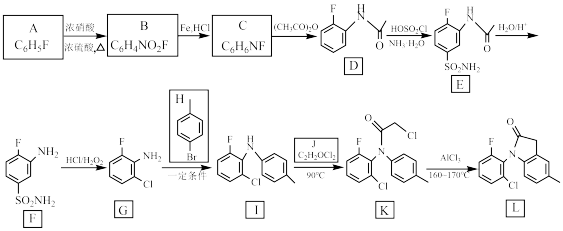
【推荐3】内酰胺是有机化合物中常见的一种环状结构,能维持某些化合物的抗菌活性,一种合成该类化合物的路线如下(部分反应条件已简化):
(1)B的结构简式为______ 。
(2)D所含官能团的名称为______ 、______ 。
(3)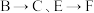 的反应类型分别是
的反应类型分别是______ 、______ 。
(4)J的结构简式为______ 。
(5)酸碱质子理论认为:凡是能接受氢离子的分子或离子称为碱。胺类化合物中氮原子含孤电子对,氮原子上的电子云密度越大,碱性越强。下列三种物质的碱性由强到弱的是______ (用序号表示)。 (吡啶)是一种重要的化工原料,该分子与苯相似,含有芳香环结构。满足下列条件的C的同分异构体有
(吡啶)是一种重要的化工原料,该分子与苯相似,含有芳香环结构。满足下列条件的C的同分异构体有______ 种。
a.含六元芳香环结构 b.不含N—F
(7)参照上述合成路线,以对二甲苯和J为原料,设计合成 的路线
的路线_______ (无机试剂任选)。
已知: 。
。
(1)B的结构简式为
(2)D所含官能团的名称为
(3)
 的反应类型分别是
的反应类型分别是(4)J的结构简式为
(5)酸碱质子理论认为:凡是能接受氢离子的分子或离子称为碱。胺类化合物中氮原子含孤电子对,氮原子上的电子云密度越大,碱性越强。下列三种物质的碱性由强到弱的是
① ②
② ③
③
 (吡啶)是一种重要的化工原料,该分子与苯相似,含有芳香环结构。满足下列条件的C的同分异构体有
(吡啶)是一种重要的化工原料,该分子与苯相似,含有芳香环结构。满足下列条件的C的同分异构体有a.含六元芳香环结构 b.不含N—F
(7)参照上述合成路线,以对二甲苯和J为原料,设计合成
 的路线
的路线
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
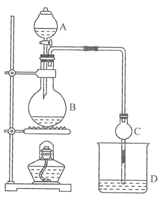
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
请回答:(1)浓硫酸的作用是__________________ ;写出合成乙酸乙酯的化学方程式:____________________
(2)球形干燥管C的作用是___________________________ 。
(3)饱和Na2CO3溶液的作用( )
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出__________ ;再加入(此空从下列选项中选择)_______ ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:(1)浓硫酸的作用是
(2)球形干燥管C的作用是
(3)饱和Na2CO3溶液的作用
A.中和乙酸和乙醇.
B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】(1)实验室用下图所示装置制备少量乙酸乙酯。

①写出制备乙酸乙酯的化学方程式_______________________ 。
②试管Ⅱ中盛的试剂是____________________________ 。
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是________ 。
(2)已知乳酸的结构简式为 。试回答:
。试回答:
①乳酸分子中含有________ 和_________ 两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为_____________________________ ;

①写出制备乙酸乙酯的化学方程式
②试管Ⅱ中盛的试剂是
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(2)已知乳酸的结构简式为
 。试回答:
。试回答:①乳酸分子中含有
②乳酸与足量金属钠反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】有机反应一般速率较小,副反应多,产物复杂。回答下面问题:
(1)有如下实验装置。

①实验室利用装置A用乙醇制乙烯,其中碎瓷片的作用是___________ 。反应方程式为___________ 。
②装置B可以做乙醛的银镜反应实验,该反应的化学方程式为___________ 。
③装置C可以制备乙酸乙酯,其中饱和碳酸钠溶液的作用是___________ 。向试管a中依次加入2mL乙醇、0.5mL___________ (填名称)、2mL乙酸和碎瓷片。本实验中既要对反应物加热,但又不能使温度过高,原因是___________ 。
(2)1-溴丙烷中溴元素的检验:
①向试管中加入少量1-溴丙烷,再加入 溶液,稍微加热一段时间,发生反应的化学方程式
溶液,稍微加热一段时间,发生反应的化学方程式___________ 。
②冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴2%的 溶液。试剂a是
溶液。试剂a是___________ (填化学式),实验现象是___________ 。
(3)某同学称取9g淀粉溶于水,测定淀粉的水解程度。其程序如下:

A溶液是___________ (填化学式,下同),B悬浊液是___________ 。淀粉是否完全水解___________ (填“是”或“否”)。
(1)有如下实验装置。

①实验室利用装置A用乙醇制乙烯,其中碎瓷片的作用是
②装置B可以做乙醛的银镜反应实验,该反应的化学方程式为
③装置C可以制备乙酸乙酯,其中饱和碳酸钠溶液的作用是
(2)1-溴丙烷中溴元素的检验:
①向试管中加入少量1-溴丙烷,再加入
 溶液,稍微加热一段时间,发生反应的化学方程式
溶液,稍微加热一段时间,发生反应的化学方程式②冷却,静置,待液体分层后,用滴管吸取少量上层液体,移入另一支盛有试剂a的试管中,然后滴加2滴2%的
 溶液。试剂a是
溶液。试剂a是(3)某同学称取9g淀粉溶于水,测定淀粉的水解程度。其程序如下:

A溶液是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
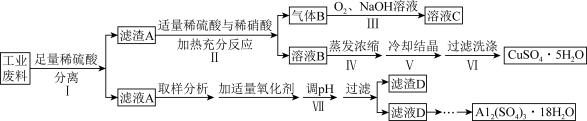
请回答:
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________ 。

(2)写出步骤Ⅱ中发生反应的离子方程式___________________ 。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________ 。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________ 。
(4)下列有关实验说法正确的是___________________ 。
A.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B.步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a
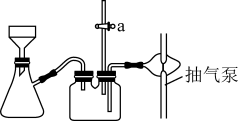
C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样ag溶于20mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mLZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666gmol-1,EDTA分别能与Al3+或Zn2+以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________ (用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________ 。

请回答:
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是

(2)写出步骤Ⅱ中发生反应的离子方程式
(3)步骤Ⅳ蒸发浓缩的具体操作是
(4)下列有关实验说法正确的是
A.步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B.步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a

C.步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D.步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样ag溶于20mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1mol·L-1EDTA溶液V1mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1ZnCl2溶液滴定过量的EDTA,达到终点时消耗V2mLZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666gmol-1,EDTA分别能与Al3+或Zn2+以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
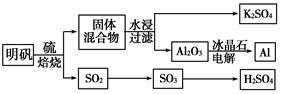
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是______________________ 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是__________________________ 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是__________________________ 。

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S
 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
(2)从水浸后的滤液中得到K2SO4晶体的方法是
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
您最近一年使用:0次
【推荐3】地球的表面积为 5.1 亿平方公里,其中海洋的面积为 3.67 亿平方公里,占整个地球表面积的 70.8 %。海洋是一个巨大的化学资源宝库,请回答下列问题:
Ⅰ 请列举海水淡化的一种方法____________________________ 。
II 下面是海水资源综合利用的部分流程图:

(1)步骤①中,粗盐中含有 Ca2+、Mg2+、 等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是
等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是_____ (填字母)。
(2)反应④由无水 MgCl2制取金属镁的常用工业方法是________________ (用化学方程式表示)。
(3)步骤⑤已经获得 Br2,步骤⑥又将 Br2还原为 Br-,其目的是________ 。写出步骤⑥反应的离子方程式 ______________________________ 。由海水提溴过程中的反应可得出 Cl-、SO2、Br-还原性由强到弱的顺序是____________________ 。
(4)工业上也可以用 Na2CO3溶液吸收吹出的 Br2,生成溴化钠和溴酸钠,同时放出 CO2。写出反应的离子方程式__________________________ 。最后再用H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为 ______________________________ 。
Ⅲ 海带灰中富含以 I- 形式存在的碘元素。实验室提取 I2的途径如图所示:

(1)灼烧海带至灰烬时所用的主要仪器名称是_______________ 。
(2)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_________ 。反应结束后,再加入 CCl4作萃取剂,振荡、静置,可以观察到 CCl4层呈 ______ 色。
Ⅰ 请列举海水淡化的一种方法
II 下面是海水资源综合利用的部分流程图:

(1)步骤①中,粗盐中含有 Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是
等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是(2)反应④由无水 MgCl2制取金属镁的常用工业方法是
(3)步骤⑤已经获得 Br2,步骤⑥又将 Br2还原为 Br-,其目的是
(4)工业上也可以用 Na2CO3溶液吸收吹出的 Br2,生成溴化钠和溴酸钠,同时放出 CO2。写出反应的离子方程式
Ⅲ 海带灰中富含以 I- 形式存在的碘元素。实验室提取 I2的途径如图所示:

(1)灼烧海带至灰烬时所用的主要仪器名称是
(2)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
您最近一年使用:0次



