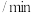2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由 、铝箔、炭黑等组成,
、铝箔、炭黑等组成, 、
、 、P具有极高的回收价值,具体流程如下:
、P具有极高的回收价值,具体流程如下:
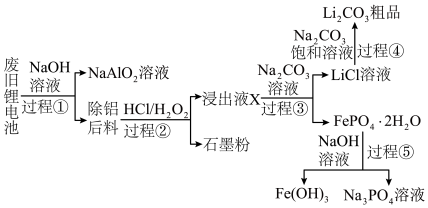
浸出液X的主要成分为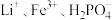 等。过程③控制碳酸钠溶液浓度20%、温度
等。过程③控制碳酸钠溶液浓度20%、温度 、反应时间
、反应时间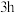 条件下,探究
条件下,探究 对磷酸铁沉淀的影响,如图所示。
对磷酸铁沉淀的影响,如图所示。
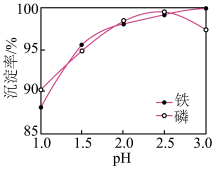
(1)综合考虑铁和磷沉淀率,最佳 为
为_______ 。
(2)结合平衡移动原理,解释过程③中 增大,铁和磷沉淀率增大的原因:
增大,铁和磷沉淀率增大的原因:_______ 。
(3)当 后,随
后,随 增加,磷沉淀率出现了减小的趋势,解释其原因:
增加,磷沉淀率出现了减小的趋势,解释其原因:_______ 。
 、铝箔、炭黑等组成,
、铝箔、炭黑等组成, 、
、 、P具有极高的回收价值,具体流程如下:
、P具有极高的回收价值,具体流程如下:
浸出液X的主要成分为
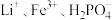 等。过程③控制碳酸钠溶液浓度20%、温度
等。过程③控制碳酸钠溶液浓度20%、温度 、反应时间
、反应时间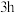 条件下,探究
条件下,探究 对磷酸铁沉淀的影响,如图所示。
对磷酸铁沉淀的影响,如图所示。
(1)综合考虑铁和磷沉淀率,最佳
 为
为(2)结合平衡移动原理,解释过程③中
 增大,铁和磷沉淀率增大的原因:
增大,铁和磷沉淀率增大的原因:(3)当
 后,随
后,随 增加,磷沉淀率出现了减小的趋势,解释其原因:
增加,磷沉淀率出现了减小的趋势,解释其原因:
2023高三·全国·专题练习 查看更多[2]
更新时间:2023-02-04 21:18:47
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】以氢气、一氧化碳为主要组分的合成气是一种重要的化工原料,可以合成二甲醚、甲醇等许多重要的化工产品。回答下列问题:
(1)已知反应Ⅰ: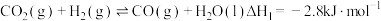
反应Ⅱ: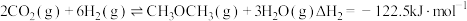
 液态水全部蒸发为气态水吸收
液态水全部蒸发为气态水吸收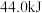 的能量,则以气态
的能量,则以气态 和气态
和气态 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是________________ .
(2)在一温度恒定的密闭容器中通入一定量的 和
和 ,在催化剂作用下转化为
,在催化剂作用下转化为 ,当
,当 与
与 的投料比为
的投料比为________ 时,混合气体 的体积分数最大;为了提高
的体积分数最大;为了提高 的平衡产率,不改变温度,可以采取的措施有
的平衡产率,不改变温度,可以采取的措施有________ 。(答出一条即可)
(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为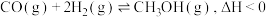 ,
, 分别为正逆反应速率常数,x为物质的量分数。
分别为正逆反应速率常数,x为物质的量分数。
①该反应在某条件下达到平衡后,升高温度,
________ (填“增大”或“减小”), 变化的程度
变化的程度________ (填“大于”“小于”或“等于”) 变化的程度。
变化的程度。
②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入 和
和 (代替合成气中的杂质,不参与反应),测得压强为
(代替合成气中的杂质,不参与反应),测得压强为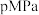 ,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:
,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:
则氢气的平衡转化率为________ ,该温度下的平衡常数 为
为________ 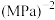 (
( 为以分压表示的平衡常数,请用含
为以分压表示的平衡常数,请用含 的式子表示)。
的式子表示)。
(4)利用二氧化碳和甲烷经催化重整,可以制得合成气: ,按一定体积比加入甲烷和
,按一定体积比加入甲烷和 ,在恒容下发生反应,温度对
,在恒容下发生反应,温度对 和
和 产率的影响如图所示。则下列叙述正确的是________.
产率的影响如图所示。则下列叙述正确的是________.

(1)已知反应Ⅰ:
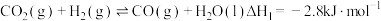
反应Ⅱ:
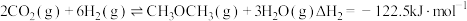
 液态水全部蒸发为气态水吸收
液态水全部蒸发为气态水吸收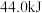 的能量,则以气态
的能量,则以气态 和气态
和气态 为原料制备气态
为原料制备气态 和水蒸气的热化学方程式是
和水蒸气的热化学方程式是(2)在一温度恒定的密闭容器中通入一定量的
 和
和 ,在催化剂作用下转化为
,在催化剂作用下转化为 ,当
,当 与
与 的投料比为
的投料比为 的体积分数最大;为了提高
的体积分数最大;为了提高 的平衡产率,不改变温度,可以采取的措施有
的平衡产率,不改变温度,可以采取的措施有(3)改用不同的催化剂可以利用合成气制备甲醇,反应方程式为
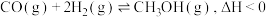 ,
, 分别为正逆反应速率常数,x为物质的量分数。
分别为正逆反应速率常数,x为物质的量分数。①该反应在某条件下达到平衡后,升高温度,

 变化的程度
变化的程度 变化的程度。
变化的程度。②在实验室模拟工业合成甲醇的反应,在一恒压密闭容器内充入
 和
和 (代替合成气中的杂质,不参与反应),测得压强为
(代替合成气中的杂质,不参与反应),测得压强为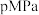 ,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:
,加入合适催化剂后在恒温条件下开始反应,测得容器的体积变化如下:反应时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
容器体积/L | 4 | 3.5 | 3.2 | 3.0 | 2.9 | 2.8 | 2.8 |
 为
为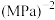 (
( 为以分压表示的平衡常数,请用含
为以分压表示的平衡常数,请用含 的式子表示)。
的式子表示)。(4)利用二氧化碳和甲烷经催化重整,可以制得合成气:
 ,按一定体积比加入甲烷和
,按一定体积比加入甲烷和 ,在恒容下发生反应,温度对
,在恒容下发生反应,温度对 和
和 产率的影响如图所示。则下列叙述正确的是________.
产率的影响如图所示。则下列叙述正确的是________.
A.该反应 |
| B.催化剂的使用可以降低反应的活化能,从而使平衡产率提高 |
| C.在恒压条件下进行该反应,产率将更高 |
D.此反应的优选温度为 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】X,Y,Z,W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y﹑W均相邻,Y﹑Z和W三种元素的原子最外层电子数之和为17,且Z﹑W最外层电子数相同则:
(1)用电子式表示X与Y所组成的简单化合物的形成过程__ ,W在周期表中的位置是__ 。
(2)已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为__ 。
(3)在体积为1L的密闭容器中反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g),充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
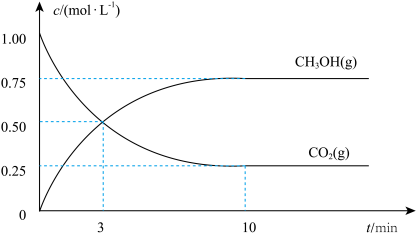
从反应开始到平衡,用H2浓度变化量表示的平均反应v(H2)=___ mol•L-1•min-1。
(4)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s) NH3(g)+HI(g)
NH3(g)+HI(g)
b.2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
则反应a达到平衡后,扩大容器体积,反应b的移动方向__ (填正向、逆向或不移动)
(5)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2 N2O4∆H<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4∆H<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__ 。

A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d点:v(正)>v(逆)
(6)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a的电极反应式为___ 。
②为使电池持续放电,该离子交换膜需选用___ 交换膜。
③当有2.24LNO2(标准状况下)被处理时,通过交换膜移动的离子为__ mol。
(1)用电子式表示X与Y所组成的简单化合物的形成过程
(2)已知,在101kPa时,X单质在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,则表示X单质燃烧热的热化学方程式为
(3)在体积为1L的密闭容器中反应的化学方程式为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)的浓度随时间的变化如图所示。
从反应开始到平衡,用H2浓度变化量表示的平均反应v(H2)=
(4)一定条件下在密闭容器中加入NH4I发生反应:
a.NH4I(s)
 NH3(g)+HI(g)
NH3(g)+HI(g)b.2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)则反应a达到平衡后,扩大容器体积,反应b的移动方向
(5)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2
 N2O4∆H<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4∆H<0,将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
A.b点的操作是压缩注射器
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d点:v(正)>v(逆)
(6)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a的电极反应式为
②为使电池持续放电,该离子交换膜需选用
③当有2.24LNO2(标准状况下)被处理时,通过交换膜移动的离子为
您最近一年使用:0次
【推荐3】氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制备方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为___ 。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1 mol H2放出10.3 kJ热量。其热化学方程式为_________ 。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。

①下列说法正确的是___ (填标号)。
a. 温度:T1>T2
b. 当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c. A点的反应速率小于C点的反应速率
d. 温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有___ (写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的______ 。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______ (填“左”或“右”)池移动;铜电极上发生反应的电极反应式为_______ 。

(1)传统的氮化镓制备方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1 mol H2放出10.3 kJ热量。其热化学方程式为
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。

①下列说法正确的是
a. 温度:T1>T2
b. 当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c. A点的反应速率小于C点的反应速率
d. 温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如图:

(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有___ (写一条。)
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式___ 。
(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___ (填离子符号)。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是___ 。

(5)写出“氧化”过程中MnO2与SO2反应的化学方程式___ 。
(6)滤渣Ⅱ是___ (填化学式)。
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___ 。

(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有
(2)浸锰过程中Fe2O3与SO2反应的化学方程式为:Fe2O3+SO2+2H+=2Fe2++SO
 +H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式
+H2O,该反应是经历以下两步反应实现的:ⅰ:Fe2O3+6H+=2Fe3++3H2O;ⅱ:……。写出ⅱ的离子方程式(3)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是

(5)写出“氧化”过程中MnO2与SO2反应的化学方程式
(6)滤渣Ⅱ是
(7)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】以硅藻土为载体的五氧化二钒( )是接触法生产硫酸的催化剂。从废矾催化剂中回收
)是接触法生产硫酸的催化剂。从废矾催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为______ ,同时 转化成
转化成 。
。
(2)“废渣1”的主要成分是______ 。
(3)“氧化”中欲使3mol的 变为
变为 ,则需要氧化剂
,则需要氧化剂 至少为
至少为______ mol。
(4)“中和”作用之一是使钒以 形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有
形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有______ 。
(5)“离子交换”和“洗脱”可简单表示为 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈______ 性(填“酸”、“碱”或“中”)。
(6)“流出液”中阳离子最多的是______ 。
(7)“沉钒”得到偏钒酸铵( )沉淀,写出“煅烧”中发生反应的化学方程式
)沉淀,写出“煅烧”中发生反应的化学方程式______ 。
 )是接触法生产硫酸的催化剂。从废矾催化剂中回收
)是接触法生产硫酸的催化剂。从废矾催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为| 物质 |  |  |  |  |  |  |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(1)“酸浸”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为 转化成
转化成 。
。(2)“废渣1”的主要成分是
(3)“氧化”中欲使3mol的
 变为
变为 ,则需要氧化剂
,则需要氧化剂 至少为
至少为(4)“中和”作用之一是使钒以
 形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有
形式存在于溶液中,将Al和Fe元素转化为难溶物。“废渣2”中含有(5)“离子交换”和“洗脱”可简单表示为
 (ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(6)“流出液”中阳离子最多的是
(7)“沉钒”得到偏钒酸铵(
 )沉淀,写出“煅烧”中发生反应的化学方程式
)沉淀,写出“煅烧”中发生反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
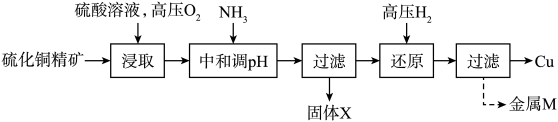
(1)“浸取”操作中通入高压 的目的:
的目的:_______ 。
(2)“浸取”过程有黄色沉淀生成,CuS在“浸取”中发生反应的化学方程式为:_______ 。
(3)“中和调pH”的pH范围:_______ 。
(4)固体X的成分:_______ 。
(5)“还原”步骤中发生的离子方程式:_______ 。
(6)“过滤”操作后经若干步骤可得到金属M,M为_______ (填化学式)。

 |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 |
(1)“浸取”操作中通入高压
 的目的:
的目的:(2)“浸取”过程有黄色沉淀生成,CuS在“浸取”中发生反应的化学方程式为:
(3)“中和调pH”的pH范围:
(4)固体X的成分:
(5)“还原”步骤中发生的离子方程式:
(6)“过滤”操作后经若干步骤可得到金属M,M为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:

(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________ (任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________ 。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________ ;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________ 。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________ 。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________ 。

(1)“浸取”时,为了提高浸取速率可采取的措施有
(2)“保温除铁”过程中,加入CuO的目的是
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】科学家研制的新型铝合金(掺杂镁、锌和铜)将航天器屏蔽辐射能力提高百倍。某小组以铝质废料(主要成分是Al、 ,含少量
,含少量 、MgO、
、MgO、 等)为原料制备高纯度铝的流程如图所示:
等)为原料制备高纯度铝的流程如图所示:
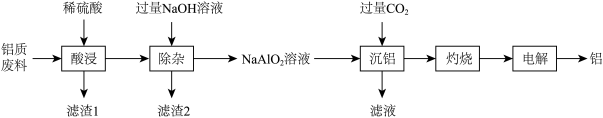
回答下列问题:
(1)滤渣2的主要成分是_______ (填化学式)。
(2)“酸浸”时,粉碎铝质废料的目的是_______ 。
(3)其他条件相同,“酸浸”中金属浸出率与硫酸浓度的关系如图所示。
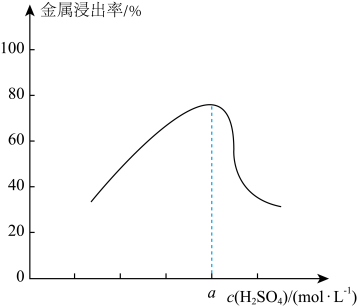
 时,金属浸出率急剧降低的可能原因是
时,金属浸出率急剧降低的可能原因是_______ 。
(4)已知常温下, 的
的 ,
, 的
的 。若酸浸液中
。若酸浸液中 mol·L
mol·L ,当
,当 开始沉淀时,
开始沉淀时,
_______ mol·L 。
。
(5)写出“沉铝”的离子方程式:_______ 。
(6)“电解”中以石墨为阳极、铝为阴极,写出阴极反应式:_______ 。电解过程中,需要定期在阳极更换石墨的原因是_______ 。
 ,含少量
,含少量 、MgO、
、MgO、 等)为原料制备高纯度铝的流程如图所示:
等)为原料制备高纯度铝的流程如图所示:
回答下列问题:
(1)滤渣2的主要成分是
(2)“酸浸”时,粉碎铝质废料的目的是
(3)其他条件相同,“酸浸”中金属浸出率与硫酸浓度的关系如图所示。

 时,金属浸出率急剧降低的可能原因是
时,金属浸出率急剧降低的可能原因是(4)已知常温下,
 的
的 ,
, 的
的 。若酸浸液中
。若酸浸液中 mol·L
mol·L ,当
,当 开始沉淀时,
开始沉淀时,
 。
。(5)写出“沉铝”的离子方程式:
(6)“电解”中以石墨为阳极、铝为阴极,写出阴极反应式:
您最近一年使用:0次
【推荐3】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有__ (任写一点),酸溶时废渣中主要成分发生反应的离子方程式为__________ 。
(2)加入30%H2O2的目的是____________ 。
(3)室温下,除去MgSO4溶液中的Al3+(使Al3+浓度小于1×10-6 mol·L-1)而不引入其他杂质,应加入的试剂X为_____ ,应调节pH的范围为_______ 。(已知:①Ksp[Al(OH)3]=1.0×10-33;②pH=8.5时,Mg(OH)2开始沉淀)
(4)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象_______ 。

(1)为了加快废渣的酸溶速率,可采取的办法有
(2)加入30%H2O2的目的是
(3)室温下,除去MgSO4溶液中的Al3+(使Al3+浓度小于1×10-6 mol·L-1)而不引入其他杂质,应加入的试剂X为
(4)向滤液中加入Na2CO3溶液生成MgCO3沉淀并用蒸馏水洗涤,确认沉淀洗净的操作及现象
您最近一年使用:0次