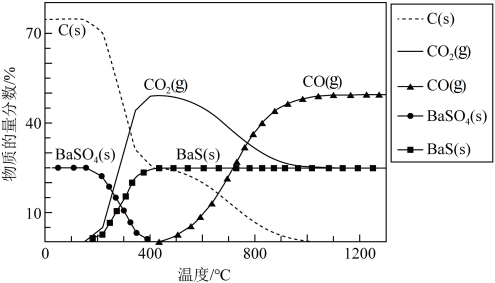
工业上利用碳热还原 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原 过程中可能发生下列反应。
过程中可能发生下列反应。
i.

ii.
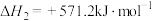
iii.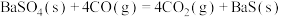
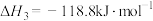
下列关于碳热还原 过程的说法中正确的是
过程的说法中正确的是
 制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
制得BaS,进而生产各种含钡化合物。温度对反应后组分的影响如图。
已知:碳热还原
 过程中可能发生下列反应。
过程中可能发生下列反应。i.


ii.

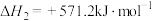
iii.
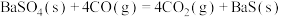
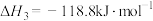
下列关于碳热还原
 过程的说法中正确的是
过程的说法中正确的是| A.要想得到更多的BaS,温度应该越高越好 |
B.对于反应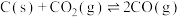 ,温度升高,CO的物质的量分数减小 ,温度升高,CO的物质的量分数减小 |
C.400℃后,C、 的量减少是由 的量减少是由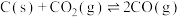 的移动导致的 的移动导致的 |
D.根据原子守恒规律可知生成的 和CO的物质的量之和始终等于投入C的物质的量 和CO的物质的量之和始终等于投入C的物质的量 |
22-23高三下·广东·开学考试 查看更多[2]
广东省新高考普通高中学科综合素养评价2022-2023学年高三下学期开学调研考试化学试题(已下线)素养卷04 化学反应速率与平衡图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
更新时间:2023-02-10 14:15:01
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】 催化氧化
催化氧化 制取
制取 的新路径,其反应为:
的新路径,其反应为:
反应Ⅰ: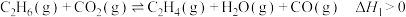
反应Ⅱ:
一定条件下,向容积为 的容器中通入
的容器中通入 和
和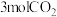 ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强变化的关系如图所示,
的选择性随温度、压强变化的关系如图所示, 、
、 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知: 的选择性
的选择性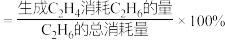
 催化氧化
催化氧化 制取
制取 的新路径,其反应为:
的新路径,其反应为:反应Ⅰ:
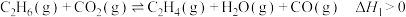
反应Ⅱ:

一定条件下,向容积为
 的容器中通入
的容器中通入 和
和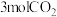 ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强变化的关系如图所示,
的选择性随温度、压强变化的关系如图所示, 、
、 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。已知:
 的选择性
的选择性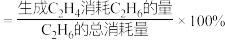

A.压强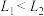 |
B.一定温度下,增大 会降低 会降低 的平衡转化率 的平衡转化率 |
C.压强为 、温度为T时,反应达平衡时,混合气体中 、温度为T时,反应达平衡时,混合气体中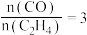 |
D.反应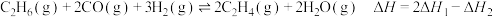 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】在 、
、 下,将
下,将 通入
通入 的
的 溶液中充分反应,测得反应放出
溶液中充分反应,测得反应放出 的热量。已知在该条件下,
的热量。已知在该条件下, 通入
通入 的
的 溶液中充分反应放出
溶液中充分反应放出 的热量。则
的热量。则 与
与 溶液反应生成
溶液反应生成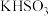 的热化学方程式正确的是
的热化学方程式正确的是
 、
、 下,将
下,将 通入
通入 的
的 溶液中充分反应,测得反应放出
溶液中充分反应,测得反应放出 的热量。已知在该条件下,
的热量。已知在该条件下, 通入
通入 的
的 溶液中充分反应放出
溶液中充分反应放出 的热量。则
的热量。则 与
与 溶液反应生成
溶液反应生成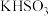 的热化学方程式正确的是
的热化学方程式正确的是A. , , |
B. , , |
C. , , |
D. , , |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】利用管状透氧膜反应器实现乙醇-水重整制氢,具有无需额外热源、氧气可协助消除积碳等优点。其主要反应为:
反应Ⅰ: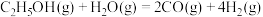
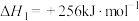
反应Ⅱ:
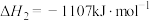
反应Ⅲ:
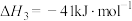
反应Ⅳ:

一定温度下,将一定比例的 、
、 、Ar气体通过装有催化剂的管状透氧膜反应器。经计算机仿真模拟,控制
、Ar气体通过装有催化剂的管状透氧膜反应器。经计算机仿真模拟,控制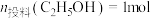 ,平衡时氢醇比
,平衡时氢醇比 随水醇比
随水醇比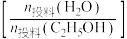 、膜管长度的变化如题13图所示。若仅考虑上述反应,下列说法正确的是
、膜管长度的变化如题13图所示。若仅考虑上述反应,下列说法正确的是
反应Ⅰ:
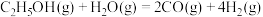
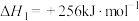
反应Ⅱ:

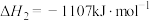
反应Ⅲ:

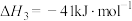
反应Ⅳ:


一定温度下,将一定比例的
 、
、 、Ar气体通过装有催化剂的管状透氧膜反应器。经计算机仿真模拟,控制
、Ar气体通过装有催化剂的管状透氧膜反应器。经计算机仿真模拟,控制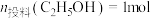 ,平衡时氢醇比
,平衡时氢醇比 随水醇比
随水醇比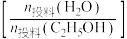 、膜管长度的变化如题13图所示。若仅考虑上述反应,下列说法正确的是
、膜管长度的变化如题13图所示。若仅考虑上述反应,下列说法正确的是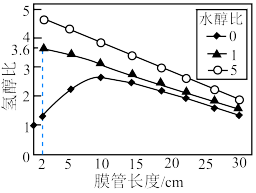
A.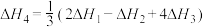 |
B.水醇比为0时,管长度超过10cm后氢醇比下降的原因可能为 氧化 氧化 |
C.水醇比为1、管长度为2cm,若 、 、 转化率为100%且 转化率为100%且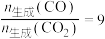 ,则管状透氧膜透过氧气0.1mol ,则管状透氧膜透过氧气0.1mol |
| D.实际生产中,水醇比越大、管长度越短,氢气产率越高 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】下列实验操作和实验现象得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向 溶液中加入 溶液中加入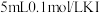 溶液,充分反应后,用四氯化碳萃取数次后取上层溶液,滴加几滴 溶液,充分反应后,用四氯化碳萃取数次后取上层溶液,滴加几滴 溶液 溶液 | 溶液变红 |  与 与 之间的反应是可逆反应 之间的反应是可逆反应 |
| B | 用蒸馏水溶解 固体,并继续加水稀释 固体,并继续加水稀释 | 溶液由绿色逐渐变为蓝色 |  正向移动 正向移动 |
| C | 向苯酚稀溶液中逐滴加入饱和溴水 | 有白色沉淀产生 | 苯环对羟基性质产生影响 |
| D | 向氯化铜溶液中逐滴加入氨水 | 产生沉淀继而溶解 | 氢氧化铜有两性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法正确的是
A. 其他条件不变,增大反应容器体积,正逆反应速率不变 其他条件不变,增大反应容器体积,正逆反应速率不变 |
B. ,碳的质量不再改变说明反应已达平衡 ,碳的质量不再改变说明反应已达平衡 |
C.若平均相对分子质量不再随时间变化能说明反应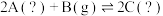 已达平衡,则A、C不能同时是气体 已达平衡,则A、C不能同时是气体 |
D.4mol 分解为 分解为 和 和 的转化率为10%时,吸收热量 的转化率为10%时,吸收热量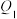 ;在相同温度和压强下,当2mol ;在相同温度和压强下,当2mol 和6mol 和6mol 反应达到平衡时 反应达到平衡时 转化率为10%,放出热量 转化率为10%,放出热量 , , 不等于 不等于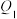 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
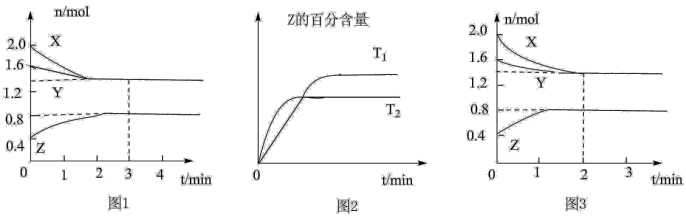

| A.容器中发生的反应可表示为3X(g)+Y(g) ==2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1 |
| C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
| D.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
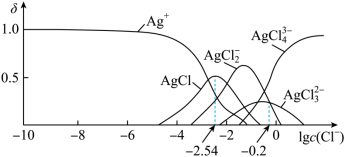
【推荐2】湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的分布系数δ[如δ(AgCl )=
)=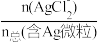 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
 )=
)=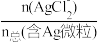 ]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
]随lgc(Cl-)的变化曲线如图所示。已知:lg[Ksp(AgCl)]=-9.75。下列叙述错误的是
| A.AgCl溶解度随c(Cl-)增大而不断减小 |
| B.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol•L-1 |
C.当c(Cl-)=10-2mol•L-1时,溶液中c(AgCl )>c(Ag+)>c(AgCl )>c(Ag+)>c(AgCl ) ) |
D.25℃时,AgCl +Cl- +Cl- AgCl AgCl 的平衡常数K=100.2 的平衡常数K=100.2 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】在某容积一定的密闭容器中,有下列可逆反应xA(g)+B(g)⇌2C(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中一定正确的是( )
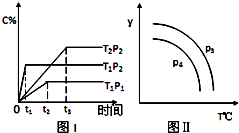

| A.该反应是吸热反应 |
| B.x=2 |
| C.P3<P4,y轴可表示混合气体的相对分子质量 |
| D.P3>P4,y轴可表示C物质在平衡体积中的百分含量 |
您最近一年使用:0次

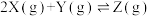 ,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法不正确的是
,测得实验①、②、③反应过程中体系压强随时间的变化曲线如图所示。下列说法不正确的是