下列性质中,可以证明HA是弱酸的是
①体积相同、浓度相同的HA溶液与NaOH溶液恰好完全反应
②NaA溶液显碱性
③在相同条件下,物质的量浓度相同的HA溶液的导电性比盐酸弱
④1 mol·L-1的HA溶液的pH=1
⑤HA溶液中HA、A-、H+同时存在
⑥pH相同、体积相同的HA溶液和HCl溶液与Fe反应时,开始放出H2的速率一样
①体积相同、浓度相同的HA溶液与NaOH溶液恰好完全反应
②NaA溶液显碱性
③在相同条件下,物质的量浓度相同的HA溶液的导电性比盐酸弱
④1 mol·L-1的HA溶液的pH=1
⑤HA溶液中HA、A-、H+同时存在
⑥pH相同、体积相同的HA溶液和HCl溶液与Fe反应时,开始放出H2的速率一样
| A.①②③⑥ | B.②③④⑤ | C.①④⑤⑥ | D.③⑤⑥ |
更新时间:2023-03-06 20:42:15
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是( )
| A.用NH3·H2O溶液做导电性实验,灯泡很暗,说明NH3·H2O是弱电解质 |
| B.等体积的pH都为2的酸HA和HB分别与足量的铁粉反应,HA放出的H2多,说明HA酸性强 |
| C.c=0.1 mol·L-1的CH3COOH溶液和c=0.1 mol·L-1的HCl溶液中,前者的pH大 |
| D.常温下,pH=5的CH3COOH溶液和pH=4的HCl溶液中,c(CH3COO-)/c(Cl-)=1/10 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某学习小组用足量大小相同的去膜镁条与体积均为40mL、浓度均为0.1mol·L-1的醋酸(A瓶)和盐酸(B瓶)分别反应,相同条件下(该条件下Vm=22.5L·mol-1)测得反应产生的气体体积与反应时间的关系如下表所示:
下列说法不正确的是
气体读数/mL 时间/s 物质 | 5 | 10 | 15 | 20 | …… | 45 |
| 醋酸(A瓶) | 88 | 170 | 248 | 326 | …… | 865 |
| 盐酸(B瓶) | 10 | 18 | 30 | 64 | …… | 464 |
下列说法不正确的是
| A.产生气体体积为0~5mL时,A瓶与B瓶反应速率不同的原因是c(H+)不同 |
| B.产生气体体积为5~10mL时,B瓶产生气体的平均速率为0.625mL·s-1 |
| C.产生气体体积为0~15mL时,A瓶反应速率增大是醋酸继续电离使c(H+)升高所致 |
| D.产生气体体积为0~45mL时,镁与盐酸反应的速率始终大于镁与醋酸反应的速率 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列说法不正确的是
| A.0.1mol·L−1NaOH溶液从常温升温到60℃,其pH变小 |
| B.等浓度的氨水、NaOH溶液加入稀盐酸至中性,则c(NH4+)=c(Na+) |
| C.等浓度的氨水、NaOH溶液稀释相同的倍数,pH后者大 |
| D.等体积、等pH的氨水、NaOH溶液加入足量的AlCl3溶液,产生沉淀的质量前者大 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.溶液的pH |
| C.电离常数Ka | D.CH3COOH的物质的量 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A.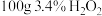 溶液中含氧原子数为 溶液中含氧原子数为 |
B.10.4g苯乙烯(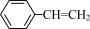 )分子中含碳碳双键数为 )分子中含碳碳双键数为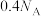 |
C. 氨水中 氨水中 数为 数为 |
D.2.24L(标准状况) 与足量NaOH溶液反应转移的电子数为 与足量NaOH溶液反应转移的电子数为 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列实验方案不能达到探究目的是
| 选项 | 探究方案 | 探究目的 |
| A | 将两支盛有等体积、等浓度的Na2S2O3溶液的试管分别置于冷水、热水中,再同时加入等体积、等浓度的稀硫酸,观察现象 | 温度对化学反应速率的影响 |
| B | 将溴乙烷与氢氧化钠的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,观察溶液是否褪色 | 溴乙烷在氢氧化钠的乙醇溶液中是否发生消去反应 |
| C | 室温下,用pH计测量同浓度的NaClO溶液和CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 向菠菜提取液中加入少量稀硝酸,再滴加几滴KSCN溶液,振荡,观察现象 | 检查菠菜中是否含有铁元素 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】苯甲酸(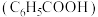 )及其钠盐是常用的食品防腐剂。25℃,苯甲酸的
)及其钠盐是常用的食品防腐剂。25℃,苯甲酸的 ,下列叙述正确的是
,下列叙述正确的是
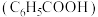 )及其钠盐是常用的食品防腐剂。25℃,苯甲酸的
)及其钠盐是常用的食品防腐剂。25℃,苯甲酸的 ,下列叙述正确的是
,下列叙述正确的是A. 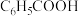 溶液稀释100倍,pH增加2 溶液稀释100倍,pH增加2 |
B.  溶液的 溶液的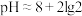 |
C.苯甲酸钠溶液中: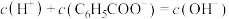 |
| D.用NaOH标准溶液滴定苯甲酸溶液,可用甲基橙作指示剂 |
您最近半年使用:0次

 的电离常数分别
的电离常数分别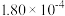 和
和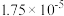 。将
。将 ,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随
,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是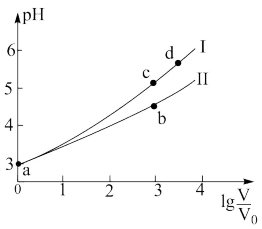
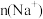 相同
相同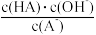 不变(HA,A-分别代表相应的酸和酸根离子)
不变(HA,A-分别代表相应的酸和酸根离子)



