以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:

回答下列问题:
(1)提高“浸取”速率可以采取的措施为_____ (请至少写出两条)。
(2)Mn2+的核外电子排布式为_____ ;“浸取”时MnO2转化为Mn2+,反应的离子方程式为_____ 。
(3)“除Fe、Al、Si”时,需将Fe2+氧化为Fe3+,最适宜的氧化剂为_____ (填标号)。
A.Cl2 B.HNO3 C.H2O2
(4)“除Ca、Mg”时,所得溶液中 =
=_____ 。[Ksp(MgF2)=6.5×10-11,Ksp(CaF2)=5.2×10-9]。
(5)“沉锰”时,“锰”转化为MnCO3,则反应的离子方程式为_____ ;此过程需控制温度低于70℃,该过程不宜在较高温度下进行的原因是_____ 。

回答下列问题:
(1)提高“浸取”速率可以采取的措施为
(2)Mn2+的核外电子排布式为
(3)“除Fe、Al、Si”时,需将Fe2+氧化为Fe3+,最适宜的氧化剂为
A.Cl2 B.HNO3 C.H2O2
(4)“除Ca、Mg”时,所得溶液中
 =
=(5)“沉锰”时,“锰”转化为MnCO3,则反应的离子方程式为
22-23高二上·黑龙江大庆·期末 查看更多[2]
更新时间:2023-03-24 16:40:13
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)

(1)写出下列物质的化学式B______ , F_______ , H______ 。A和G的最简单气态氢化物中,较稳定的物质是_______ (填化学式),写出反应①的化学方程式________________________ 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

①__________ ②_____________ ③_______________
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为___________________________________________ 。
(4)写出G→J的化学方程式________________________________________ ,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G=1:1 B.反应②:A:D=1:1
C.反应③:A:J=2:1 D.反应④:E:B =1:1

(1)写出下列物质的化学式B
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

①
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为
(4)写出G→J的化学方程式
A.反应①:F:G=1:1 B.反应②:A:D=1:1
C.反应③:A:J=2:1 D.反应④:E:B =1:1
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的Fe2+含量,请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式_________ (K2Cr2O7被还原为Cr3+)。
(2)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取K2Cr2O7________ g(保留四位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器一定不会用到的有________ 。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(3)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果________ (填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将____________________________ 。
(4)用0.010 00 mol·L-1的K2Cr2O7溶液滴定20.00 mL未知浓度的含Fe2+的溶液。恰好完全反应时消耗10.00 mL K2Cr2O7溶液,则溶液中Fe2+的物质的量浓度是多少?_________________ 。
(2)若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取K2Cr2O7
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(3)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果
(4)用0.010 00 mol·L-1的K2Cr2O7溶液滴定20.00 mL未知浓度的含Fe2+的溶液。恰好完全反应时消耗10.00 mL K2Cr2O7溶液,则溶液中Fe2+的物质的量浓度是多少?
您最近一年使用:0次
【推荐3】氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:

已知:①BiOCl难溶于水;
②“浸铋”所得浸取液中含BiCl3、AsCl3等物质。
回答下列问题:
(1)“浸铜”时有单质硫生成,发生反应的离子方程式为_______ 。
(2)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为_______ 。“沉铋”所得滤液可导入到_______ 中使用(填流程中操作单元名称)。
(3)工业生产中还可采用铁盐氧化法除砷。向“浸铋”所得浸取液中加入 ,和H2O2,并调节pH,生成FeAsO4沉淀,发生反应的离子方程式是
,和H2O2,并调节pH,生成FeAsO4沉淀,发生反应的离子方程式是_______ 。欲使溶液中 且不产生
且不产生 ,沉淀,应控制pH的范围为
,沉淀,应控制pH的范围为_______ 。(已知: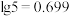 ;
; 、
、 的Ksp分别
的Ksp分别 ,
, ,计算结果保留2位小数)
,计算结果保留2位小数)
(4)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入K+,BiOCl被还原为Bi,电极反应式是_______ 。研究发现,充电过程中,除上述反应外,还包括 ,该反应的发生使得电池的储能
,该反应的发生使得电池的储能_______ (填“增大”“减小”或“不变”)。

已知:①BiOCl难溶于水;
②“浸铋”所得浸取液中含BiCl3、AsCl3等物质。
回答下列问题:
(1)“浸铜”时有单质硫生成,发生反应的离子方程式为
(2)“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为
(3)工业生产中还可采用铁盐氧化法除砷。向“浸铋”所得浸取液中加入
 ,和H2O2,并调节pH,生成FeAsO4沉淀,发生反应的离子方程式是
,和H2O2,并调节pH,生成FeAsO4沉淀,发生反应的离子方程式是 且不产生
且不产生 ,沉淀,应控制pH的范围为
,沉淀,应控制pH的范围为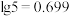 ;
; 、
、 的Ksp分别
的Ksp分别 ,
, ,计算结果保留2位小数)
,计算结果保留2位小数)(4)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入K+,BiOCl被还原为Bi,电极反应式是
 ,该反应的发生使得电池的储能
,该反应的发生使得电池的储能
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】Fe3O4/TiO2磁性复合材料具有优异的光催化性能,可由钛铁矿(主要成分为FeTiO3,可表示为FeO·TiO2,杂质为SiO2)制备,一种工艺流程如下:

回答下列问题:
(1)“酸浸”工序中,将矿石粉碎的目的是___________ 。
(2)“酸浸”后钛元素主要以TiO2+形式存在,FeTiO3发生的化学反应方程式为___________ 。
(3)滤渣A的主要成分为___________ 。
(4)加入氨水、双氧水的作用分别是___________ 、___________ ,获得FeCl2·4H2O需在HCl氛围中结晶,原因是___________ 。
(5)滤液C加热水后得到难溶于水和稀酸的偏钛酸(用H2TiO3表示),恢复温度至25℃,滤液中pH=2,则此时滤液中c(TiO2+)为___________ mol/L。(已知:Ksp[TiO(OH)2]=1.0×10–27)

回答下列问题:
(1)“酸浸”工序中,将矿石粉碎的目的是
(2)“酸浸”后钛元素主要以TiO2+形式存在,FeTiO3发生的化学反应方程式为
(3)滤渣A的主要成分为
(4)加入氨水、双氧水的作用分别是
(5)滤液C加热水后得到难溶于水和稀酸的偏钛酸(用H2TiO3表示),恢复温度至25℃,滤液中pH=2,则此时滤液中c(TiO2+)为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除加热外,还可采取的措施有_______ (任写一种)。
(2)滤渣I中的主要成分是S、SiO2,请写出“浸取”反应中Cu2S生成S的化学方程式:_______
(3)常温下“除铁”时加入的试剂A可用_______ 起到调节pH的作用,调节pH调的范围为_______ ,若加A后溶液的pH调为5.0,则溶液中Fe3+的浓度为_______ mol/L。
(4).写出“沉锰”(除Mn2+)过程中反应的离子方程式:_______
(5)“赶氨”时,最适宜的操作方法是_______

已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除加热外,还可采取的措施有
(2)滤渣I中的主要成分是S、SiO2,请写出“浸取”反应中Cu2S生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用
(4).写出“沉锰”(除Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)为提高溶矿速率,可采取的措施___________ (举1例)。
(2)加入少量MnO2的作用是___________ 。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=___________ mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是___________ 。
(4)在电解槽中,发生电解反应的离子方程式为___________ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是___________ 。

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)为提高溶矿速率,可采取的措施
(2)加入少量MnO2的作用是
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=
(4)在电解槽中,发生电解反应的离子方程式为
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】短周期元素A、B、C、D,A元素的原子最外层电子数是内层电子数的两倍,B为地壳中含量最多的元素,C是原子半径最大的短周期主族元素,C与D形成的离子化合物CD是常用的调味品。填写下列空白:
(1)A的基态原子的电子排布式为_________________ ;
(2)C元素在周期表中的位置是____________________
(3)B、C组成的一种化合物与水发生反应生成气体,其化学方程式为:_________ 。
(4)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。
X电极的电极反应式为___________ ,电解池总反应的离子方程式为:_________ 。
(1)A的基态原子的电子排布式为
(2)C元素在周期表中的位置是
(3)B、C组成的一种化合物与水发生反应生成气体,其化学方程式为:
(4)如图所示,电解质a溶液为含有CD的饱和溶液。X为石墨电极,Y为铁电极,接通直流电源。

X电极的电极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】现有A、B、C、D、E五种元素,它们的核电荷数依次增多。
①A的核电荷数大于2,可形成氢化物 ,该氢化物在常温下是液体;
,该氢化物在常温下是液体;
②A和B两元素可形成化合物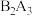 ,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
③ 比
比 多8个电子;
多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为 。
。
试回答下列问题:
(1)A是_____ (写元素符号,下同), 分子的空间结构为
分子的空间结构为_____________ 。
(2)B的离子结构示意图为_______ ,C元素最高价氧化物对应的水化物的电子式为_________ ,D的原子的电子排布式为___________ 。
(3)用电子式表示 的形成过程:
的形成过程:______________ 。
(4)写出CD的溶液中通入氯气的离子方程式:_____________ 。
(5)比较B、C、E三种元素形成的简单离子半径由小到大的顺序(B、C、E离子用实际离子符号表示):_____________ 。
①A的核电荷数大于2,可形成氢化物
 ,该氢化物在常温下是液体;
,该氢化物在常温下是液体;②A和B两元素可形成化合物
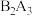 ,该化合物既能溶于强酸溶液,又能溶于强碱溶液;
,该化合物既能溶于强酸溶液,又能溶于强碱溶液;③
 比
比 多8个电子;
多8个电子;④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥在周期表中E处于C的下两个周期,E单质可与冷水反应生成氢气,反应时E的单质与生成的氢气的物质的量之比为
 。
。试回答下列问题:
(1)A是
 分子的空间结构为
分子的空间结构为(2)B的离子结构示意图为
(3)用电子式表示
 的形成过程:
的形成过程:(4)写出CD的溶液中通入氯气的离子方程式:
(5)比较B、C、E三种元素形成的简单离子半径由小到大的顺序(B、C、E离子用实际离子符号表示):
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某厂利用富锗ZnO烟尘(还含有CuO、CaO、PbO2、FeO、MnO2等)生产锗精矿和碱式碳酸锌[Zn2(OH)2CO3]。其流程如图:

已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式______ 。
(2)浸渣①主要含有______ ;酸浸中PbO2与98%H2SO4反应的化学方程式为______ 。
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换______ (填离子符号);常温下,“Ⅱ”控制pH最高为______ (溶液中金属离子浓度均按0.12mol•L-1计算)。
(4)沉锌的离子方程式为______ 。
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“ ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置______ ;设晶胞中S离子与其最近的Zn离子的距离为dnm,其密度为ρg•cm-3,阿伏加德罗常数NA为______ (用含d、ρ的式子表示)。


已知:Ⅰ.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
Ⅱ.25℃:Ksp[Fe(OH)3]=4×10-38、Ksp[Zn(OH)2]=1.2×10-17。
请回答下列问题:
(1)基态Zn2+的价层电子排布式
(2)浸渣①主要含有
(3)流程中,“Ⅰ”加入Zn粉主要是为了置换
(4)沉锌的离子方程式为
(5)若ZnS晶胞沿体对角线方向投影,所得的原子投影外围图形为正六边形,如图乙所示,请用“
 ”在图乙中标出晶胞中4个Zn原子的投影位置
”在图乙中标出晶胞中4个Zn原子的投影位置
您最近一年使用:0次



