Ⅰ.有人设计了如图所示实验,以确认某混合气体中含有 CH2=CH2和SO2。
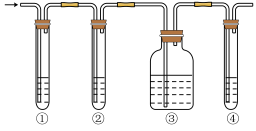
实验中提供的试剂有:A.品红溶液B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
试回答下列问题:
(1)写出图中①②③④ 装置盛放试剂的顺序为( 将上述有关试剂的序号填入空格内)______ 。
(2)能确定混合气体中存在乙烯的现象是__________________ 。
(3)乙烯与溴水反应的化学方程式为__________ ,该反应的反应类型为________ 。
Ⅱ.一定条件下铁可以和 CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2气体,反应过程中 CO2气体和 CO 气体的浓度与时间的关系如图所示:
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2气体,反应过程中 CO2气体和 CO 气体的浓度与时间的关系如图所示:

(4)t1时,正、逆反应速率的大小关系为 v 正_____ v 逆(填“>”“<”或“=”)。
(5)4 min 内,CO 的平均反应速率 v(CO)=_______________ 。
(6)下列条件的改变能减慢其反应速率的是___________ (填序号,下同)。
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(7)下列描述能说明上述反应已达平衡状态的是_____ 。
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化

实验中提供的试剂有:A.品红溶液B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液。
试回答下列问题:
(1)写出图中①②③④ 装置盛放试剂的顺序为( 将上述有关试剂的序号填入空格内)
(2)能确定混合气体中存在乙烯的现象是
(3)乙烯与溴水反应的化学方程式为
Ⅱ.一定条件下铁可以和 CO2发生反应:Fe(s)+CO2(g)
 FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2气体,反应过程中 CO2气体和 CO 气体的浓度与时间的关系如图所示:
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的 CO2气体,反应过程中 CO2气体和 CO 气体的浓度与时间的关系如图所示:
(4)t1时,正、逆反应速率的大小关系为 v 正
(5)4 min 内,CO 的平均反应速率 v(CO)=
(6)下列条件的改变能减慢其反应速率的是
①降低温度
②减少铁粉的质量
③保持压强不变,充入 He 使容器的体积增大
④保持容积不变,充入 He 使体系压强增大
(7)下列描述能说明上述反应已达平衡状态的是
①v(CO2)=v(CO)
②单位时间内生成 n mol CO2的同时生成 n mol CO
③容器中气体压强不随时间变化而变化
④容器中气体的平均相对分子质量不随时间变化而变化
更新时间:2023-04-01 22:38:21
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】汽车尾气中含有CO、NO等有害气体。
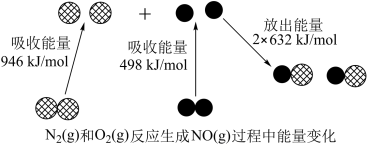
(1)汽车尾气中NO生成过程的能量变化如图示。1mol 和1mol
和1mol 完全反应生成NO会
完全反应生成NO会___________ (填“吸收”或“放出”)kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示: 可在此固体电解质中自由移动)
可在此固体电解质中自由移动)
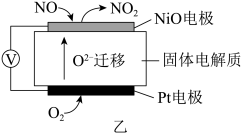
①外电路中,电子是从电极流出___________ (填“NiO”或“Pt”)。
②Pt电极上的电极反应式为___________ 。
(3)一种新型催化剂用于NO和CO的反应: 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
①请将表中数据补充完整:a___________ 。
②能验证温度对化学反应速率规律的是实验___________ (填实验序号)。
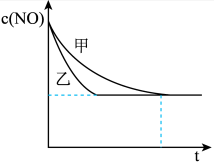
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线___________ (填“甲”或“乙”)。
(4)在容积固定的绝热容器中发生反应 ,
,不能 说明已达到平衡状态的是___________(不定项选择);
(1)汽车尾气中NO生成过程的能量变化如图示。1mol
 和1mol
和1mol 完全反应生成NO会
完全反应生成NO会
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:
 可在此固体电解质中自由移动)
可在此固体电解质中自由移动)
①外电路中,电子是从电极流出
②Pt电极上的电极反应式为
(3)一种新型催化剂用于NO和CO的反应:
 。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(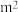 /g) /g) |
| Ⅰ | 280 | 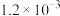 |  | 82 |
| Ⅱ | 280 | 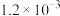 | b | 124 |
| Ⅲ | 350 | a |  | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度
 随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线
(4)在容积固定的绝热容器中发生反应
 ,
,| A.容器内混合气体温度不再变化 | B.容器内的气体压强保持不变 |
C. | D.容器内混合气体密度保持不变 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) ==2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式_________________________________________________________
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.
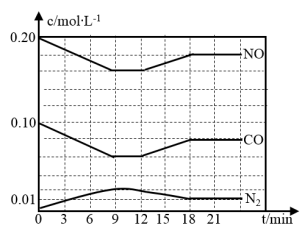
①该反应第一次达到平衡时的平衡常数为________ 。
②第12min时改变的条件是________ 。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________ 移动(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________ 。

②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________
(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) ==2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.

①该反应第一次达到平衡时的平衡常数为
②第12min时改变的条件是
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是

②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g) C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________ mol/(L·s)。
(2)反应前A的物质的量浓度是________________ mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
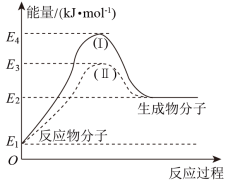
(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
 C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:(1)用生成物C表示20s内的平均反应速率为
(2)反应前A的物质的量浓度是
(3)反应达平衡时,B的转化率为
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
| 编号 | 改变的条件 | D的生成速率 |
| ① | 降低体系温度 | |
| ② | 恒容下补充A气体 | |
| ③ | 恒容下充入Ne(不参与体系反应) |
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】t℃时,将3 mol A和2 mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
(1)该过程用A表示的反应速率为:v(A)=_______ ;该温度下该反应的化学平衡常数表达式为__________ 。
(2)比较达到平衡时,A、B两反应物的转化率:α(A)______ α(B)(填“>”、“=”或“<”)。
(3)判断反应达到平衡状态的依据是(填字母序号)__________ 。
a.生成C的速率与消耗B的速率相等 b.混合气体的密度不变
c.混合气体的相对平均分子质量不变 d.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的 H
H_____ 0(填“>”、“=”或“<”)。
(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会__________ (填“加快”、“减慢”或“不变”),化学平衡将_________ (填“正反应方向移动”、“逆反应方向移动”或“不移动”)。
(6)在恒温恒容密闭容器中进行上述反应,起始投料时各物质的浓度如下表:
按投料I进行反应,测得达到化学平衡状态时A的转化率为40%,若按投料II进行反应,起始时反应进行的方向为________ (填“正向”、“逆向”或“不移动)。
 2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:
2C(g),2 min时反应达到平衡状态(温度不变),测得C的浓度为0.2 mol/L,请填写下列空白:(1)该过程用A表示的反应速率为:v(A)=
(2)比较达到平衡时,A、B两反应物的转化率:α(A)
(3)判断反应达到平衡状态的依据是(填字母序号)
a.生成C的速率与消耗B的速率相等 b.混合气体的密度不变
c.混合气体的相对平均分子质量不变 d.A的质量分数不再发生变化
(4)若升高温度,再次达平衡时,平衡常数数值变大,则该反应的
 H
H(5)若保持温度不变时,继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,则化学反应速率会
(6)在恒温恒容密闭容器中进行上述反应,起始投料时各物质的浓度如下表:
| A | B | C | |
| 投料I | 3.0 mol/L | 1.0 mol/L | 0 |
| 投料II | 2.0 mol/L | 1.0 mol/L | 2.0 mol/L |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氨的用途十分广泛,是现代工业、农业生产最基础的化工原料之一。氨可作为一种较易储运的储氢载体,是破解氢大规模储运难题的有效手段。氨也可以作为能源直接燃烧,且燃烧产物只有氮气和水,是助力“双碳”目标的新路径之一。
I.以氨为原料可生产尿素[化学式为CO(NH2)2],其原理分两步进行:
①2NH3(g)+CO2(g) NH2COONH4(l) ΔH1=-117kJ•mol-1
NH2COONH4(l) ΔH1=-117kJ•mol-1
②NH2COONH4(l) CO(NH2)2(l)+H2O(g) ΔH2=+15kJ•mol-1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ•mol-1
(1)生产尿素的决速步骤是第二步,可判断活化能较小的是_______ (填“①”或“②”)。
(2)写出合成尿素的热化学方程式_______ 。
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ•mol-1 ΔS=-200J•K-1•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1 ΔS=-200J•K-1•mol-1
(3)上述反应在常温下_______ (填“能”或“不能”)自发进行。
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是_______ 。
(5)科研小组模拟不同条件下的合成氨反应,向体积可变的密闭容器中充入6molN2和10molH2,不同温度下平衡时氨气的体积分数与总压强(p)的关系如图所示。
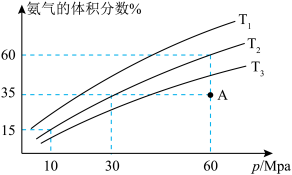
①T1、T2、T3由小到大的顺序为_______ 。
②在T2、60MPa条件下,平衡时N2的转化率为_______ %;若此时容器体积为1L,则平衡常数K=_______ (保留两位有效数字)。
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气的还原合成氨。
已知:第一步:*+H+e-=*H(快)(吸附在催化剂表面的物种用*表示)
第二步:N2+2*H=中间体(吸附在催化剂表面)(慢)
第三步:_______(快)
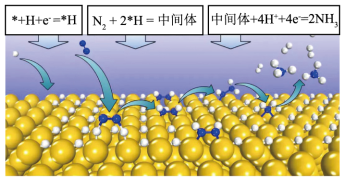
(6)第三步的方程式为_______ 。
(7)该法在合成氨的过程中能量的转化形式是_______ ;较传统工业合成氨法,该方法具有_______ 的优点。
I.以氨为原料可生产尿素[化学式为CO(NH2)2],其原理分两步进行:
①2NH3(g)+CO2(g)
 NH2COONH4(l) ΔH1=-117kJ•mol-1
NH2COONH4(l) ΔH1=-117kJ•mol-1②NH2COONH4(l)
 CO(NH2)2(l)+H2O(g) ΔH2=+15kJ•mol-1
CO(NH2)2(l)+H2O(g) ΔH2=+15kJ•mol-1(1)生产尿素的决速步骤是第二步,可判断活化能较小的是
(2)写出合成尿素的热化学方程式
Ⅱ.传统的“哈伯法”合成氨原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4kJ•mol-1 ΔS=-200J•K-1•mol-1
2NH3(g) ΔH=-92.4kJ•mol-1 ΔS=-200J•K-1•mol-1(3)上述反应在常温下
(4)一定条件下,在恒温恒容的密闭容器中充入等物质的量的N2和H2发生反应生成NH3下列状态能说明反应达到平衡的是
| A.容器内气体的平均摩尔质量不变 | B.N2的体积分数不变 |
| C.混合气体的颜色不再改变 | D.2v正(NH3)=3v逆(H2) |

①T1、T2、T3由小到大的顺序为
②在T2、60MPa条件下,平衡时N2的转化率为
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气的还原合成氨。
已知:第一步:*+H+e-=*H(快)(吸附在催化剂表面的物种用*表示)
第二步:N2+2*H=中间体(吸附在催化剂表面)(慢)
第三步:_______(快)

(6)第三步的方程式为
(7)该法在合成氨的过程中能量的转化形式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
I.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,实现循环内零碳排放。
(1)已知:反应①: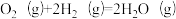
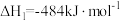
反应②: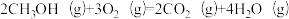
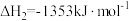
反应③: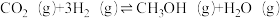 △H3。
△H3。
△H3=__________ kJ·mol-1,下列叙述中能说明反应③达到平衡状态的是________ (填字母)。
A.断裂3molC-H的同时生成1molC=O
B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化
D.v正(CO2)= v正(H2O)
(2)压强为0.1MPa时,在密闭容器中按n(CO2):n(H2)=1:3投料,通过反应③合成甲醇,还发生副反应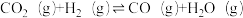
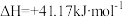 ,得CO2的平衡转化率如图所示。
,得CO2的平衡转化率如图所示。
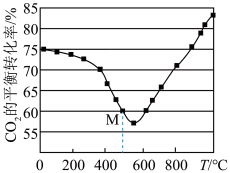
①温度高于570℃后,CO2平衡转化率随温度升高而增大的原因是_______________ 。
②图中M点CO2的平衡转化率为60%,若CH3OH的选择性为 (转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为
(转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为_______________ MPa。
Ⅱ.以甲醇和二氧化碳为原料,利用活性催化电极电解制备甲酸(甲酸盐)的原理如图。

(3)该装置中电子流动方向是_______________ :_____→_____,_____→_____。(用“A”“B”“a”“b”表示)
(4)电解过程中阴极的电极反应式为_______________ 。
(5)若有1molH+通过质子交换膜时,装置内生成HCOOˉ和HCOOH的物质的量的差为_______________ mol。
I.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,实现循环内零碳排放。
(1)已知:反应①:
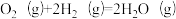
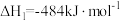
反应②:
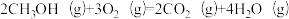
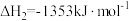
反应③:
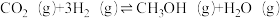 △H3。
△H3。△H3=
A.断裂3molC-H的同时生成1molC=O
B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化
D.v正(CO2)= v正(H2O)
(2)压强为0.1MPa时,在密闭容器中按n(CO2):n(H2)=1:3投料,通过反应③合成甲醇,还发生副反应
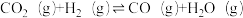
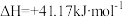 ,得CO2的平衡转化率如图所示。
,得CO2的平衡转化率如图所示。
①温度高于570℃后,CO2平衡转化率随温度升高而增大的原因是
②图中M点CO2的平衡转化率为60%,若CH3OH的选择性为
 (转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为
(转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为Ⅱ.以甲醇和二氧化碳为原料,利用活性催化电极电解制备甲酸(甲酸盐)的原理如图。

(3)该装置中电子流动方向是
(4)电解过程中阴极的电极反应式为
(5)若有1molH+通过质子交换膜时,装置内生成HCOOˉ和HCOOH的物质的量的差为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH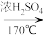 CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
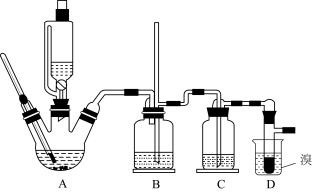
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___ (填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入___ ,其目的是吸收反应中可能生成的酸性气体(填字母)。
a.水 b.氢氧化钠溶液 c.浓硫酸
(3)判断该制备反应已经结束的最简单方法是___ 。
(4)若产物中有少量未反应的Br2,最好用___ 洗涤除去(填正确选项前的字母)。
a.水 b.乙醇 c.氢氧化钠溶液
(5)若产物中有少量副产物乙醚,可用的___ 方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是___ ;但又不能过度冷却(如用冰水),其原因是___ 。
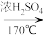 CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。
CH2=CH2↑+H2O,CH2=CH2+Br2→BrCH2CH2Br。可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。
用少量溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

| 乙醇 | 1,2—二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入
a.水 b.氢氧化钠溶液 c.浓硫酸
(3)判断该制备反应已经结束的最简单方法是
(4)若产物中有少量未反应的Br2,最好用
a.水 b.乙醇 c.氢氧化钠溶液
(5)若产物中有少量副产物乙醚,可用的
(6)反应过程中应用冷水冷却装置D,其主要目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。
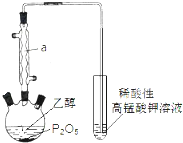
(1)仪器a的名称为_________________ 。
(2)用化学反应方程式表示上述制备乙烯的原理___________________________________ 。
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为)________________ 。
(4)该装置中还缺一种必备仪器,该仪器为_______________ 。某同学认为即使添加了该仪器上述装置验证产生了乙烯不够严密,仍须在酸性高锰酸钾溶液之前添加洗气装置,其理由为_____________________ 。

(1)仪器a的名称为
(2)用化学反应方程式表示上述制备乙烯的原理
(3)已知P2O5是一种酸性干燥剂,吸水放出大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为)
(4)该装置中还缺一种必备仪器,该仪器为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl-、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+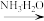 Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+ Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________ 。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________ 。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________ 。
④生成CuCl的离子方程式是____________________ 。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________ 。
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________ 。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________ 。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl-、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+
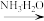 Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+ Cu+Cu2+
Cu+Cu2+ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是
④生成CuCl的离子方程式是
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是
| 编号 | 实验 | 现象 |
| III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
| IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】甲同学在药店买了一瓶补铁剂,取一片该补铁剂用盐酸溶解,经脱色过滤后,加入1~2滴液溴,振荡,溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:___________ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是___________
(2)现提供以下试剂:A.酸性高锰酸钾溶液B.氢氧化钠溶液C.四氧化碳D.硫氰化钾溶液。请你判断:推断正确的是___________ 同学(填甲或乙),并用两种方法对你的推断加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)用(2)所提供的试剂___________ (填能或不能)确定该补铁剂经脱色后的溶液中含 。若能,请写出实验方法和现象。
。若能,请写出实验方法和现象。
若不能,请说出理由。
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出双氧水与亚铁离子反应的离子方程式___________ 。
(5)丙同学在街头看到有人用刀把胳膊划的“鲜血直流”,贴上膏药两分钟后竟然“痊愈”,请你揭秘骗子的小把戏___________ (用离子方程式表示,可加适当语言描述)。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(2)现提供以下试剂:A.酸性高锰酸钾溶液B.氢氧化钠溶液C.四氧化碳D.硫氰化钾溶液。请你判断:推断正确的是
| 选用试剂(填字母) | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
 。若能,请写出实验方法和现象。
。若能,请写出实验方法和现象。| 实验方法 | 实验现象 |
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出双氧水与亚铁离子反应的离子方程式
(5)丙同学在街头看到有人用刀把胳膊划的“鲜血直流”,贴上膏药两分钟后竟然“痊愈”,请你揭秘骗子的小把戏
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学在加热NH4HCO3固体时,闻到了刺激性气味,决定对其进一步探究:
(1)如图所示,
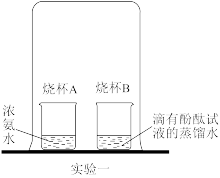
实验一中观察到的现象是_______ ,宏观上说明浓氨水有_______ ,微观上说明_______ 。写出NH4HCO3受热分解的化学方程式_______ 。
(2)实验二装置连接好之后首先要做的是_______ ,然后再通入氨气排尽装置A中的空气,最后点燃酒精灯,持续加热,发现氧化铜逐渐由黑变红,依据题中信息,写出装置A中发生反应的化学方程式_______ ,该反应中氨气是_______ 剂,实验证明了氨气具有_______ 性。
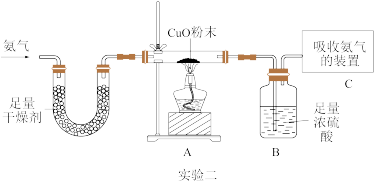
(3)实验二加热一段时间后,A、B、C三个装置的质量变化是:
该实验小组的同学按照实验数据计算出氮、氢元素的质量之比明显与理论上氨气中氮、氢的质量比不符,分析产生该误差的原因是_______ ,写出装置B中发生反应的化学方程式_______ 。
(1)如图所示,

实验一中观察到的现象是
(2)实验二装置连接好之后首先要做的是

(3)实验二加热一段时间后,A、B、C三个装置的质量变化是:
| 装置 | A | B | C |
| 数据 | 减少了4.8g | 增加了7.2g | 增加了2.8g |
您最近一年使用:0次




