根据所学化学知识,回答下列问题。
I.太阳能可以给我们提供能源,现在以太阳能为热源,经铁氧化物循环分解液态水的过程如图所示。
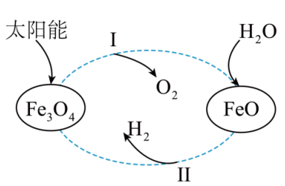
已知:①2H2(g)+O2(g)=2H2O(g)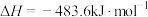
②
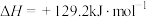
(1)请写出过程I的热化学方程式___________
II.为了实现碳达峰、碳中和,工业利用 合成乙烯,反应原理为:
合成乙烯,反应原理为:

(2)已知温度对 的平衡转化率和催化效率的影响如图:
的平衡转化率和催化效率的影响如图:
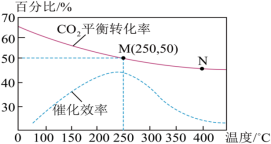
①由图可知:该反应为反应___________ (填“放热”或“吸热”)。M、N两点对应的平衡常数: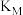
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②在总压为 的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为
的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为___________ 。用平衡分压代替平衡浓度可以得到平衡常数 ,则M点对应温度下的
,则M点对应温度下的
___________ (只需列出有具体数字的计算式,不要求计算出结果)。
③结合图像分析,工业上将该反应温度定于250℃的原因:___________
(3)已知反应的正反应速率可表示为 ,逆反应速率可表示为
,逆反应速率可表示为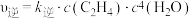 ,其中
,其中 、
、 为速率常数。如图中能够代表
为速率常数。如图中能够代表 的曲线为
的曲线为___________ (填“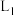 ”“
”“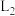 ”“
”“ ”或“
”或“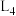 ”)。
”)。
(4)利用惰性电极电解 同样可以制得乙烯,原理如图:
同样可以制得乙烯,原理如图:
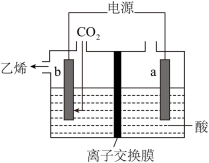
b极的电极反应式为___________
I.太阳能可以给我们提供能源,现在以太阳能为热源,经铁氧化物循环分解液态水的过程如图所示。

已知:①2H2(g)+O2(g)=2H2O(g)
②

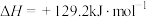
(1)请写出过程I的热化学方程式
II.为了实现碳达峰、碳中和,工业利用
 合成乙烯,反应原理为:
合成乙烯,反应原理为:

(2)已知温度对
 的平衡转化率和催化效率的影响如图:
的平衡转化率和催化效率的影响如图:
①由图可知:该反应为反应
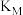
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②在总压为
 的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为
的恒压条件下,M点的投料比为n(H2):n(CO2)=3:1,达到平衡时乙烯的体积分数为 ,则M点对应温度下的
,则M点对应温度下的
③结合图像分析,工业上将该反应温度定于250℃的原因:
(3)已知反应的正反应速率可表示为
 ,逆反应速率可表示为
,逆反应速率可表示为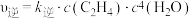 ,其中
,其中 、
、 为速率常数。如图中能够代表
为速率常数。如图中能够代表 的曲线为
的曲线为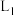 ”“
”“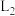 ”“
”“ ”或“
”或“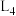 ”)。
”)。
(4)利用惰性电极电解
 同样可以制得乙烯,原理如图:
同样可以制得乙烯,原理如图:
b极的电极反应式为
更新时间:2023-04-06 15:11:19
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐1】实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
,其实验过程可表示为
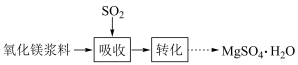
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为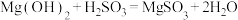 ,其平衡常数K与
,其平衡常数K与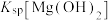 、
、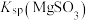 、
、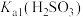 、
、 、
、 的代数关系式为
的代数关系式为
__________ 。
(2)①水浴加热氧化镁浆料,不一定能提高氧化镁浆料吸收 效率,说明原因
效率,说明原因__________ 。
②写出一种能提高氧化镁浆料吸收 效率的操作
效率的操作__________ 。
(3)在负载钴的分子筛催化剂作用下 被
被 氧化为
氧化为 。已知
。已知 的溶解度为
的溶解度为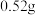 (19℃),若
(19℃),若 饱和溶液的密度以
饱和溶液的密度以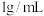 计。
计。
①计算19℃时,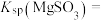
__________ 。
②写出 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为__________ 。
③金属钴在周期表中的位置是__________ 。钴原子价电子排布式为__________ 。
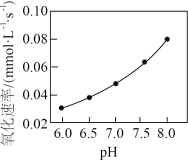
(4)在其他条件相同时,浆料中 被
被 氧化的速率随pH的变化如图所示。在
氧化的速率随pH的变化如图所示。在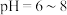 范围内,pH增大,浆料中
范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是__________ 。
 ,其实验过程可表示为
,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为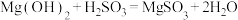 ,其平衡常数K与
,其平衡常数K与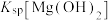 、
、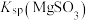 、
、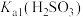 、
、 、
、 的代数关系式为
的代数关系式为
(2)①水浴加热氧化镁浆料,不一定能提高氧化镁浆料吸收
 效率,说明原因
效率,说明原因②写出一种能提高氧化镁浆料吸收
 效率的操作
效率的操作(3)在负载钴的分子筛催化剂作用下
 被
被 氧化为
氧化为 。已知
。已知 的溶解度为
的溶解度为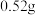 (19℃),若
(19℃),若 饱和溶液的密度以
饱和溶液的密度以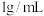 计。
计。①计算19℃时,
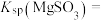
②写出
 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为③金属钴在周期表中的位置是
(4)在其他条件相同时,浆料中
 被
被 氧化的速率随pH的变化如图所示。在
氧化的速率随pH的变化如图所示。在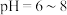 范围内,pH增大,浆料中
范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】Ⅰ.氯及其化合物是卤素中最早被认识和制备的。KClO3热分解是实验室制取O2的方法之一,KClO3在不同条件下热分解结果如下:
已知:①K(s)+ Cl2(g)=KCl(s)+437kJ
Cl2(g)=KCl(s)+437kJ
②K(s)+ Cl2(g)+
Cl2(g)+ O2=KClO3(s)+398kJ
O2=KClO3(s)+398kJ
③K(s)+ Cl2(g)+2O2=KClO4(s)+433kJ
Cl2(g)+2O2=KClO4(s)+433kJ
(1)验A、B在第一放热温度时分解的热化学方程式为4KClO3(s) 3KClO4(s)+KCl(s)+Q,Q=
3KClO4(s)+KCl(s)+Q,Q=___________ kJ。
(2)实验C制得的O2因混有杂质而有轻微的刺激性气味,杂质气体可能是___________ ,检验方法是___________ 。
Ⅱ.甲苯(C6H5CH3)与干燥的Cl2在光照下反应生成氯化苄(C6H5CH2Cl)。用下列方法分析粗产品的纯度:称取0.255 g样品,与足量 4 mol∙L−1 NaOH(aq)混合加热回流1 h,冷却至室温,加入足量硝酸酸化后,用25.00 mL 0.1000 mol∙L−1AgNO3(aq)处理,再以NH4Fe(SO4)2为指示剂,用0.1000 mol∙L−1 NH4SCN(aq)滴定剩余的AgNO3(aq),发生反应:Ag++SCN-=AgSCN↓,消耗NH4SCN(aq) 6.75 mL。
(3)滴定终点溶液为___________ 色,样品中氯化苄的质量分数为___________ (保留两位有效数字)。
(4)通常上述测定结果高于样品中氯化苄的实际含量,任写两个可能的原因___________ 。
(5)上述方法不适用于氯苯(C6H5Cl)的纯度分析,原因是___________ 。
| 实验 | 反应体系 | 第一放热温度/℃ | 第二放热温度/℃ |
| A | KClO3 | 400 | 480 |
| B | KClO3+Fe2O3 | 360 | 390 |
| C | KClO3+MnO2 | 350 |
 Cl2(g)=KCl(s)+437kJ
Cl2(g)=KCl(s)+437kJ②K(s)+
 Cl2(g)+
Cl2(g)+ O2=KClO3(s)+398kJ
O2=KClO3(s)+398kJ③K(s)+
 Cl2(g)+2O2=KClO4(s)+433kJ
Cl2(g)+2O2=KClO4(s)+433kJ(1)验A、B在第一放热温度时分解的热化学方程式为4KClO3(s)
 3KClO4(s)+KCl(s)+Q,Q=
3KClO4(s)+KCl(s)+Q,Q=(2)实验C制得的O2因混有杂质而有轻微的刺激性气味,杂质气体可能是
Ⅱ.甲苯(C6H5CH3)与干燥的Cl2在光照下反应生成氯化苄(C6H5CH2Cl)。用下列方法分析粗产品的纯度:称取0.255 g样品,与足量 4 mol∙L−1 NaOH(aq)混合加热回流1 h,冷却至室温,加入足量硝酸酸化后,用25.00 mL 0.1000 mol∙L−1AgNO3(aq)处理,再以NH4Fe(SO4)2为指示剂,用0.1000 mol∙L−1 NH4SCN(aq)滴定剩余的AgNO3(aq),发生反应:Ag++SCN-=AgSCN↓,消耗NH4SCN(aq) 6.75 mL。
(3)滴定终点溶液为
(4)通常上述测定结果高于样品中氯化苄的实际含量,任写两个可能的原因
(5)上述方法不适用于氯苯(C6H5Cl)的纯度分析,原因是
您最近一年使用:0次
【推荐3】减少氮的氧化物在大气中的排放是环境保护的重要内容。合理应用和处理氮及其化合物,在生产生活中有重要意义。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g) N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是
N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是___________ 。
A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g) 2CO2(g)+N2(g),若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol CO、0.2 mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示(反应前后温度不变)。
2CO2(g)+N2(g),若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol CO、0.2 mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示(反应前后温度不变)。
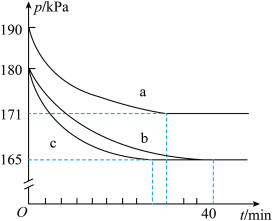
①实验b从开始至平衡时的反应速率v(CO)=___________ ;
②实验b中NO的平衡转化率为___________ 。
(3)已知 N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ·mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ·mol﹣1,
根据盖斯定律写出肼N2H4(g)与NO2(g)完全反应生成氮气和气态水的热化学方程式___________ 。
(4)回答下列问题:

①该燃料电池中负极发生的反应式为___________ 。
②电池工作时,OH-移向___________ 电极(填“a”或“b”)。
③当电池放电转移10 mol电子时,至少消耗燃料肼___________ g。
(5)工业上消除氮氧化物的污染可用如下反应: 。反应中还原剂为
。反应中还原剂为___________ (填化学式);若反应中消耗 ,则转移电子的物质的量为
,则转移电子的物质的量为___________  。
。
(1)通过活性炭对汽车尾气进行处理,相关原理为C(s)+2NO(g)
 N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是
N2(g)+CO2(g)。下列情况能说明该反应达到平衡状态的是A.2v正(NO)=v逆(CO2)
B.混合气体中N2的体积分数保持不变
C.单位时间内断裂1个N≡N同时生成1个C=O
D.恒温、恒容条件下,混合气体的密度保持不变
E.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
(2)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)
 2CO2(g)+N2(g),若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol CO、0.2 mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示(反应前后温度不变)。
2CO2(g)+N2(g),若在容积为10 L的密闭容器中进行该反应,起始时充入0.4 mol CO、0.2 mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示(反应前后温度不变)。
①实验b从开始至平衡时的反应速率v(CO)=
②实验b中NO的平衡转化率为
(3)已知 N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ·mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=﹣534kJ·mol﹣1,
根据盖斯定律写出肼N2H4(g)与NO2(g)完全反应生成氮气和气态水的热化学方程式
(4)回答下列问题:

①该燃料电池中负极发生的反应式为
②电池工作时,OH-移向
③当电池放电转移10 mol电子时,至少消耗燃料肼
(5)工业上消除氮氧化物的污染可用如下反应:
 。反应中还原剂为
。反应中还原剂为 ,则转移电子的物质的量为
,则转移电子的物质的量为 。
。
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐1】过碳酸钠(2Na2CO3·3H2O2) 的俗名为固态双氧水,是由碳酸钠与过氧化氢复合形成的一种固体放氧剂,可用于洗涤、印染、纺织、造纸、医药卫生等领域。常温下,过碳酸钠溶于水时自动分解并放出氧气。过碳酸钠的制备流程如下图所示:
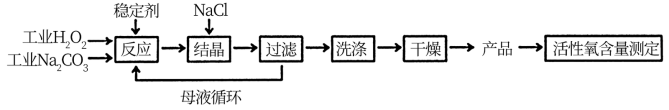
请回答下列问题:
(1)制备过程中要添加稳定剂,什么类型的物质不能作为稳定剂? (要求写出两类)________ ;__________ 。
(2)该反应要控制在低温下进行,为什么?__________ 。
(3)加入NaCl的作用是什么?__________ 。
(4)通过收集气体并测定其体积的量来确定过碳酸钠产品中活性氧的含量。图给出了部分装置,请画出其余装置、标出各部件的名称,并简述实验步骤________ ;__________ 。
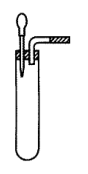

请回答下列问题:
(1)制备过程中要添加稳定剂,什么类型的物质不能作为稳定剂? (要求写出两类)
(2)该反应要控制在低温下进行,为什么?
(3)加入NaCl的作用是什么?
(4)通过收集气体并测定其体积的量来确定过碳酸钠产品中活性氧的含量。图给出了部分装置,请画出其余装置、标出各部件的名称,并简述实验步骤

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】在 密闭容器中放入
密闭容器中放入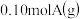 ,在一定温度进行如下反应:
,在一定温度进行如下反应: 容器内气体总压强
容器内气体总压强 与起始压强
与起始压强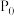 的比值随反应时间
的比值随反应时间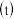 数据见表:
数据见表:
回答下列问题:
 下列能提高A的转化率的是
下列能提高A的转化率的是______ 。
A.升高温度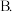 体系中通入A气体
体系中通入A气体 将D的浓度减小
将D的浓度减小  通入稀有气体He,使体系压强增大到原来的5倍
通入稀有气体He,使体系压强增大到原来的5倍
E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
 该反应的平衡常数表达式
该反应的平衡常数表达式
______ ;前2小时C的反应速率是______ ;计算平衡时A的转化率______ 。
 若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为
若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为______ 。 保留两位有效数字
保留两位有效数字
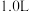 密闭容器中放入
密闭容器中放入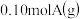 ,在一定温度进行如下反应:
,在一定温度进行如下反应: 容器内气体总压强
容器内气体总压强 与起始压强
与起始压强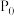 的比值随反应时间
的比值随反应时间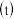 数据见表:
数据见表:时间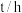 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
 |  |  | 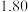 | 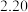 | 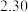 | 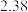 | 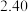 | 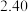 |
 下列能提高A的转化率的是
下列能提高A的转化率的是A.升高温度
 体系中通入A气体
体系中通入A气体 将D的浓度减小
将D的浓度减小  通入稀有气体He,使体系压强增大到原来的5倍
通入稀有气体He,使体系压强增大到原来的5倍E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
 该反应的平衡常数表达式
该反应的平衡常数表达式
 若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为
若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为 保留两位有效数字
保留两位有效数字
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如下表。
(1)则该温度下,
___________  ;K3=
;K3=___________ (用 和
和 表示)。
表示)。
Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
___________ (填“>”“<”或“=”)0;
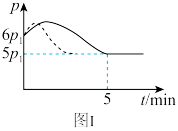
(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是___________ ;
(4)5min时,再充入0.08molNO和0.04mol ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将___________ (填“增大”“减小”或“不变”)。
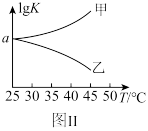
(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(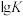 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是___________ (填“甲”或“乙”)。
Ⅲ.在300℃下,将 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,
(6)该反应条件下的平衡常数为
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
| 热化学方程式 | 平衡常数 | |
| ① | 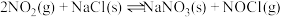 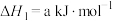 |  |
| ② | 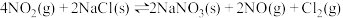 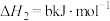 |  |
| ③ |  |  |
(1)则该温度下,

 ;K3=
;K3= 和
和 表示)。
表示)。Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol
 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则

(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是
(4)5min时,再充入0.08molNO和0.04mol
 ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(
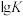 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是
Ⅲ.在300℃下,将
 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,(6)该反应条件下的平衡常数为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】用化学用语填空。
(1)图1甲醇( )脱氢法可制备甲醛(HCHO,反应体系中各物质均为气态),结合如图回答。
)脱氢法可制备甲醛(HCHO,反应体系中各物质均为气态),结合如图回答。
①此反应的热化学方程式是___________ 。
②反应活化能:过程Ⅰ___________ 过程Ⅱ(填“>”“=”或“<”)。
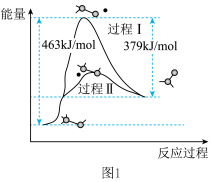
(2)某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图2,据图回答:
①该反应的化学方程式可表示为___________ 。
②反应起始至t min(设 ),Z的平均反应速率是:
),Z的平均反应速率是:___________ ,Y的体积分数为___________ 。
③下列可判断反应已达到平衡状态的是___________ 。
A.X、Y、Z的反应速率相等 B.体系的压强保持不变
C.混合气体的密度不变 D.生成1 mol Z 的同时生成2 mol X
E.混合气体的平均相对分子质量不变
(1)图1甲醇(
 )脱氢法可制备甲醛(HCHO,反应体系中各物质均为气态),结合如图回答。
)脱氢法可制备甲醛(HCHO,反应体系中各物质均为气态),结合如图回答。
①此反应的热化学方程式是
②反应活化能:过程Ⅰ
(2)某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图2,据图回答:

①该反应的化学方程式可表示为
②反应起始至t min(设
 ),Z的平均反应速率是:
),Z的平均反应速率是:③下列可判断反应已达到平衡状态的是
A.X、Y、Z的反应速率相等 B.体系的压强保持不变
C.混合气体的密度不变 D.生成1 mol Z 的同时生成2 mol X
E.混合气体的平均相对分子质量不变
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】二甲醚是重要的化工原料,采用二氧化碳的有效转化,既是生成二甲醚的简便方法,又是实现“碳中和”的重要途径。
Ⅰ. 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中发生副反应:
转化方法,其过程中发生副反应:
①
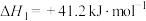
已知反应:
②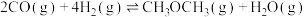
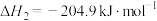
(1) 催化加氢合成二甲醚的热化学方程式为
催化加氢合成二甲醚的热化学方程式为___________ ,该反应自发进行的条件为___________ 。
(2)在恒压、 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图。其中,
的选择性随温度变化如图。其中,
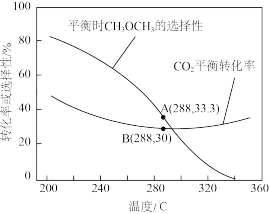
当温度高于300℃, 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是___________ 。若起始投料比为 ,不考虑其他副反应,则288℃时,反应①的化学平衡常数K=
,不考虑其他副反应,则288℃时,反应①的化学平衡常数K=___________ (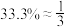 )。
)。
Ⅱ.由 制备二甲醚的另一种方法为先合成甲醇,再经脱水,主要分为以下步骤。
制备二甲醚的另一种方法为先合成甲醇,再经脱水,主要分为以下步骤。
反应③:

反应④: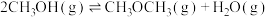
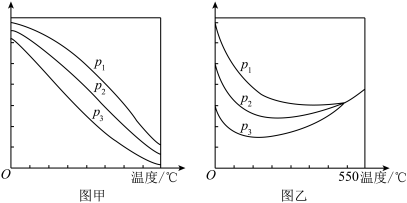
(3)在不同的压强下,按照 投料比合成甲醇,实验测定
投料比合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲或乙所示。
的平衡产率随温度的变化关系如图甲或乙所示。
下列说法正确的是___________(填字母)。
(4)压强为4MPa,当 的混合气体以一定流速通过装有某种催化剂的反应器。在280℃时,若
的混合气体以一定流速通过装有某种催化剂的反应器。在280℃时,若 的平衡转化率为7.00%,甲醇的选择性为95.0%,则甲醇的收率为
的平衡转化率为7.00%,甲醇的选择性为95.0%,则甲醇的收率为___________
(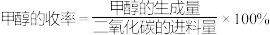 )。
)。
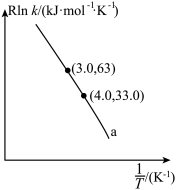
(5)甲醇脱水若条件控制不当可生成丙烯,反应为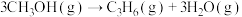 ,反应的Arrhenius经验公式的实验数据如图曲线所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图曲线所示,已知Arrhenius经验公式为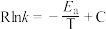 (其中,
(其中, 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能
___________  。
。
Ⅰ.
 催化加氢合成二甲醚是一种
催化加氢合成二甲醚是一种 转化方法,其过程中发生副反应:
转化方法,其过程中发生副反应:①
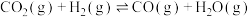
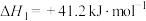
已知反应:
②
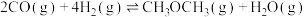
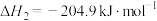
(1)
 催化加氢合成二甲醚的热化学方程式为
催化加氢合成二甲醚的热化学方程式为(2)在恒压、
 和
和 的起始量一定的条件下,
的起始量一定的条件下, 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度变化如图。其中,
的选择性随温度变化如图。其中,

当温度高于300℃,
 的平衡转化率随温度升高而上升的原因是
的平衡转化率随温度升高而上升的原因是 ,不考虑其他副反应,则288℃时,反应①的化学平衡常数K=
,不考虑其他副反应,则288℃时,反应①的化学平衡常数K=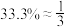 )。
)。Ⅱ.由
 制备二甲醚的另一种方法为先合成甲醇,再经脱水,主要分为以下步骤。
制备二甲醚的另一种方法为先合成甲醇,再经脱水,主要分为以下步骤。反应③:


反应④:
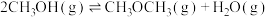
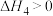
(3)在不同的压强下,按照
 投料比合成甲醇,实验测定
投料比合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲或乙所示。
的平衡产率随温度的变化关系如图甲或乙所示。
下列说法正确的是___________(填字母)。
A.图甲的纵坐标表示 的平衡产率 的平衡产率 |
B.压强: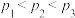 |
C.为了同时提高 的平衡转化率和 的平衡转化率和 的平衡产率,应选择高温、高压的反应条件 的平衡产率,应选择高温、高压的反应条件 |
D.一定温度、压强下,寻找活性更高的催化剂,是提高 的平衡转化率的主要研究方向 的平衡转化率的主要研究方向 |
 的混合气体以一定流速通过装有某种催化剂的反应器。在280℃时,若
的混合气体以一定流速通过装有某种催化剂的反应器。在280℃时,若 的平衡转化率为7.00%,甲醇的选择性为95.0%,则甲醇的收率为
的平衡转化率为7.00%,甲醇的选择性为95.0%,则甲醇的收率为(
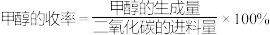 )。
)。(5)甲醇脱水若条件控制不当可生成丙烯,反应为
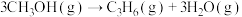 ,反应的Arrhenius经验公式的实验数据如图曲线所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图曲线所示,已知Arrhenius经验公式为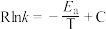 (其中,
(其中, 为活化能,k为速率常数,R和C为常数)。该反应的活化能
为活化能,k为速率常数,R和C为常数)。该反应的活化能
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐3】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。正丁烷脱氢制丁烯的热化学方程式为: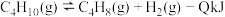 (
(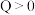 )。完成下列填空:
)。完成下列填空:
(1)T1℃时,5mol 在100L容器内脱氢,30min达到平衡转化了30%。则30min内的平均反应速率
在100L容器内脱氢,30min达到平衡转化了30%。则30min内的平均反应速率
_______ 。为提高反应的平衡转化率,可采取的一条措施是_______ 。
(2)T2℃时,该反应平衡常数K=1.2,则T1_______ T2 (选填“>”“<”或“=”)。
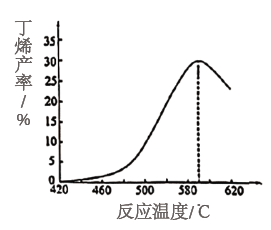
(3)如图为反应平衡时丁烯产率和反应温度的关系曲线。丁烯的产率在590℃之前随温度升高而增大的原因可能是_______ ;590℃之后,丁烯的产率快速降低的主要原因可能是_______ 。
(4)已知: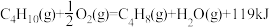

则
_______ 。
(5)写出2-丁烯在一定条件下发生聚合反应的化学方程式_______ 。
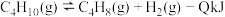 (
(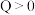 )。完成下列填空:
)。完成下列填空:(1)T1℃时,5mol
 在100L容器内脱氢,30min达到平衡转化了30%。则30min内的平均反应速率
在100L容器内脱氢,30min达到平衡转化了30%。则30min内的平均反应速率
(2)T2℃时,该反应平衡常数K=1.2,则T1
(3)如图为反应平衡时丁烯产率和反应温度的关系曲线。丁烯的产率在590℃之前随温度升高而增大的原因可能是

(4)已知:
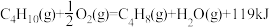

则

(5)写出2-丁烯在一定条件下发生聚合反应的化学方程式
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】如图是一个用石墨作电极,电解稀 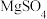 溶液的装置,电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的
溶液的装置,电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的  范围是
范围是  ,酸性溶液中呈红色,碱性溶液中呈黄色)。回答下列问题。
,酸性溶液中呈红色,碱性溶液中呈黄色)。回答下列问题。___________ (填序号)。
①A管溶液由红色变为黄色 ②B管溶液由红色变为黄色
③A管溶液不变色 ④B管溶液不变色
(2)写出 管中发生的电极反应:
管中发生的电极反应:___________ ;
(3)写出 管中发生的电极反应:
管中发生的电极反应:___________ ;
(4)检验 管中气体的方法是
管中气体的方法是___________ ;
(5)若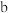 管中生成标况下气体
管中生成标况下气体  ,则该装置电解过程中转移的电子数目为
,则该装置电解过程中转移的电子数目为___________ 。
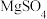 溶液的装置,电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的
溶液的装置,电解液中事先加有指示剂,此时溶液呈红色(指示剂变色的  范围是
范围是  ,酸性溶液中呈红色,碱性溶液中呈黄色)。回答下列问题。
,酸性溶液中呈红色,碱性溶液中呈黄色)。回答下列问题。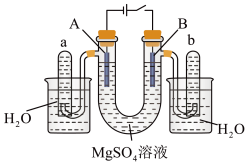
①A管溶液由红色变为黄色 ②B管溶液由红色变为黄色
③A管溶液不变色 ④B管溶液不变色
(2)写出
 管中发生的电极反应:
管中发生的电极反应:(3)写出
 管中发生的电极反应:
管中发生的电极反应:(4)检验
 管中气体的方法是
管中气体的方法是(5)若
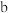 管中生成标况下气体
管中生成标况下气体  ,则该装置电解过程中转移的电子数目为
,则该装置电解过程中转移的电子数目为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】甲醇是一种可再生能源,由 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ: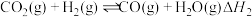
反应Ⅲ: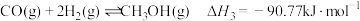
(1)反应Ⅱ的
_______ 。反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为 、
、 、
、 ,则
,则
_______ (用 、
、 表示)。
表示)。
(2)反应Ⅰ能自发进行的条件是_______ (填“较低温度”“较高温度”或“任何温度”)。
(3)下表是反应Ⅲ: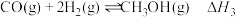 在不同温度下化学平衡常数(K)
在不同温度下化学平衡常数(K)
某温度下,将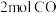 和
和 充入2L的密闭容器中,充分反应后达平衡时,
充入2L的密闭容器中,充分反应后达平衡时,
①测得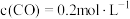 ,则
,则 的转化率是
的转化率是_______ ,此时的温度为_______ 。
②要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是_______ 。
A.升温 B.恒容充入 C.恒容充入
C.恒容充入 D.分离出甲醇
D.分离出甲醇
③在此条件下,不可作为判断反应Ⅲ达到平衡状态的标志是_______ 。
A.混合气体的密度不再变化 B.生成 的同时生成
的同时生成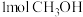
C.混合气体的平均相对分子质量不再变化 D.甲醇的百分含量不再变化
(4)由 制备甲醇还需要氢气。工业上用电解法制取
制备甲醇还需要氢气。工业上用电解法制取 ,同时获得氢气,原理如下图。
,同时获得氢气,原理如下图。
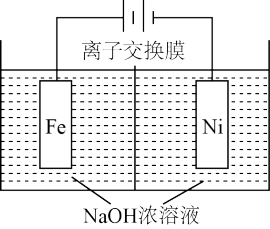
电解一段时间后, 降低的区域在
降低的区域在_______ 。(填“阴极室”或“阳极室”)。该室发生的电极反应式为_______ 。
 制备甲醇可能涉及的反应如下:
制备甲醇可能涉及的反应如下:反应Ⅰ:

反应Ⅱ:
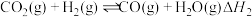
反应Ⅲ:
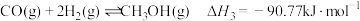
(1)反应Ⅱ的

 、
、 、
、 ,则
,则
 、
、 表示)。
表示)。(2)反应Ⅰ能自发进行的条件是
(3)下表是反应Ⅲ:
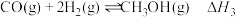 在不同温度下化学平衡常数(K)
在不同温度下化学平衡常数(K)| 温度/℃ | 250 | 300 | 350 |
| 平衡常数(K) | 2.04 | 0.27 | 0.012 |
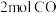 和
和 充入2L的密闭容器中,充分反应后达平衡时,
充入2L的密闭容器中,充分反应后达平衡时,①测得
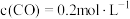 ,则
,则 的转化率是
的转化率是②要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是A.升温 B.恒容充入
 C.恒容充入
C.恒容充入 D.分离出甲醇
D.分离出甲醇③在此条件下,不可作为判断反应Ⅲ达到平衡状态的标志是
A.混合气体的密度不再变化 B.生成
 的同时生成
的同时生成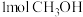
C.混合气体的平均相对分子质量不再变化 D.甲醇的百分含量不再变化
(4)由
 制备甲醇还需要氢气。工业上用电解法制取
制备甲醇还需要氢气。工业上用电解法制取 ,同时获得氢气,原理如下图。
,同时获得氢气,原理如下图。
电解一段时间后,
 降低的区域在
降低的区域在
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g) H= +133 kJ/mol
H= +133 kJ/mol
H2O(g)=H2O(l) H=- 44 kJ/mol
H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是___________ 。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO 。物质A的化学式为
。物质A的化学式为___________ ,阴极的电极反应式是___________ 。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g)
 H= +133 kJ/mol
H= +133 kJ/molH2O(g)=H2O(l)
 H=- 44 kJ/mol
H=- 44 kJ/mol催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO 。物质A的化学式为
。物质A的化学式为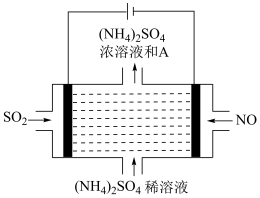
您最近一年使用:0次



