自然界中存在大量的金属元素,在工农业生产中有着广泛的应用。回答下列问题:
(1)下列有关微粒性质的排列顺序错误的是___________。
(2)基态Ni原子核外电子运动状态有___________ 种,其核外电子排布式中未成对电子数为___________ 个。
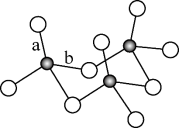
(3)钌−多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(II)的配位数是___________ ,N原子的杂化类型为___________ 。

(4)SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________ ;该结构中S−O键长有两类,一类键长约140pm,另一类键长约为160pm,较长的键为___________ (填图中字母),该分子中含有___________ 个σ键。
(1)下列有关微粒性质的排列顺序错误的是___________。
| A.元素的电负性:P<O<F | B.元素的第一电离能:C<N<O |
| C.离子半径:O2−>Na+>Mg2+ | D.原子的未成对电子数:Mn>Si>Cl |
(3)钌−多吡啶配合物具有丰富的光化学和光物理信息,结构简式如图所示。钌(II)的配位数是

(4)SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为

更新时间:2023-04-06 22:56:39
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________ ,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________ 种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____ B(选填“>或“<”);第一电离能N>O,原因是__________________________________________ 。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
① 的空间构型为
的空间构型为_____________ ,其中硫原子采用____________ 杂化。
②与 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_________________ (任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有___________ 个。
②该化合物的化学式为_________________________________ 。
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为__________________ g/cm3(列式即可)
(1)基态Zn原子的电子占据能量最高的能层符号为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①
 的空间构型为
的空间构型为②与
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有
②该化合物的化学式为
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】氟是特种塑料、橡胶和冷冻剂(氟氯烷)中的关键元素。回答下列问题:
(1)基态F原子核外电子的空间运动状态有___________ 种。
(2)同周期元素N、O、F的第一电离能由大到小的顺序为___________ ,N、O、F常见的氢化物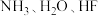 的稳定性由强到弱的顺序为
的稳定性由强到弱的顺序为___________ 。
(3)氟气与水的反应复杂,主要生成 和
和 ,副反应生成少量的
,副反应生成少量的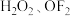 等。
等。 分子的空间构型为
分子的空间构型为___________ ; 与水能以任意比例互溶,原因是
与水能以任意比例互溶,原因是___________ 。在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合 形式存在,使
形式存在,使 分子缔合的作用力是
分子缔合的作用力是___________ 。
(4)同主族元素 的单质均可与水反应生成次卤酸,则
的单质均可与水反应生成次卤酸,则 中氯原子的杂化方式为
中氯原子的杂化方式为___________ 。
(1)基态F原子核外电子的空间运动状态有
(2)同周期元素N、O、F的第一电离能由大到小的顺序为
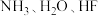 的稳定性由强到弱的顺序为
的稳定性由强到弱的顺序为(3)氟气与水的反应复杂,主要生成
 和
和 ,副反应生成少量的
,副反应生成少量的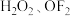 等。
等。 分子的空间构型为
分子的空间构型为 与水能以任意比例互溶,原因是
与水能以任意比例互溶,原因是 形式存在,使
形式存在,使 分子缔合的作用力是
分子缔合的作用力是(4)同主族元素
 的单质均可与水反应生成次卤酸,则
的单质均可与水反应生成次卤酸,则 中氯原子的杂化方式为
中氯原子的杂化方式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)基态Cr原子的价层电子的轨道表示式为___________ 。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由 与尿素[
与尿素[ ]反应先得到配合物
]反应先得到配合物 ,然后正通有
,然后正通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
② 中存在的化学键有
中存在的化学键有___________ (填字母)。
A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示:
的熔点如图所示: 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是___________ 。
②请解释 随原子序数的递增熔点变化的原因
随原子序数的递增熔点变化的原因___________ 。
(4)丁二酮肟常与 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式:___________ 。
(1)基态Cr原子的价层电子的轨道表示式为
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由
 与尿素[
与尿素[ ]反应先得到配合物
]反应先得到配合物 ,然后正通有
,然后正通有 和
和 混合气体的反应炉内热分解制得。
混合气体的反应炉内热分解制得。①尿素中C、N、O三种元素的第一电离能由大到小的顺序为
②
 中存在的化学键有
中存在的化学键有A.极性共价键 B.非极性共价键 C.氢键 D.配位键
(3)四卤化硅
 的沸点和二卤化铅
的沸点和二卤化铅 的熔点如图所示:
的熔点如图所示:
 的沸点依F、Cl、Br、I次序升高的原因是
的沸点依F、Cl、Br、I次序升高的原因是②请解释
 随原子序数的递增熔点变化的原因
随原子序数的递增熔点变化的原因(4)丁二酮肟常与
 形成图A所示的配合物,图B是图A中硫代氧后的结构简式:
形成图A所示的配合物,图B是图A中硫代氧后的结构简式: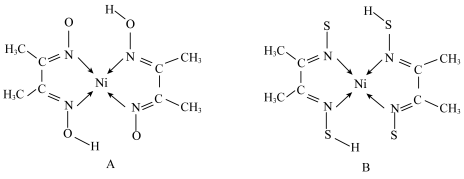
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】下表是元素周期表的一部分,表中所列的字母分别代表一种元素。
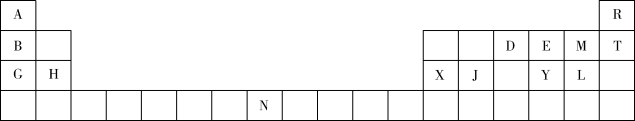
回答下列问题:
(1)D的简单气态氢化物的VSEPR模型为_______ 。
(2)第一电离能H_______ X(填“>”“<”或“=”),其原因是_______ 。
(3)电负性E_______ M(填“>”“<”或“=”)。
(4)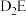 的沸点比
的沸点比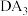 的沸点低,其原因是
的沸点低,其原因是_______ 。
(5)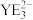 的键角比
的键角比 的键角小的原因是
的键角小的原因是_______ 。

回答下列问题:
(1)D的简单气态氢化物的VSEPR模型为
(2)第一电离能H
(3)电负性E
(4)
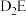 的沸点比
的沸点比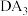 的沸点低,其原因是
的沸点低,其原因是(5)
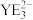 的键角比
的键角比 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)A元素基态原子占据最高能级的电子云轮廓图为_______ ;B元素原子中未成对电子为_______ 。
(2)写出C元素基态原子的电子排布式:_______ 。
(3)D元素的价层电子排布图为:_______ 。
(4)元素B与D的电负性的大小关系是B_______ (填“>”“<”或“=”,下同)D,E与C的第一电离能大小关系是E_______ C。
(1)A元素基态原子占据最高能级的电子云轮廓图为
(2)写出C元素基态原子的电子排布式:
(3)D元素的价层电子排布图为:
(4)元素B与D的电负性的大小关系是B
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________ ,有___________ 个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是_____________ 。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为____________ ,1mol 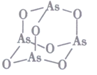 As4O6含有σ键的物质的量为
As4O6含有σ键的物质的量为________ mol。
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子
坐标参数A处Li为(0,0, );B处As为(
);B处As为( ,
, ,
, );C处Li的坐标参数为
);C处Li的坐标参数为_____________ 。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数α=594 pm,NA表示阿伏伽德罗常数的数值,其密度为____________ g·cm-3(列出计算式即可)。
(1)基态As原子的核外电子排布式为[Ar]
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为
 As4O6含有σ键的物质的量为
As4O6含有σ键的物质的量为(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子
坐标参数A处Li为(0,0,
 );B处As为(
);B处As为( ,
, ,
, );C处Li的坐标参数为
);C处Li的坐标参数为②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数α=594 pm,NA表示阿伏伽德罗常数的数值,其密度为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】已知铜的配合物A(结构如下图)。请回答下列问题:Cu

(1)Cu2+基态核外电子排布式为___________ 。基态Cu原子中,核外电子占据最高能层的符号是___________ 。
(2)A所含三种元素C、N、O的电负性大小顺序为___________ 。其中氮原子的杂化轨道类型为___________ 。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ 分子(极性或非极性); N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为___________ 。
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是_______
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角___________ 120°(选填“大于”、“等于”或“小于”),甲醛能与水形成氢键,其表示式为:___________ 。

(1)Cu2+基态核外电子排布式为
(2)A所含三种元素C、N、O的电负性大小顺序为
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】锂—磷酸氧铜电池正极的活性物质是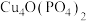 ,可通过下列反应制备:
,可通过下列反应制备: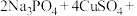
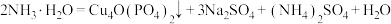 。
。
(1)写出基态 的电子排布式:
的电子排布式:_______________ 。
(2)P、S元素第一电离能大小关系为_______________ ,原因是_______________ 。
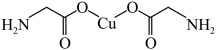
(3)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为_______________ ,基态碳原子核外电子有_______________ 种运动状态。 ,生成配合物
,生成配合物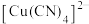 ,则
,则 该配合物含有
该配合物含有 键的数目为
键的数目为_______________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为_______________ ,铜的原子半径为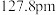 ,
, 表示阿伏加德罗常数的值,晶体铜的密度为
表示阿伏加德罗常数的值,晶体铜的密度为_______________  (列出计算式即可)。
(列出计算式即可)。
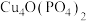 ,可通过下列反应制备:
,可通过下列反应制备: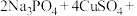
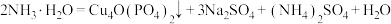 。
。(1)写出基态
 的电子排布式:
的电子排布式:(2)P、S元素第一电离能大小关系为
(3)氨基乙酸铜分子结构如图所示,碳原子的杂化方式为
 ,生成配合物
,生成配合物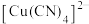 ,则
,则 该配合物含有
该配合物含有 键的数目为
键的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(5)晶体铜的晶胞结构如图甲所示,原子之间相对位置关系的平面图如图乙所示,铜原子的配位数为
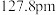 ,
, 表示阿伏加德罗常数的值,晶体铜的密度为
表示阿伏加德罗常数的值,晶体铜的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
【推荐3】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外子排布式为_______ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_______ ,电负性由大到小的顺序为_______ 。
(3)AsCl3分子的立体构型为_______ ,其中As的杂化轨道类型为_______ 。
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是_______ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。
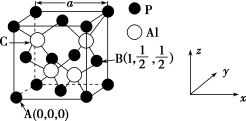
①磷化铝的晶体类型为_______ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_______ 。
③磷化铝的晶胞参数a=546.35 pm,其密度为_______ g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数的值)。
(1)基态砷原子的核外子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)AsCl3分子的立体构型为
(4)H2O与H2S为同族元素的氢化物,H2O可以形成H9O
 或H3O+,而H2S几乎不能形成类似的H9S
或H3O+,而H2S几乎不能形成类似的H9S 或H3S+,其原因是
或H3S+,其原因是(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2 000 ℃,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35 pm,其密度为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为____________ ,3d能级上的未成对电子数为________ 。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是__________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为________ ,提供孤电子对的成键原子是________ 。
③氨的沸点________ (填“高于”或“低于”)膦(PH3),原因是___________ ;氨是________ 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为________ 。
(3)单质铜及镍都是由________ 键形成的晶体。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
③氨的沸点
(3)单质铜及镍都是由
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】氮元素与氢元素能形成多种化合物,在工业、农业和国防等方面用途非常广泛,例如:氨气、肼(N2H4)、叠氮酸(HN3)……等,请回答下列问题:
(1)N位于周期表中____ 区,基态N原子的价电子排布式为____ 。
(2)N2H4分子的电子式为____ ,其中N采取____ 杂化。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式____ ;叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中Fe的配位数为____ ,SO 的立体构型为
的立体构型为____ 。
(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为____ 。
(5)氮与铝形成的某种晶体的晶胞如图所示。
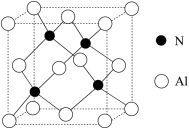
①该晶体的化学式为____ 。
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率____ (用含a、b、d和NA的式子表示)。
(1)N位于周期表中
(2)N2H4分子的电子式为
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N
 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式 的立体构型为
的立体构型为(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为
(5)氮与铝形成的某种晶体的晶胞如图所示。

①该晶体的化学式为
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子排布图为___________ 。
(2)已知电离能:I2(Ti)=1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为___________ 。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
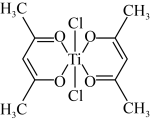
①钛的配位数为___________ ,碳原子的杂化类型___________ 。
②该配合物中存在的化学键有___________ (填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 E。氢键
(4)钙钛矿(CaTiO3)是工业获取钛的重要原料。CaTiO3晶胞如下图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________ nm(已知 =1.414),与Ti紧邻的O个数为
=1.414),与Ti紧邻的O个数为___________ 。
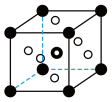
(5)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___________ 位置,O处于___________ 位置。
(1)基态Ti原子的价电子排布图为
(2)已知电离能:I2(Ti)=1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:

①钛的配位数为
②该配合物中存在的化学键有
A.离子键 B.配位键 C.金属键 D.共价键 E。氢键
(4)钙钛矿(CaTiO3)是工业获取钛的重要原料。CaTiO3晶胞如下图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为
 =1.414),与Ti紧邻的O个数为
=1.414),与Ti紧邻的O个数为
(5)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于
您最近一年使用:0次



