工业上利用炼锌矿渣[含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4等铁的化合物]获得3种金属盐,并进一步制备半导体材料氮化镓GaN,部分工艺流程如图:
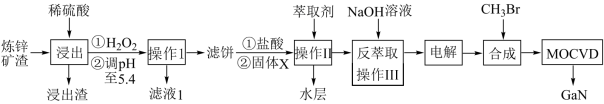
已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
②镓的化学性质与铝相似;
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为_______ , 浸取前需对矿渣粉碎的目的是_______ 。
(2)“浸出”后①中加入H2O2的离子方程式为_______ 。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)萃取前,加入的固体X为_______ (填化学式)。
(5)反萃取后,镓元素的存在形式为_______ (填化学式)。
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为_______ 。
(7)滤液1中残留的镓离子的浓度为_______ mol·L-l。

已知:
①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在该工艺条件下的萃取率见表;
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.8 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
③当某离子浓度≤10-5mol·L-1时认为沉淀完全。
请回答:
(1)Ga2(Fe2O4)3中Ga的化合价为
(2)“浸出”后①中加入H2O2的离子方程式为
(3)处理浸出液时,调节pH至5.4的目的是
(4)萃取前,加入的固体X为
(5)反萃取后,镓元素的存在形式为
(6)GaN可采用MOCVD(金属有机物化学气相淀积)技术制得:以“合成”步骤中产生的三甲基镓[Ga(CH3)3]为原料,使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(7)滤液1中残留的镓离子的浓度为
2023·江西·二模 查看更多[2]
更新时间:2023-05-30 10:09:49
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
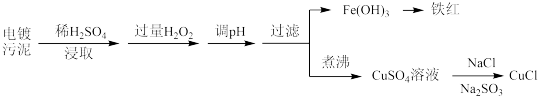
(1)酸浸后加入H2O2的目的是______ ,调pH的最适宜范围为______ 。
(2)调pH过程中加入的试剂合理的是 。
(3)煮沸CuSO4溶液的目的为__________________ 。
(4)25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数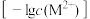 与溶液pH的变化关系如图所示。曲线
与溶液pH的变化关系如图所示。曲线____ (填“a”或“b”)表示Fe(OH)2饱和溶液中的变化关系。当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=______ 。

(5)25℃时,Fe3发生反应: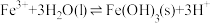 ,则该反应的平衡常数为
,则该反应的平衡常数为________ 。
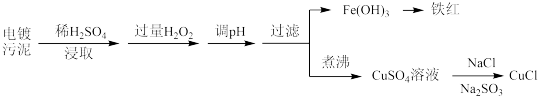
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
| Ksp | 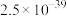 | 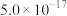 |  |
(1)酸浸后加入H2O2的目的是
(2)调pH过程中加入的试剂合理的是 。
| A.NaOH | B.CuO | C.NH3⋅H2O | D.Cu2(OH)2CO3 |
(4)25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数
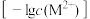 与溶液pH的变化关系如图所示。曲线
与溶液pH的变化关系如图所示。曲线
(5)25℃时,Fe3发生反应:
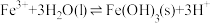 ,则该反应的平衡常数为
,则该反应的平衡常数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】锗与硅同主族,是重要的战略资源,在航空航天测控、光纤通讯、生物医学等领域都有广泛而重要的应用。煤灰中含有GeO2、SiO2及少量的As2O3、Al2O3等成分,一种从煤灰中提取四氯化锗的流程如图:
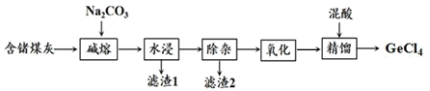
已知:①GeO2、As2O3既能溶于强酸,也能溶于强碱
②GeCl4的熔点为-49.5℃,沸点为83℃,GeCl4容易与AsCl3形成共沸物。
(1)Ge在周期表中位于第四周期___________ 族。
(2)“碱熔”在1000℃下熔炼,GeO2反应的主要化学方程式为___________ 。反应后得到的共熔物中含有的阴离子除CO 、AsO
、AsO 、GeO
、GeO 外,还有
外,还有___________ (填离子符号)
(3)“水浸”中,为提高Ge的浸出率,可以采取的措施有___________ (答2条)。
(4)“除杂”中,加入___________ (填“盐酸”、“氨水”、“Al2O3”、“NaOH溶液”),调节溶液pH=10.5,除去Al和Si。
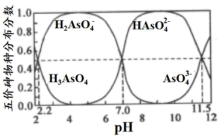
(5)已知H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图:
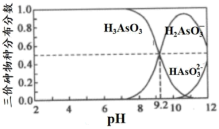
“除杂”后所得的滤液中含砷粒子浓度最大的是___________ 。在“氧化”中,加入适量的NaClO3,结合图写出主要反应的离子方程式___________ 。充分反应后继续调节溶液pH约为5,分离得到GeO2•nH2O。
(6)已知GeO2•nH2O+4HCl GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是
GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是___________ 。
(7)提取四氯化锗的另一种工艺步骤是:将含锗煤灰用上述混酸的酸浸,过滤后直接蒸馏,这种工艺的缺点是___________ 。

已知:①GeO2、As2O3既能溶于强酸,也能溶于强碱
②GeCl4的熔点为-49.5℃,沸点为83℃,GeCl4容易与AsCl3形成共沸物。
(1)Ge在周期表中位于第四周期
(2)“碱熔”在1000℃下熔炼,GeO2反应的主要化学方程式为
 、AsO
、AsO 、GeO
、GeO 外,还有
外,还有(3)“水浸”中,为提高Ge的浸出率,可以采取的措施有
(4)“除杂”中,加入
(5)已知H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图:

“除杂”后所得的滤液中含砷粒子浓度最大的是

(6)已知GeO2•nH2O+4HCl
 GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是
GeCl4+(n+2)H2O。在“精馏”中,加入硫酸和7mol/L的盐酸的混酸,硫酸的作用是(7)提取四氯化锗的另一种工艺步骤是:将含锗煤灰用上述混酸的酸浸,过滤后直接蒸馏,这种工艺的缺点是
您最近一年使用:0次
【推荐3】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
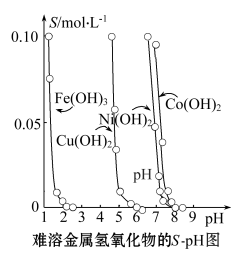
(1)pH=3时溶液中铜元素的主要存在形式是____ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液pH范围在____ 。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,____ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是____ 。
(4)已知一些难溶物的溶度积常数如表。
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的____ (填选项)。
A.NaOH B.FeS C.Na2S
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____ (填化学式)沉淀。
(6)已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=
Fe3++3H2O的平衡常数K=____ 。
(7)优化反应条件是研究化学反应的重要方向。以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+2H2O为例,探究外界条件对化学反应速率的影响,实验方案如表所示。
表中,a为____ ,b为____ 。实验表明,实验III的反应速率最快,支持这一结论的实验现象为____ 。

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液pH范围在
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,
(4)已知一些难溶物的溶度积常数如表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(6)已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,该温度下反应Fe(OH)3+3H+
 Fe3++3H2O的平衡常数K=
Fe3++3H2O的平衡常数K=(7)优化反应条件是研究化学反应的重要方向。以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+2H2O为例,探究外界条件对化学反应速率的影响,实验方案如表所示。
| 实验序号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | 温度/℃ | ||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | ||
| Ⅰ | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| Ⅱ | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| Ⅲ | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
表中,a为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】我国科学家利用一种廉价、高效的铈基催化剂,解决了在室温下把甲烷一步转化为液态产品的科学难题。二氧化铈是常用的催化剂,以氟碳铈矿(主要成分为CeFCO3)制备CeO2的工艺流程如图所示:
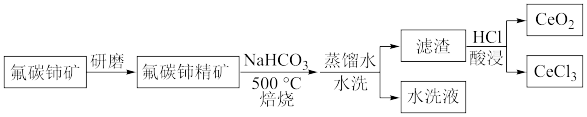
已知:CeO2难溶于稀盐酸,可溶于浓盐酸;Ce2O3可溶于稀盐酸。
请回答下列问题:
(1)CeFCO3中铈的化合价为___________ ;将氟碳铈矿研磨成精矿的目的是___________ 。
(2)碳酸氢钠在270℃时可完全分解。500℃时在空气中焙烧,CeFCO3与Na2CO3发生化学反应,生成CeO2与Ce2O3(2:1)、NaF及一种气体,该反应的化学方程式为___________ 。
(3)焙烧后对产物进行水洗,水洗液不宜使用玻璃容器盛装的原因是___________ 。
(4)工业生产中,不仅要考虑目标产物的含量,还要综合考虑生产过程中的时间效率。酸浸时,CeO2含量随盐酸浓度、酸浸温度的变化曲线如图所示,则最适宜的盐酸浓度和酸浸温度为___________ ;当温度升高到一定程度后,CeO2含量随温度升高而减小,其原因可能是___________ 。
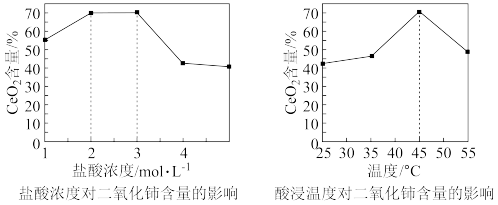
(5)室温下,向酸浸液中加入氢氧化钠溶液调节pH使Ce3+沉淀完全(通常认为残留在溶液中的离子浓度小于1x10-5mol·L-1时,沉淀就达完全),则应调节pH大于___________ 。(Ksp[Ce(OH)3]=1.0x10-20)。
(6)为测定酸浸液中CeCl3的浓度,现量取酸浸液V1mL,加入过量过硫酸铵溶液将Ce3+氧化为Ce4+,加热煮沸2min,然后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定,测得终点时消耗标准溶液V2mL,则CeCl3的浓度为___________ mol·L-1(已知:过硫酸铵具有强氧化性,受热易分解;Fe2++Ce4+=Ce3++Fe3+)。若上述过程中没有进行煮沸操作,则测定结果将会___________ (填“偏大”“偏小”或“无影响”)。
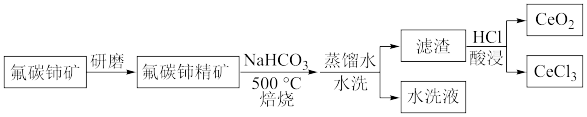
已知:CeO2难溶于稀盐酸,可溶于浓盐酸;Ce2O3可溶于稀盐酸。
请回答下列问题:
(1)CeFCO3中铈的化合价为
(2)碳酸氢钠在270℃时可完全分解。500℃时在空气中焙烧,CeFCO3与Na2CO3发生化学反应,生成CeO2与Ce2O3(2:1)、NaF及一种气体,该反应的化学方程式为
(3)焙烧后对产物进行水洗,水洗液不宜使用玻璃容器盛装的原因是
(4)工业生产中,不仅要考虑目标产物的含量,还要综合考虑生产过程中的时间效率。酸浸时,CeO2含量随盐酸浓度、酸浸温度的变化曲线如图所示,则最适宜的盐酸浓度和酸浸温度为

(5)室温下,向酸浸液中加入氢氧化钠溶液调节pH使Ce3+沉淀完全(通常认为残留在溶液中的离子浓度小于1x10-5mol·L-1时,沉淀就达完全),则应调节pH大于
(6)为测定酸浸液中CeCl3的浓度,现量取酸浸液V1mL,加入过量过硫酸铵溶液将Ce3+氧化为Ce4+,加热煮沸2min,然后用cmol/L(NH4)2Fe(SO4)2标准溶液滴定,测得终点时消耗标准溶液V2mL,则CeCl3的浓度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】三氧化二钴是重要的化工原料。以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如下图:
的流程如下图:
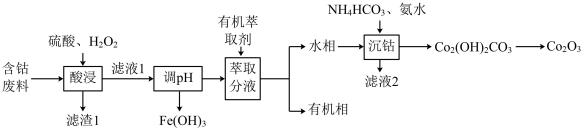
已知:“滤液1”中含有的阳离子有 、
、 、
、 、
、 。
。
(1)“滤渣1”的主要成分是___________ (写化学式)。
(2)“酸浸”时,为了提高钴的浸出率可采取的措施有(写出两种)___________ 。 可将
可将 还原为
还原为 ,离子方程式是
,离子方程式是___________ 。
(3)在工艺流程中,已知 ,调节pH值,要使
,调节pH值,要使 完全沉淀(离子沉淀完全浓度
完全沉淀(离子沉淀完全浓度 ,
, ,请问需要调节pH值为
,请问需要调节pH值为___________ 。
(4)加有机萃取剂的目的是为了除去___________ (填离子符号)。
(5)由“滤液2”可得到的主要副产品是___________ (写化学式)。
(6)“沉钴”过程中,生成 的离子方程式
的离子方程式___________ 。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如下图:
的流程如下图:
已知:“滤液1”中含有的阳离子有
 、
、 、
、 、
、 。
。(1)“滤渣1”的主要成分是
(2)“酸浸”时,为了提高钴的浸出率可采取的措施有(写出两种)
 可将
可将 还原为
还原为 ,离子方程式是
,离子方程式是(3)在工艺流程中,已知
 ,调节pH值,要使
,调节pH值,要使 完全沉淀(离子沉淀完全浓度
完全沉淀(离子沉淀完全浓度 ,
, ,请问需要调节pH值为
,请问需要调节pH值为(4)加有机萃取剂的目的是为了除去
(5)由“滤液2”可得到的主要副产品是
(6)“沉钴”过程中,生成
 的离子方程式
的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】含铬电镀废水的主要成分如表,常用“Pb2+沉淀法”和“药剂还原沉淀法”进行处理。
I. “Pb2+沉淀法”工艺流程如图。 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。
(1)铬元素的价电子排布式:_______ 。已知金属铬为体心立方晶体,密度为7.2g/cm3,求两个Cr原子的最小核间距_______ nm。(只写表达式,不计算)
(2)“氧化”过程中Cr(OH)3转化为 的离子方程式为
的离子方程式为_______ 。
(3)“沉降”过程中应调节pH范围是_______ ~10.5。
(4)已知25℃是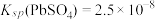 ;
;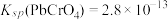 ;
; 。“沉铬”过程中:
。“沉铬”过程中:
①生成铬黄的离子方程式为_______ 。
②从平衡角度分析pH对沉铬率的影响_______ 。
II. “药剂还原沉淀法”工艺流程如图。 被Cr(VI)氧化为
被Cr(VI)氧化为_______ 。
(6)“沉淀”过程中,当溶液pH为8.6时,
_______  。
。
| 离子 | Cr(VI) | Cr3+ | Cu2+ | Fe2+ | Zn2+ |
| 含量mg/L | 28.38 | 12.92 | 0.34 | 0.069 | 0.014 |
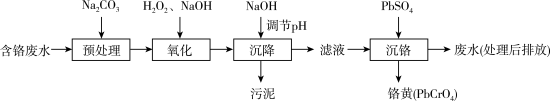
 )及沉淀开始溶解时的pH如表。
)及沉淀开始溶解时的pH如表。| 金属离子 | Cu2+ | Fe2+ | Fe3+ | Zn2+ | Cr3+ | |
| pH | 沉淀完全 | 6.7 | 8.3 | 2.8 | 8.2 | 5.6 |
| 沉淀开始溶解 | — | 13.5 | 14.0 | 10.5 | 12.0 | |
(2)“氧化”过程中Cr(OH)3转化为
 的离子方程式为
的离子方程式为(3)“沉降”过程中应调节pH范围是
(4)已知25℃是
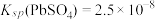 ;
;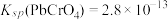 ;
; 。“沉铬”过程中:
。“沉铬”过程中:①生成铬黄的离子方程式为
②从平衡角度分析pH对沉铬率的影响
II. “药剂还原沉淀法”工艺流程如图。
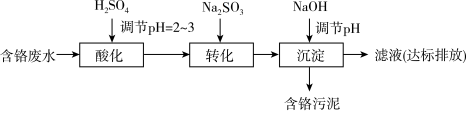
 被Cr(VI)氧化为
被Cr(VI)氧化为(6)“沉淀”过程中,当溶液pH为8.6时,

 。
。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】硫氰化钾 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。

已知:① 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;
② 。
。
请回答下列问题:
(1) 的电子式为
的电子式为___________ 。
(2)装置A用于实验室制备氨气,该反应的化学方程式为___________ 。
(3)装置B中,三口烧瓶内盛有 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是___________ 。
(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至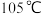 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为___________ ,装置C处的烧杯中产生淡黄色浑浊的原因是___________ (用离子方程式表示)。
(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。
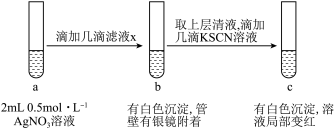
已知: 。
。
①试管b中产生银镜的原因是___________ (用离子方程式表示)。
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因___________ 。
 是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备
是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图所示的实验装置模拟工业制备 并进行相关探究实验。
并进行相关探究实验。
已知:①
 是一种不溶于水且密度大于水的非极性试剂;
是一种不溶于水且密度大于水的非极性试剂;②
 。
。请回答下列问题:
(1)
 的电子式为
的电子式为(2)装置A用于实验室制备氨气,该反应的化学方程式为
(3)装置B中,三口烧瓶内盛有
 、水和固体催化剂,通入氨气的导管需要插入
、水和固体催化剂,通入氨气的导管需要插入 液体中,其目的是
液体中,其目的是(4)待三口烧瓶内液体不再分层时,熄灭装置A处的酒精灯,关闭
 ,移开水浴。将装置B继续加热至
,移开水浴。将装置B继续加热至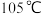 ,待
,待 完全分解后,打开
完全分解后,打开 ,缓缓滴入适量
,缓缓滴入适量 溶液,充分反应后制得
溶液,充分反应后制得 溶液。装置C中仪器a的名称为
溶液。装置C中仪器a的名称为(5)过滤装置C中吸收尾气后的悬浊液,得到滤液x。现取少量滤液x进行如图所示的探究实验。

已知:
 。
。①试管b中产生银镜的原因是
②观察到试管c中出现上述实验现象后,用力振荡试管c,又观察到红色褪去且白色沉淀增多,结合平衡移动的知识解释其原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】亚铜的化合物经常具有令人惊奇的化学性质,常见的有CuH、CuCl等。
已知:CuCl熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(白色,s)+3HCl(aq)⇌H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
方法1:次磷酸H3PO2 是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH。待CuH生成后将A装置产生的HCl气体通入,可产生CuCl。
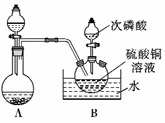
(1)写出H3PO2与CuSO4水溶液反应的化学方程式____________________ 。
(2)A装置中分液漏斗与圆底烧瓶中的物质依次为_________________________ 。
(3)刚开始通HCl气体时B装置中反应的化学方程式为______________________________ 。
(4)请描述从开始通HCl气体到通大量HCl气体过程中B装置中的现象_______________ 。
方法2:实验室用也可用如图所示装置制取CuCl,反应原理为: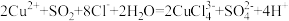
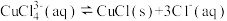 装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。
装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。
(5)①在反应过程中SO2要过量通入的原因是______________________ 。
②欲提纯某混有铜粉的CuCl晶体,请简述实验方案:___________________ 。
已知:CuCl熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(白色,s)+3HCl(aq)⇌H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
方法1:次磷酸H3PO2 是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH。待CuH生成后将A装置产生的HCl气体通入,可产生CuCl。

(1)写出H3PO2与CuSO4水溶液反应的化学方程式
(2)A装置中分液漏斗与圆底烧瓶中的物质依次为
(3)刚开始通HCl气体时B装置中反应的化学方程式为
(4)请描述从开始通HCl气体到通大量HCl气体过程中B装置中的现象
方法2:实验室用也可用如图所示装置制取CuCl,反应原理为:
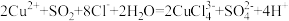
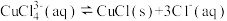 装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。
装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。(5)①在反应过程中SO2要过量通入的原因是
②欲提纯某混有铜粉的CuCl晶体,请简述实验方案:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂中(含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等)回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:

已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成 和VO2+。
和VO2+。
②有机萃取剂萃取VO2+的能力比萃取 的能力强。
的能力强。
③溶液中 与
与 可相互转化:
可相互转化: +H2O
+H2O
 +2H+
+2H+
(1)“酸浸”时,FeSO4参与反应的化学方程式为___________ 。
(2)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”加入试剂
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”加入试剂___________ 。(填化学式)假设“滤液2”中c(VO2+)=amol·L—1,“萃取”和“反萃取”每进行一次,VO2+萃取率为90%,4次操作后,“滤液2”中残留的c(VO2+)=___________ mol·L-1.(萃取率= ×100%)
×100%)
(3)“氧化”过程中发生反应的离子方程式为___________ 。
(4)“沉钒”时,通入氨气的作用是___________ ,以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请解释下图温度超过80℃以后,沉钒率下降的可能原因是___________ 。

(5)该工艺流程中,可以循环使用的物质有___________ 。

已知:①“酸浸”时V2O5和V2O4先与稀硫酸反应分别生成
 和VO2+。
和VO2+。②有机萃取剂萃取VO2+的能力比萃取
 的能力强。
的能力强。③溶液中
 与
与 可相互转化:
可相互转化: +H2O
+H2O
 +2H+
+2H+(1)“酸浸”时,FeSO4参与反应的化学方程式为
(2)“萃取”和“反萃取”时,将发生R2(SO4)n(水层)+2nHA(有机层)
 2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”加入试剂
2RAn(有机层)+nH2SO4(水层)(R表示VO2+,HA表示有机萃取剂),“反萃取”加入试剂 ×100%)
×100%)(3)“氧化”过程中发生反应的离子方程式为
(4)“沉钒”时,通入氨气的作用是

(5)该工艺流程中,可以循环使用的物质有
您最近一年使用:0次



