B、N、F、Ti、Fe、As、Se等元素及其化合物的研究对工农业生产意义重大,回答下列问题:
(1)写出Ti基态原子的电子排布式_____ 。
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为_____ 。
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为_____ 。
(4)BF3的空间构型为_____ ;其中B原子采用_____ 杂化,根据对角线规则,B的一些化学性质与元素_____ 的相似。
(5)元素As与N同族。As的氢化物的沸点比NH3的_____ (填“高”或“低”),其判断理由是_____ 。
(1)写出Ti基态原子的电子排布式
(2)基态Fe2+与Fe3+离子中未成对的电子数之比为
(3)VIA族元素中O、S、Se的电负性由大到小的顺序为
(4)BF3的空间构型为
(5)元素As与N同族。As的氢化物的沸点比NH3的
更新时间:2023-05-04 23:31:32
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】性质比较:
(1)半径比较Al___________ S、Al3+___________ S2-(填“大于”、“等于”或“小于”,下同)
(2)第一电离能比较Mg___________ Al,解释原因___________
(3)稳定性比较NH3、H2O、HF,___________ ,解释原因___________
(4)酸性强弱比较HClO4、HClO3___________ ,解释原因___________
(1)半径比较Al
(2)第一电离能比较Mg
(3)稳定性比较NH3、H2O、HF,
(4)酸性强弱比较HClO4、HClO3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】下表为元素周期表的一部分,请参照元素①—⑧在表中的位置,用化学用语回答下列问题:

(1)②在元素周期表中的位置是______________________ 。
(2)②的最简单氢化物分子的空间结构呈___________ ,③的单质的结构式为___________ ,③、⑤两种元素形成的既含离子键又含非极性共价键的化合物的电子式为___________ 。
(3)④、⑤、⑥的简单离子半径由大到小的顺序为______________________ 。(填离子符号)。
(4)②、⑥、⑦的最高价氧化物的水化物的酸性由强到弱的顺序是___________ (填化学式)。
(5)⑤、⑥的最高价氧化物的水化物相互反应的离子方程式为___________ 。

(1)②在元素周期表中的位置是
(2)②的最简单氢化物分子的空间结构呈
(3)④、⑤、⑥的简单离子半径由大到小的顺序为
(4)②、⑥、⑦的最高价氧化物的水化物的酸性由强到弱的顺序是
(5)⑤、⑥的最高价氧化物的水化物相互反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表列出了A-R九种元素在元素周期表中的位置,试用元素符号或化学式回答下列问题:
(1)B的离子结构示意图为___________ ,AD两最高价氧化物对应的的水化物反应的离子方程式是___________ 。
(2)在AC、D、F这些元素形成的最简单离子中,离子半径由大到小的顺序是___________ (填离子符号),AC、D最高价氧化物对应水化物的碱性由强到弱为___________ 。
(3)由元素AF形成的一种杀菌消毒剂中存在的化学键有___________ 。
(4)由元素E和G形成的某种化合物可表示为 (其中各原子均满足8电子稳定结构),写出
(其中各原子均满足8电子稳定结构),写出 的电子式:
的电子式:___________ 。
(5)已知常温下氯酸钾与浓盐酸反应放出气体 ,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
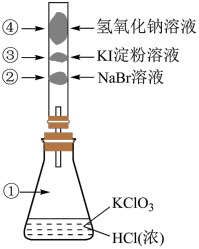
(6)G元素和H元素两者核电荷数之差是___________ 。
周期 主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | F | |||||||
| 3 | A | C | D | E | G | R | ||
| 4 | B | H |
(1)B的离子结构示意图为
(2)在AC、D、F这些元素形成的最简单离子中,离子半径由大到小的顺序是
(3)由元素AF形成的一种杀菌消毒剂中存在的化学键有
(4)由元素E和G形成的某种化合物可表示为
 (其中各原子均满足8电子稳定结构),写出
(其中各原子均满足8电子稳定结构),写出 的电子式:
的电子式:(5)已知常温下氯酸钾与浓盐酸反应放出气体
 ,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
,现按如图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是___________。
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 无色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 白色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氯吡苯脲是一种常用的膨大剂,其结构简式为 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为______ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:

反应过程中,每生成1mol氯吡苯脲,断裂_____ mol σ 键,断裂_____ mol π 键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。请用共价键知识解释H2O分子比NH3分子稳定的原因为________ 。
 ,它是经国家批准使用的植物生长调节剂。
,它是经国家批准使用的植物生长调节剂。(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如下:

反应过程中,每生成1mol氯吡苯脲,断裂
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。请用共价键知识解释H2O分子比NH3分子稳定的原因为
您最近一年使用:0次
【推荐2】如图是s能级和p能级的原子轨道图。

试回答下列问题:
(1)s电子的原子轨道呈_______ 形,每个s能级有_______ 个原子轨道;p电子的原子轨道呈_______ 形,每个p能级有_______ 个原子轨道。
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是_______ 电子,其电子云在空间有3个互相_______ (填“垂直”或“平行”)的伸展方向。元素X的名称是_______ ,它的最低价氢化物的电子式是_______ 。
(3)元素Y的原子最外层电子排布式为nsn-1npn+1,Y的元素符号为_______ ,原子的核外电子排布式为_______ 。
(4)下列电子排布图中,能正确表示元素X的原子处于最低能量状态的是_______。

试回答下列问题:
(1)s电子的原子轨道呈
(2)元素X的原子最外层电子排布式为nsnnpn+1,原子中能量最高的是
(3)元素Y的原子最外层电子排布式为nsn-1npn+1,Y的元素符号为
(4)下列电子排布图中,能正确表示元素X的原子处于最低能量状态的是_______。
A.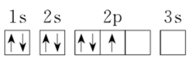 | B.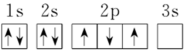 |
C. | D. |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)①基态Cu原子有___________ 种不同能级的电子。
②N原子中最高能级的电子的电子云轮廓图为___________ 。
③在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2)元素X位于第4周期,其基态原子有4个未成对电子,基态 的价电子排布式是
的价电子排布式是___________ ; 的价电子排布式为
的价电子排布式为___________ 。
(3)M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,M元素基态原子的电子排布式为___________ , 的价电子排布式为
的价电子排布式为___________ ,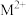 的电子排布式为
的电子排布式为___________ 。
(4)2019年《Science》杂志报道了制取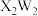 的绿色方法,原理如图所示。
的绿色方法,原理如图所示。

①X膜为选择性___________ 离子交换膜(填“阴”、“阳”)。
②每生成1mol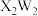 电极上流过
电极上流过___________ mol 。
。
③用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阴极可能的电极反应式:___________ 。
(1)①基态Cu原子有
②N原子中最高能级的电子的电子云轮廓图为
③在空气中FeO稳定性小于
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)元素X位于第4周期,其基态原子有4个未成对电子,基态
 的价电子排布式是
的价电子排布式是 的价电子排布式为
的价电子排布式为(3)M是第4周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子,M元素基态原子的电子排布式为
 的价电子排布式为
的价电子排布式为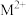 的电子排布式为
的电子排布式为(4)2019年《Science》杂志报道了制取
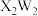 的绿色方法,原理如图所示。
的绿色方法,原理如图所示。
①X膜为选择性
②每生成1mol
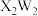 电极上流过
电极上流过 。
。③用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阴极可能的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】请查阅化合物HCl、NO、MgO、KCl中元素的电负性数值,判断_______ 是离子化合物,_______ 是共价化合物。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】光伏材料是指能将太阳能直接转换成电能的材料,光伏材料又称太阳能材料,只有半导体材料具有这种功能。硅(Si)、镓(Ga)、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)硅能形成与烷烃类似的硅烷,写出乙硅烷的电子式:___________ 。硅烷很难像烷烃一样形成长链,这是因为硅的原子半径___________ (填“大于”“小于”或“等于”)碳的原子半径,因此键长___________ (填“长”或“短”),键能小。丁硅烯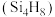 中
中 键与
键与 键的个数比为
键的个数比为___________ 。
(2)我国航天事业发展迅猛,太阳能电池材料使用的是砷化镓(GaAs)。基态砷原子中电子占据的最高能层符号是___________ 。
(3)光催化还原 制备
制备 的反应中,带状纳米
的反应中,带状纳米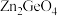 是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是___________ 。
(4)硅和锗都能与氯元素形成四氯化物 和
和 ,从原子结构角度解释原因:
,从原子结构角度解释原因:___________ 。
(5)太阳能电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因:___________ 。
(1)硅能形成与烷烃类似的硅烷,写出乙硅烷的电子式:
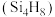 中
中 键与
键与 键的个数比为
键的个数比为(2)我国航天事业发展迅猛,太阳能电池材料使用的是砷化镓(GaAs)。基态砷原子中电子占据的最高能层符号是
(3)光催化还原
 制备
制备 的反应中,带状纳米
的反应中,带状纳米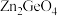 是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是
是该反应的良好催化剂。Zn、Ge、O电负性由大到小的顺序是(4)硅和锗都能与氯元素形成四氯化物
 和
和 ,从原子结构角度解释原因:
,从原子结构角度解释原因:(5)太阳能电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】现有①H2O2;②CO2;③NH3; ④Ba(OH)2 四种物质,回答下列问题:
(1)属于离子化合物的是_______ (填编号,下同); 属于共价化合物且中心原子杂化类型为sp3杂化的是_______ ,其中分子空间构型为三角锥形的是_______ 。
(2)含有非极性键的是_______ (填编号,下同);既有σ键又有π键的是_______ 。
(3)Ba(OH)2中第一电离能最小的元素是_______ (填元素符号)。 .
(4)上述四种物质中涉及的所有元素的电负性由大到小顺序排列为_______ 。
(5)写出下列物质的电子式:N2________ ;H2O2________ ;NaOH________ 。
(1)属于离子化合物的是
(2)含有非极性键的是
(3)Ba(OH)2中第一电离能最小的元素是
(4)上述四种物质中涉及的所有元素的电负性由大到小顺序排列为
(5)写出下列物质的电子式:N2
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】元素及其化合物在生活及生产中有很多重要用途。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为__ 。(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__ 。
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式__ 。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)拟卤素如(CN)2、(SCN)2、(OCN)2等与卤素单质结构相似、性质相近。已知(CN)2分子中所有原子都满足8电子稳定结构,则其分子中σ键与π键数目之比为
(2)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】钛被称为继铁、铝之后的“第三金属”,一种制备金属钛的工艺流程如下所示。

(1)Ti在元素周期表的位置为_______ ;下列基态或激发态Ti原子价电子排布图中,能量最高的是_______ 。
A.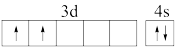
B.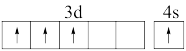
C.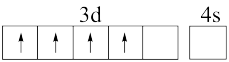
(2)已知 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ,沸点为
,沸点为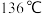 ,结构与
,结构与 相似,
相似, 的晶体类型是
的晶体类型是_______ 。 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因_______ 。
(3)纳米 是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
是一种应用广泛的催化剂,其催化作用的一个实例如下所示:

化合物甲中采取 杂化的原子有
杂化的原子有_______ (填元素符号)。化合物乙的沸点明显高于化合物甲,主要原因是_______ 。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子的化学式为_______ 。

(1)Ti在元素周期表的位置为
A.

B.

C.

(2)已知
 在通常情况下是无色液体,熔点为
在通常情况下是无色液体,熔点为 ,沸点为
,沸点为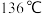 ,结构与
,结构与 相似,
相似, 的晶体类型是
的晶体类型是 稳定性比
稳定性比 差,试从化学键角度分析原因
差,试从化学键角度分析原因(3)纳米
 是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
化合物甲中采取
 杂化的原子有
杂化的原子有(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子的化学式为
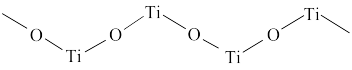
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮、磷、硫、氯的化合物种类繁多,应用广泛。
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是______ 。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、共价键和_____ 。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____ 。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是____ 。
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是____ ,该分子属于___ (填“极性分子”或“非极性分子”)。
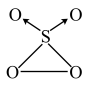
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、共价键和
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为
②H2O2常温下是液体,沸点较高(150℃),其主要原因是
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是

您最近一年使用:0次



