回答下列问题:
(1)常温下,0.010mol•L-1的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示。H2A分两步电离,对应的电离平衡常数分别为Ka1和Ka2。
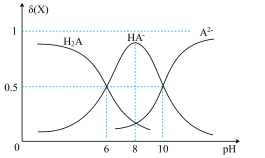
①由图确定下列数据:-lgKa1=______ ,Ka2=_____ 。
②将0.020mol•L-1的Na2A溶液和0.010mol•L-1的盐酸等体积混合,所得溶液的pH约为_____ 。
(2)已知部分弱酸的电离常数如表:
①25℃时,0.1mol•L-1的HCOONa溶液和0.1mol•L-1的Na2CO3溶液中,c(HCOO-)_____ c(CO )(填>、<、=)。
)(填>、<、=)。
②25℃时,一定浓度的HCOONa溶液的pH=9,该溶液呈碱性的原因______ (用离子方程式表示)。
③将少量CO2通入苯酚钠溶液中,发生反应的离子方程式是______ 。
(1)常温下,0.010mol•L-1的二元酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH变化如图所示。H2A分两步电离,对应的电离平衡常数分别为Ka1和Ka2。

①由图确定下列数据:-lgKa1=
②将0.020mol•L-1的Na2A溶液和0.010mol•L-1的盐酸等体积混合,所得溶液的pH约为
(2)已知部分弱酸的电离常数如表:
| 弱酸 | HCOOH | 苯酚 | H2CO3 |
| 电离常数(25℃) | Ka=1.77×10-4 | Ka=1.771×10-10 | Ka1=4.2×10-7 Ka2=5.6×10-11 |
 )(填>、<、=)。
)(填>、<、=)。②25℃时,一定浓度的HCOONa溶液的pH=9,该溶液呈碱性的原因
③将少量CO2通入苯酚钠溶液中,发生反应的离子方程式是
更新时间:2023-05-24 08:23:54
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,有浓度均为0.1mol·L-1的下列6种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
(1)溶液③pH=10的原因是_______ (用离子方程式表示,下同);溶液④pH=11的原因是_______ 。
(2)溶液①中各离子浓度由大到小的顺序是_______ 。
(3)溶液①和③相比较,pH (NaCN)_______ pH (CH3COONa) (填“>”“<”或“=”)。
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=___ 。
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是_______ 。
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈_______ 性。(填“酸”“碱”或“中”)
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
| HCN | H2CO3 | CH3COOH |
| Ka=4.9×10-10 | Ka1=4×10-7 Ka2=5.6×10-11 | Ka=1.7×10-5 |
(2)溶液①中各离子浓度由大到小的顺序是
(3)溶液①和③相比较,pH (NaCN)
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2=
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】已知常温下部分弱电解质的电离平衡常数如下表(已知lg2=0.3):
(1)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性___________ (填“酸性”“碱性”“中性”)。
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应后溶液呈中性,用含a的代数式表示NH3·H2O的电离平衡常数Kb___________ 。
(3)CO2可以被NaOH溶液捕获。若所得溶液中c(CO )=c(H2CO3)时,则溶液的pH=
)=c(H2CO3)时,则溶液的pH=______ 。
(4)含H2S的尾气用足量的Na2CO3溶液来吸收,写出离子方程式:___________ 。
(5)已知100℃下,Kw=10-12.将pH11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则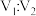 =
=___________ 。
(6)常温下,向0.1mol/LH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。请计算:

①当溶液中c(S2-)=1.4×10-19mol/L溶液时,水电离产生的c(H+)___________ mol/L。
②当pH=13时,溶液中c(H2S)+c(HS-)=___________ mol/L。
| 化学式 | H2S | HClO | H2CO3 |
| 电离常数 | K1=9.1×10-8 K2=1.1×10-12 | 4.7×10-8 | K1=4×10-7 K2=5×10-11 |
(1)常温下,0.1mol/L的HClO溶液和0.1mol/L的NaClO溶液等体积混合,判断混合溶液的酸碱性
(2)25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应后溶液呈中性,用含a的代数式表示NH3·H2O的电离平衡常数Kb
(3)CO2可以被NaOH溶液捕获。若所得溶液中c(CO
 )=c(H2CO3)时,则溶液的pH=
)=c(H2CO3)时,则溶液的pH=(4)含H2S的尾气用足量的Na2CO3溶液来吸收,写出离子方程式:
(5)已知100℃下,Kw=10-12.将pH11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
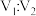 =
=(6)常温下,向0.1mol/LH2S溶液中通入HCl气体或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。请计算:

①当溶液中c(S2-)=1.4×10-19mol/L溶液时,水电离产生的c(H+)
②当pH=13时,溶液中c(H2S)+c(HS-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,Ka_____ (填“增大”、“减小”或“不变”).
(2)下列四种离子结合质子能力由大到小的顺序是__________ (填序号);
a. CO32- b. ClO- c. CH3COO- d. HCO3-
(3)下列反应不能发生的是______ (填序号)
a. CO32-+CH3COOH=CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是______ (填序号);
a. b. c. d.
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数________ (填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)________ 醋酸溶液中水电离出来的c(H+),理由是___________________ ;
(6)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=_____ mol·L-1(填精确数值)。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka
(2)下列四种离子结合质子能力由大到小的顺序是
a. CO32- b. ClO- c. CH3COO- d. HCO3-
(3)下列反应不能发生的是
a. CO32-+CH3COOH=CH3COO-+CO2↑+H2O b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO- d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是
a. b. c. d.
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数
(6)25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】认识和运用水溶液中的离子反应及其平衡原理,有助于指导工农业生产和科学研究。
(1)已知室温下:
①0.1mol/LNa2CO3溶液的pH_______ (填“>”“<”或“=”)0.1mol/LNa2C2O4溶液的pH。
②将等浓度H2C2O4溶液和H2CO3溶液等体积混合,溶液中各种粒子浓度顺序正确的是______ 。
A.c(H+)>c(HC2O )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)
B.c(HCO )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
C.c(H+)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)
D.c(H2CO3)>c(HCO )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)
(2)向Na2CO3溶液中滴加少量H2C2O4溶液,写出发生反应的离子方程式:______ 。
(1)已知室温下:
| 化学式 | H2CO3 | H2C2O4 |
| 电离常数 | Ka1=4.2×10-7 Ka2=4.8×10-11 | Ka1=5.6×10-2 Ka2=5.4×10-3 |
②将等浓度H2C2O4溶液和H2CO3溶液等体积混合,溶液中各种粒子浓度顺序正确的是
A.c(H+)>c(HC2O
 )>c(HCO
)>c(HCO )>c(CO
)>c(CO )
)B.c(HCO
 )>c(HC2O
)>c(HC2O )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)C.c(H+)>c(HC2O
 )>c(C2O
)>c(C2O )>c(CO
)>c(CO )
)D.c(H2CO3)>c(HCO
 )>c(HC2O
)>c(HC2O )>c(CO
)>c(CO )
)(2)向Na2CO3溶液中滴加少量H2C2O4溶液,写出发生反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:
(1)浓度均为0.1mol/L的下列四种溶液,pH由小到大排列的顺序是___________ (填标号)。
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是___________ (填标号)。
A.c(H+) B. C.
C. D.
D. E.
E.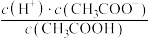
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸___________ 盐酸(填“>”、“<”或“=”)。
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =___________ 。
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈___________ (填标号)。
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为___________ (忽略溶液混合时体积的变化)。
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为___________ 。
| CH3COOH | H2CO3 | HClO | H2C2O4 | NH3·H2O | |
| 电离平衡常数 (25℃) |  |   | Ka= | Ka1=5.6×10-2 Ka2=5.4×10-5 |  |
A.CH3COONa B.Na2CO3 C.NaClO D.NaHCO3
(2)①0.1mol/L CH3COOH溶液加水稀释过程中,下列数据变大的是
A.c(H+) B.
 C.
C. D.
D. E.
E.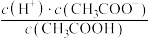
②25℃时,将pH=2的醋酸和盐酸各1mL分别加水稀释至100mL,稀释后溶液中水的电离程度:
醋酸
③25℃时,a mol/L CH3COOH溶液与b mol/L NaOH溶液等体积混合,反应后溶液恰好显中性,用含a、b的代数式表示CH3COOH的电离平衡常数Ka =
④向10 mL浓度为0.01mol/L的H2C2O4溶液中加入5 mL 0.02 mol/L的NaOH溶液,充分反应后溶液呈
a.酸性 b.碱性 c.中性
(3)25℃时,pH=4和pH=11的强酸和强碱混合后溶液pH=10,则酸、碱溶液的体积比为
(4)将少量CO2通入NaClO溶液发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氨水又称阿摩尼亚水,指氨的水溶液。已知25℃时氨水的电离平衡常数为1.8×10-5。回答下列问题:
(1)25℃时,物质的量浓度为0.10 mol/L的氨水中,c(OH-)为_______ mol/L(保留3个有效数字)。
(2)用硫酸滴定氨水,可选择_______ 作为指示剂,判定滴定终点的现象为最后半滴硫酸滴下溶液由_______ 色变为_______ 色,且半分钟内不变色。
(3)若向氨水中加入少量硫酸铵固体,则溶液中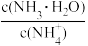 将
将_______ (填“增大”、“减小”或“不变”),电荷守恒关系为_______ 。
(4)若向0.10 mol/L的氨水中加入等体积的0.05mol/L的硫酸铵溶液,则此时溶液显_______ (填“酸性”、“碱性” 或“中性”),请结合平衡常数说明原因_______ 。
(1)25℃时,物质的量浓度为0.10 mol/L的氨水中,c(OH-)为
(2)用硫酸滴定氨水,可选择
(3)若向氨水中加入少量硫酸铵固体,则溶液中
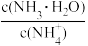 将
将(4)若向0.10 mol/L的氨水中加入等体积的0.05mol/L的硫酸铵溶液,则此时溶液显
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】按要求填空:
(1)羟基的电子式是__________________________
(2)苯酚钠溶液中通入CO2的化学方程式:__________________________
(3)苯乙烯与溴的四氯化碳溶液的反应方程式:________________________
(1)羟基的电子式是
(2)苯酚钠溶液中通入CO2的化学方程式:
(3)苯乙烯与溴的四氯化碳溶液的反应方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】I.在①苯 ②苯酚 ③甲苯 ④氯乙烷 ⑤乙烯 ⑥乙醇中,(填编号)
(1)能和金属钠反应放出H2的有_______________
(2)能与NaOH溶液反应的有_______________
(3)常温下能与溴水反应的有_______________
(4)能使酸性KMnO4溶液褪色的烃有_______________
II.已知1-丁烯A发生如下反应,F的核磁共振氢谱有三种吸收峰,

(1)A分子内所含官能团的名称____________ 。
(2)写出下列反应的化学方程式:
①A→D___________________ 。
②E→F___________________ 。
(3)由A的官能团位置异构的同分异构体G生成1,4-丁二醇需______ 步,请写出最后一步反应的化学方程式_______________________ 。
(1)能和金属钠反应放出H2的有
(2)能与NaOH溶液反应的有
(3)常温下能与溴水反应的有
(4)能使酸性KMnO4溶液褪色的烃有
II.已知1-丁烯A发生如下反应,F的核磁共振氢谱有三种吸收峰,

(1)A分子内所含官能团的名称
(2)写出下列反应的化学方程式:
①A→D
②E→F
(3)由A的官能团位置异构的同分异构体G生成1,4-丁二醇需
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】按要求填空:
(1)下列分子中含有手性碳的是_______。
(2)下列分子具有极性的是_______ 。
A.CCl4 B.NH3 C.H2O D.CS2 E.BF3
(3)氮、氧两种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:_______ 、_______ 。
(4)乙酸乙酯在碱性条件下水解的化学方程式_______ 。
(5)向苯酚钠溶液中通入少量二氧化碳的离子方程式_______ 。
(6)化合物Fe(CO)5中,与Fe直接结合的原子是C而不是O的可能原因是:_______ 。Fe元素可形成 和
和 ,其中较稳定的是
,其中较稳定的是 ,其原因是:
,其原因是:_______ 。
(1)下列分子中含有手性碳的是_______。
| A.乙醇 | B.乙醛 | C.一氯甲烷 | D.乳酸CH3CH(OH)COOH |
A.CCl4 B.NH3 C.H2O D.CS2 E.BF3
(3)氮、氧两种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)乙酸乙酯在碱性条件下水解的化学方程式
(5)向苯酚钠溶液中通入少量二氧化碳的离子方程式
(6)化合物Fe(CO)5中,与Fe直接结合的原子是C而不是O的可能原因是:
 和
和 ,其中较稳定的是
,其中较稳定的是 ,其原因是:
,其原因是:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为________ (写离子符号);若所得溶液c(HCO3-)∶c(CO32-)=2∶1,溶液pH=__________ 。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=________________ mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________________ 。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为________ mol·L-1,此时溶液中c(CrO )等于
)等于__________ mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为
(2)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)=
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为 )等于
)等于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求填空:
(1)①写出下列物质在水中的电离方程式:
NH4HSO3_____ ;
H3PO4_____ 。
②HClO4、H2SO4、HCl、HNO3都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是_____ 。
A.温度不会影响这四种酸在冰酸中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4=2H++SO
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)在水的电离平衡中,c(H+)和(OH﹣)的关系如图所示:

①100℃时,向1L水中加入0.1molNaOH(s),所得溶液的pH=_____ 。
②25℃时,若盐酸中c(H+)=5×10﹣4mol/L,则由水电离产生的c(H+)=_____ 。
③25℃时,若0.015mol/LH2SO4溶液与pH=12NaOH溶液等积混合(混合后体积变化不计),混合后的pH为_____ 。
(1)①写出下列物质在水中的电离方程式:
NH4HSO3
H3PO4
②HClO4、H2SO4、HCl、HNO3都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10﹣5 | Ka1=6.3×10﹣9 | 1.6×10﹣9 | 4.2×10﹣10 |
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4=2H++SO

D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)在水的电离平衡中,c(H+)和(OH﹣)的关系如图所示:

①100℃时,向1L水中加入0.1molNaOH(s),所得溶液的pH=
②25℃时,若盐酸中c(H+)=5×10﹣4mol/L,则由水电离产生的c(H+)=
③25℃时,若0.015mol/LH2SO4溶液与pH=12NaOH溶液等积混合(混合后体积变化不计),混合后的pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】常温下,部分酸的电离常数如表所示:
回答下列问题:
(1) 相同的三种酸,其酸的浓度由大到小的顺序为
相同的三种酸,其酸的浓度由大到小的顺序为_______ 。
(2)若HCN的起始浓度为0.01 mol⋅L ,平衡时
,平衡时 约为
约为_______ mol⋅L 。若使此溶液中HCN的电离程度增大且
。若使此溶液中HCN的电离程度增大且 也增大的方法是
也增大的方法是_______ 。
(3)25℃时,0.1 mol⋅L 的HA溶液中测得
的HA溶液中测得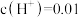 mol⋅L
mol⋅L ,则:
,则:
①HA是_______ (填“强电解质”或“弱电解质”)。
②HA的电离方程式为_______ 。写出该电离平衡常数表达式:_______ 。
③25℃时,当向HA中加入一定量的盐酸时,HA的电离平衡常数是否变化?_______ (填“变大”“变小”或“不变”),说明原因:_______ 。
| 化学式 | HF | HCN |  |
| 电离常数 | 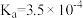 | 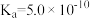 | 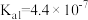 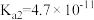 |
(1)
 相同的三种酸,其酸的浓度由大到小的顺序为
相同的三种酸,其酸的浓度由大到小的顺序为(2)若HCN的起始浓度为0.01 mol⋅L
 ,平衡时
,平衡时 约为
约为 。若使此溶液中HCN的电离程度增大且
。若使此溶液中HCN的电离程度增大且 也增大的方法是
也增大的方法是(3)25℃时,0.1 mol⋅L
 的HA溶液中测得
的HA溶液中测得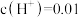 mol⋅L
mol⋅L ,则:
,则:①HA是
②HA的电离方程式为
③25℃时,当向HA中加入一定量的盐酸时,HA的电离平衡常数是否变化?
您最近一年使用:0次



