实验室用密度为1.18 g/mL、质量分数为36.5%的浓盐酸配制250 mL0.2 mol/L的盐酸。请回答下列问题:
(1)配制250 mL0.2 mol/L的盐酸
(2)配制时,其正确的操作顺序是_____ (用字母表示,每个字母只能用一次)。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_____ 。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
①若没有进行A操作_____ ;
②若定容时俯视刻度线_____ 。
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面:_____ 。
(1)配制250 mL0.2 mol/L的盐酸
| 应量取盐酸的体积/mL | 应选用容量瓶的规格/mL | 除量筒、容量瓶、烧杯外还需的其他仪器 |
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
①若没有进行A操作
②若定容时俯视刻度线
(5)若实验过程中出现如下情况如何处理?
向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面:
2023高一下·天津和平·学业考试 查看更多[2]
更新时间:2023-06-27 13:30:59
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某校化学兴趣小组设计了如图装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(已知该反应为放热反应)。
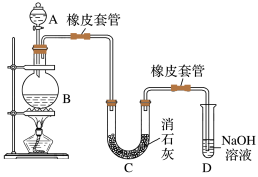
(1)装置A中所用溶液浓度为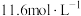 ,现欲用其配制100mL
,现欲用其配制100mL 的稀溶液。则需量取
的稀溶液。则需量取_______ mL浓溶液,量取所用量筒的规格是_______ (填“10mL”“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是_______ 。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.仰视定容
(2)仪器A的名称为_______ ,D的作用为_______ 。
(3)结果实验所得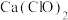 产率太低。经查阅资料发现主要原因是U形管中存在两个反应。温度较高时氯气与消石灰反应生成了
产率太低。经查阅资料发现主要原因是U形管中存在两个反应。温度较高时氯气与消石灰反应生成了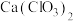 ,该反应方程式为
,该反应方程式为_______ ,为避免该反应的发生可采取的措施是_______ 。
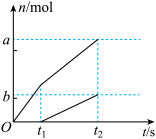
(4)向含1.0mol 的潮湿消石灰中通入足量氯气,若反应后测得产物中
的潮湿消石灰中通入足量氯气,若反应后测得产物中 的物质的量为1.2mol,溶液中
的物质的量为1.2mol,溶液中 、
、 两种物质的物质的量(n)与反应时间(t)的关系曲线表示为如图(不考虑氯气和水及其他副反应)。则图中
两种物质的物质的量(n)与反应时间(t)的关系曲线表示为如图(不考虑氯气和水及其他副反应)。则图中
_______ 。

(1)装置A中所用溶液浓度为
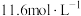 ,现欲用其配制100mL
,现欲用其配制100mL 的稀溶液。则需量取
的稀溶液。则需量取A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.仰视定容
(2)仪器A的名称为
(3)结果实验所得
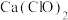 产率太低。经查阅资料发现主要原因是U形管中存在两个反应。温度较高时氯气与消石灰反应生成了
产率太低。经查阅资料发现主要原因是U形管中存在两个反应。温度较高时氯气与消石灰反应生成了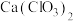 ,该反应方程式为
,该反应方程式为(4)向含1.0mol
 的潮湿消石灰中通入足量氯气,若反应后测得产物中
的潮湿消石灰中通入足量氯气,若反应后测得产物中 的物质的量为1.2mol,溶液中
的物质的量为1.2mol,溶液中 、
、 两种物质的物质的量(n)与反应时间(t)的关系曲线表示为如图(不考虑氯气和水及其他副反应)。则图中
两种物质的物质的量(n)与反应时间(t)的关系曲线表示为如图(不考虑氯气和水及其他副反应)。则图中

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】生活中处处有化学。
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。
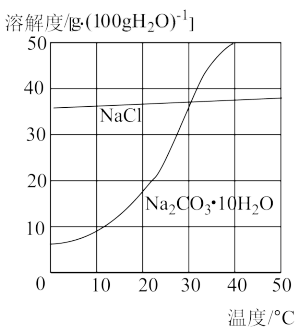
(1)“夏天晒盐”相当于实验室的_______ 法,“冬天捞碱”相当于实验室的_______ 法。
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是_______ 。
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是_______ 。如果不进行纠正,会造成所配溶液的浓度_______ (填“偏高”、“偏低”、“不影响”)
(4)填写实验单中所用仪器的名称:(A)_______ ;(B)_______ ;(C)_______ ;(D)_______ 。
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。按先后顺序 ,说明(B)在实验中的作用:_______ ,_______ 。
(6)实验单中“(_______)”的内容应该是_______ 。
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为_______ (保留三位有效数字)。
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=_______ 。(保留三位有效数字)
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。

(1)“夏天晒盐”相当于实验室的
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是
(4)填写实验单中所用仪器的名称:(A)
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。
(6)实验单中“(_______)”的内容应该是
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】用18.4 mol·L-1的浓硫酸,配制100 mL 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4 mol·L-1的浓硫酸__________ mL;
(2)配制时不需要用到的仪器有__________ (填仪器的标号);
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.250 mL容量瓶 F.100 mL容量瓶 G.胶头滴管 H.铁架台(带铁夹) I.玻璃棒
(3)下列实验步骤中,正确的操作顺序应该是__________ 。
A.用量筒量取浓硫酸后,缓缓倒入装有约50 mL 蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30 mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次的洗涤液都倒入容量瓶中
C.将稀释后的硫酸小心地倒入容量瓶中
D.检查100 mL容量瓶瓶口是否有漏液现象
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(4)进行A步操作的时候,应该选用__________ mL量筒。如果对装有浓硫酸的量筒读数如图所示,配制的稀硫酸的浓度将__________ (填“偏高”“偏低”或“无影响”)。
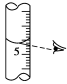
(5)进行A步操作后,必须_________ 后,才能进行C步操作。
(1)需要18.4 mol·L-1的浓硫酸
(2)配制时不需要用到的仪器有
A.托盘天平 B.烧杯 C.量筒 D.烧瓶 E.250 mL容量瓶 F.100 mL容量瓶 G.胶头滴管 H.铁架台(带铁夹) I.玻璃棒
(3)下列实验步骤中,正确的操作顺序应该是
A.用量筒量取浓硫酸后,缓缓倒入装有约50 mL 蒸馏水的烧杯里,并用玻璃棒搅拌
B.用约30 mL蒸馏水,分三次洗涤烧杯和玻璃棒,将每次的洗涤液都倒入容量瓶中
C.将稀释后的硫酸小心地倒入容量瓶中
D.检查100 mL容量瓶瓶口是否有漏液现象
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(4)进行A步操作的时候,应该选用

(5)进行A步操作后,必须
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某化学研究性学习小组欲配制含有 、
、 、
、 、
、 的植物培养液450mL,且要求该培养液中
的植物培养液450mL,且要求该培养液中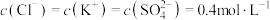 '。实验室提供的药品有:
'。实验室提供的药品有: 、KCl、
、KCl、 、
、 和蒸馏水;提供的实验仪器有:①药匙、②烧杯、③玻璃棒、④胶头滴管、⑤量筒、⑥称量纸。请回答下列问题:
和蒸馏水;提供的实验仪器有:①药匙、②烧杯、③玻璃棒、④胶头滴管、⑤量筒、⑥称量纸。请回答下列问题:
(1)该植物培养液中, 的物质的量浓度为
的物质的量浓度为_________ 。
(2)该研究小组配制该植物培养液时,还须用到的实验仪器有_________ 。
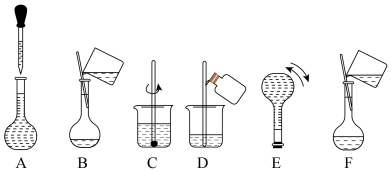
(3)甲同学用KCl和 两种物质进行配制,则需称取
两种物质进行配制,则需称取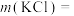
_________ g,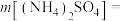
_________ g。
(4)乙同学用所提供药品中的三种进行配制,请帮助该同学选用三种物质:_________ 、_________ 、_________ 。(填化学式)
(5)本实验中玻璃棒的作用有_________ 、_________ 。
(6)请将下列实验步骤按照先后顺序排列:_________ 。
(7)请用恰当的文字描述上图A操作的过程:_________ 。
(8)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是_________ (填字母)。
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
c.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
 、
、 、
、 、
、 的植物培养液450mL,且要求该培养液中
的植物培养液450mL,且要求该培养液中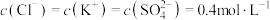 '。实验室提供的药品有:
'。实验室提供的药品有: 、KCl、
、KCl、 、
、 和蒸馏水;提供的实验仪器有:①药匙、②烧杯、③玻璃棒、④胶头滴管、⑤量筒、⑥称量纸。请回答下列问题:
和蒸馏水;提供的实验仪器有:①药匙、②烧杯、③玻璃棒、④胶头滴管、⑤量筒、⑥称量纸。请回答下列问题:(1)该植物培养液中,
 的物质的量浓度为
的物质的量浓度为(2)该研究小组配制该植物培养液时,还须用到的实验仪器有
(3)甲同学用KCl和
 两种物质进行配制,则需称取
两种物质进行配制,则需称取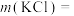
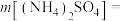
(4)乙同学用所提供药品中的三种进行配制,请帮助该同学选用三种物质:
(5)本实验中玻璃棒的作用有
(6)请将下列实验步骤按照先后顺序排列:

(7)请用恰当的文字描述上图A操作的过程:
(8)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是
a.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
b.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
c.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
d.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学帮助水质检测站配制480mL0.5mol·L-1 NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、______________ 、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为_______ 克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水______________________ 2~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度__________ 处,改用胶头滴管加水,使溶液________________ 。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是__________ (填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水
D.继续往容量瓶内小心加水,直到液面接近刻度
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】用Na2CO3·10H2O晶体,配利0.2 mol/L的Na2CO3溶液480 mL。
(1)本实验用到的仅器除托盘天平、烧杯、量筒外,还需要____ 、_____ 、_____ ;应称取Na2CO3·10H2O晶体的质量。_____________ 。
(2)下列操作中,容量瓶所不具备的功能有_____ 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某浓度的溶液
E.用来加热溶解固体溶质
(3)配制0.2 mol/L的Na2CO3溶液480 mL的主要步骤有:①溶解;②计算;③摇动摇匀;④洗涤;⑤称量;⑥上下颠倒摇匀;⑦_______ 该步骤具体操作方法:____________ 。⑧装瓶;⑨移液。正确的操作顺序是:__________ (填序号)
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水
②用"左码右物"的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
⑥定容摇匀后,发现液面低于刻度线,再加水至刻度
⑦定容时仰视
其中引起所配溶液浓度偏高的有_____ (填序号,下同),偏低的有_____ 。
(1)本实验用到的仅器除托盘天平、烧杯、量筒外,还需要
(2)下列操作中,容量瓶所不具备的功能有
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某浓度的溶液
E.用来加热溶解固体溶质
(3)配制0.2 mol/L的Na2CO3溶液480 mL的主要步骤有:①溶解;②计算;③摇动摇匀;④洗涤;⑤称量;⑥上下颠倒摇匀;⑦
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水
②用"左码右物"的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
⑥定容摇匀后,发现液面低于刻度线,再加水至刻度
⑦定容时仰视
其中引起所配溶液浓度偏高的有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】如图是某学校从化学试剂商店买回来的盐酸试剂标签上的部分内容。
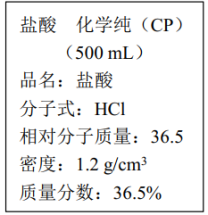
(1)该盐酸的物质的量浓度是___ mol·L-1。
(2)配制250mL3mol·L-1的稀盐酸,操作步骤如下:(浓盐酸溶于水时会放出热量):
①所需实验用品有:烧杯、玻璃棒、100mL量筒、___ 、胶头滴管、空试剂瓶、标签纸
②经计算,需用量筒量取___ mL的该浓盐酸
③将量好的浓盐酸缓慢倒入盛有适量蒸馏水的烧杯中,并不断用玻璃棒搅拌,待___ ,(填写后续实验操作)再用玻璃棒引流至容量瓶中,……
④向上述容量瓶中继续加入蒸馏水……
⑤将配制好的溶液转移至空试剂瓶中,贴好标签
(3)下列实验操作对所配制溶液的浓度是否有影响,请填写“偏大”“偏小”或“无影响”
①量取浓盐酸时俯视刻度线___ 。
②将盐酸转移至空试剂瓶时不小心洒出一些___ 。

(1)该盐酸的物质的量浓度是
(2)配制250mL3mol·L-1的稀盐酸,操作步骤如下:(浓盐酸溶于水时会放出热量):
①所需实验用品有:烧杯、玻璃棒、100mL量筒、
②经计算,需用量筒量取
③将量好的浓盐酸缓慢倒入盛有适量蒸馏水的烧杯中,并不断用玻璃棒搅拌,待
④向上述容量瓶中继续加入蒸馏水……
⑤将配制好的溶液转移至空试剂瓶中,贴好标签
(3)下列实验操作对所配制溶液的浓度是否有影响,请填写“偏大”“偏小”或“无影响”
①量取浓盐酸时俯视刻度线
②将盐酸转移至空试剂瓶时不小心洒出一些
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液 B 升华 C 结晶 D 过滤 E 蒸馏 F 分液
①分离饱和食盐水与沙子的混合物______ ;
②从硝酸钾和氯化钠的混合液中获得硝酸钾______ ;
③从碘水中提取碘单质______ ;
④分离水和汽油的混合物______ ;
⑤分离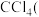 沸点为
沸点为 和甲苯
和甲苯 沸点为
沸点为 的混合物
的混合物______ 。
(2)0.4 mol某气体的体积为9.8L,则该气体的气体摩尔体积为_____ 。
(3)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为___ 。
(4)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应用托盘天平称取Na2CO3·10H2O的质量是____ 。
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7mol AOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100ml浓度为1.2mol/L的盐酸,则AOH的摩尔质量为_____ 。
(6)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要用量筒量取____ mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是____ (填序号)。
a 用量筒量取浓盐酸时俯视观察凹液面
b 将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c 稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e 容量瓶洗涤干净后未干燥
A 萃取分液 B 升华 C 结晶 D 过滤 E 蒸馏 F 分液
①分离饱和食盐水与沙子的混合物
②从硝酸钾和氯化钠的混合液中获得硝酸钾
③从碘水中提取碘单质
④分离水和汽油的混合物
⑤分离
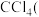 沸点为
沸点为 和甲苯
和甲苯 沸点为
沸点为 的混合物
的混合物(2)0.4 mol某气体的体积为9.8L,则该气体的气体摩尔体积为
(3)标准状况下,测得1.92克某气体的体积为672mL,则此气体的相对分子质量为
(4)实验室用Na2CO3·10H2O晶体配制0. 5mol/L的Na2CO3溶液970mL,应用托盘天平称取Na2CO3·10H2O的质量是
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7mol AOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100ml浓度为1.2mol/L的盐酸,则AOH的摩尔质量为
(6)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要用量筒量取
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是
a 用量筒量取浓盐酸时俯视观察凹液面
b 将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c 稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e 容量瓶洗涤干净后未干燥
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】按要求回答下列问题:
(1)实验室中需要配制2mol·L-1的NaOH溶液950mL,配制时应选用的容量瓶的规格是_______ ,用托盘天平称取NaOH的质量是_______ 。
(2)现用98%的浓H2SO4(ρ=1.84g/cm3)配制浓度为1.84mol·L-1的稀硫酸500mL。
①需用量筒浓H2SO4的体积为_______ mL。
②配制过程中正确的操作顺序为_______ (填选项字母)。
a.量取浓H2SO4 b.反复颠倒摇匀 c.加水定容 d.稀释浓H2SO4并冷却 e.洗涤所用仪器并将洗涤液转入容量瓶 f.将稀释溶液转入容量瓶
③分析下列操作对所配硫酸浓度的影响,选填“偏高”、“偏低”或“无影响”。在转入容量瓶前烧杯中的液体未冷却将使所配溶液浓度_______ ;定容时仰视容量瓶刻度线将使所配溶液浓度_______ 。
(1)实验室中需要配制2mol·L-1的NaOH溶液950mL,配制时应选用的容量瓶的规格是
(2)现用98%的浓H2SO4(ρ=1.84g/cm3)配制浓度为1.84mol·L-1的稀硫酸500mL。
①需用量筒浓H2SO4的体积为
②配制过程中正确的操作顺序为
a.量取浓H2SO4 b.反复颠倒摇匀 c.加水定容 d.稀释浓H2SO4并冷却 e.洗涤所用仪器并将洗涤液转入容量瓶 f.将稀释溶液转入容量瓶
③分析下列操作对所配硫酸浓度的影响,选填“偏高”、“偏低”或“无影响”。在转入容量瓶前烧杯中的液体未冷却将使所配溶液浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】已知K3[Fe(CN)6]溶液遇 Fe2+生成蓝色沉淀,可检验溶液中的Fe2+。某实验小组测定菠菜和黑木耳中的铁元素。实验如下:
I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:
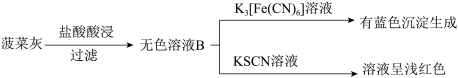
(1)操作i中起分离作用的仪器名称为_______ ;溶液A中未能检测出Fe2+的可能原因是_______ 。
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是_______ 。
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于_______ (填仪器名称)中灼烧。经过一系列操作后配制成100mL待测液。过程中,用到盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)将溶液中Fe3+还原Fe2+,同时产生一种无污染的气体。该反应的离子方程式为_______ ;配制100mL一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、烧杯外还有_______ 。
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)_______ (mg/100g);若以13.93mg/100g 为标准值,则本次实验的相对偏差为_______ 。(保留三位有效数字)

I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:

(1)操作i中起分离作用的仪器名称为
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某同学欲用 固体配制100mL 0.5
固体配制100mL 0.5 的溶液。回答下列问题:
的溶液。回答下列问题:
(1)配制 溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、___________ 。
(2)应用托盘天平称取 固体质量为
固体质量为___________ 。
(3)不规范的操作会引起误差,下列操作会导致实验结果偏高的是___________(填序号)。
 固体配制100mL 0.5
固体配制100mL 0.5 的溶液。回答下列问题:
的溶液。回答下列问题:(1)配制
 溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、
溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、(2)应用托盘天平称取
 固体质量为
固体质量为(3)不规范的操作会引起误差,下列操作会导致实验结果偏高的是___________(填序号)。
| A.溶解过程中有少量液体溅出烧杯外 | B.实验过程中未洗涤烧杯和玻璃棒 |
| C.加水定容时俯视容量瓶的刻度线 | D.容量瓶内壁附有水珠而未干燥处理 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室中经常用酸碱中和滴定的方法测定溶液的浓度。
I.NaOH标准溶液的配制
(1)用托盘天平称取2.0gNaOH固体,加500mL蒸馏水配成溶液,并放置冷却。实验过程中用到的玻璃仪器有量筒、烧杯、___________ 。
(2)现欲测定上述溶液的准确浓度,用准确称取的0.4080g邻苯二甲酸氢钾(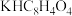 ,摩尔质量为
,摩尔质量为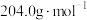 )溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为
)溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为___________  (已知:
(已知: ;计算结果保留4位有效数字,下同)。
;计算结果保留4位有效数字,下同)。
II.若用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴甲基橙溶液;
④用标准液滴定至终点,记下滴定管液面读数;
⑤重复以上滴定操作2~3次。
(3)步骤①存在的错误是___________ 。
(4)步骤③中,量取20.00mL待测液应使用___________ (填标号)。
a.酸式滴定管 b.碱式滴定管 c.量筒
(5)步骤④中,判断到达滴定终点的依据是___________ 。
(6)若步骤①中操作正确,以下是实验数据记录表:
从表中可以看出,第1次滴定记录的NaOH溶液体积明显小于后两次的体积,其可能的原因是___________(填标号)。
(7)根据表中记录数据,通过计算可得盐酸浓度为___________  。
。
I.NaOH标准溶液的配制
(1)用托盘天平称取2.0gNaOH固体,加500mL蒸馏水配成溶液,并放置冷却。实验过程中用到的玻璃仪器有量筒、烧杯、
(2)现欲测定上述溶液的准确浓度,用准确称取的0.4080g邻苯二甲酸氢钾(
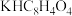 ,摩尔质量为
,摩尔质量为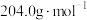 )溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为
)溶于20mL水所得的溶液与该NaOH溶液反应,测得恰好完全反应时消耗该NaOH溶液的体积为20.20mL。则该溶液中NaOH的物质的量浓度为 (已知:
(已知: ;计算结果保留4位有效数字,下同)。
;计算结果保留4位有效数字,下同)。II.若用
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,注入
 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记下读数;
③量取20.00mL待测液注入洁净的锥形瓶中,并加入2滴甲基橙溶液;
④用标准液滴定至终点,记下滴定管液面读数;
⑤重复以上滴定操作2~3次。
(3)步骤①存在的错误是
(4)步骤③中,量取20.00mL待测液应使用
a.酸式滴定管 b.碱式滴定管 c.量筒
(5)步骤④中,判断到达滴定终点的依据是
(6)若步骤①中操作正确,以下是实验数据记录表:
| 滴定次数 | 盐酸体积/mL | NaOH溶液体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 14.10 |
| 2 | 20.00 | 0.00 | 16.20 |
| 3 | 20.00 | 0.00 | 16.22 |
| A.锥形瓶装液前,留有少量蒸馏水 |
| B.取待测液时,有部分液体洒在锥形瓶外壁上 |
| C.滴定前滴定管尖嘴无气泡,滴定结束后有气泡 |
| D.NaOH标准液保存时间过长,有部分变质 |
 。
。
您最近一年使用:0次



