填空。
(1)在一个容积不变的 密闭容器中加入
密闭容器中加入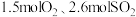 和合适的催化剂,发生反应
和合适的催化剂,发生反应 ,反应温度对
,反应温度对 的平衡转化率[
的平衡转化率[ 的平衡转化率
的平衡转化率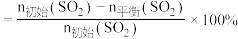 ]和催化剂的催化效率的影响如下图所示。
]和催化剂的催化效率的影响如下图所示。
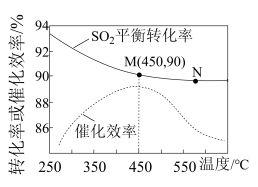
①在催化剂作用下合成 的最佳温度为
的最佳温度为___________ (填标号)。
A.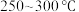 B.
B.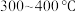 C.
C.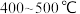
② 时,若经过
时,若经过 反应达到平衡,则
反应达到平衡,则 内用
内用 表示的平均反应速率为
表示的平均反应速率为________ 。
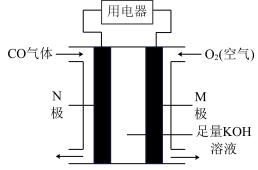
(2)某实验小组结合原电池原理设计了如图所示的燃料电池装置, 极为
极为___________ 极(填“正”或“负”),M极的电极反应式为___________ 。
(3) 气体在一定条件下可被氧气氧化,反应的化学方程式为
气体在一定条件下可被氧气氧化,反应的化学方程式为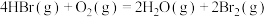 。已知:键能是指气态分子中
。已知:键能是指气态分子中 化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有
化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有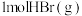 被氧化时,该反应
被氧化时,该反应___________ (填“吸收”或“放出”)的能量为___________ 。
(4)向温度、体积均相同的两个恒容密闭容器中均充入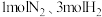 ,在不同催化剂下发生反应:
,在不同催化剂下发生反应: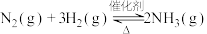 ,测得不同催化剂下氨气浓度随时间的变化如下表所示。
,测得不同催化剂下氨气浓度随时间的变化如下表所示。
对比可知,催化效果较好的是催化剂___________ 除催化剂外,对于该反应,请写出一种加快反应速率的方法:___________ 。
(1)在一个容积不变的
 密闭容器中加入
密闭容器中加入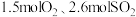 和合适的催化剂,发生反应
和合适的催化剂,发生反应 ,反应温度对
,反应温度对 的平衡转化率[
的平衡转化率[ 的平衡转化率
的平衡转化率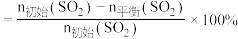 ]和催化剂的催化效率的影响如下图所示。
]和催化剂的催化效率的影响如下图所示。
①在催化剂作用下合成
 的最佳温度为
的最佳温度为A.
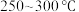 B.
B.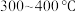 C.
C.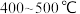
②
 时,若经过
时,若经过 反应达到平衡,则
反应达到平衡,则 内用
内用 表示的平均反应速率为
表示的平均反应速率为(2)某实验小组结合原电池原理设计了如图所示的燃料电池装置,
 极为
极为
(3)
 气体在一定条件下可被氧气氧化,反应的化学方程式为
气体在一定条件下可被氧气氧化,反应的化学方程式为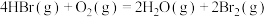 。已知:键能是指气态分子中
。已知:键能是指气态分子中 化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有
化学键断裂成气态原子所吸收的能量,试利用下表中键能数据计算上述反应中有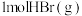 被氧化时,该反应
被氧化时,该反应| 共价键 |  |  |  |  |
键能 | 366 | 498 | 464 | 193 |
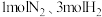 ,在不同催化剂下发生反应:
,在不同催化剂下发生反应: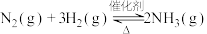 ,测得不同催化剂下氨气浓度随时间的变化如下表所示。
,测得不同催化剂下氨气浓度随时间的变化如下表所示。| 编号 | 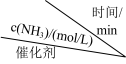 | 0 | 20 | 40 | 60 | 80 |
| ① | 催化剂1 | 0.00 | 0.40 | 0.78 | 1.13 | 1.44 |
| ② | 催化剂2 | 0.00 | 0.20 | 0.38 | 0.54 | 0.67 |
更新时间:2023/07/01 20:41:56
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____ 。部分键能数据如下表所示,△H3=_____ kJ/mol。
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g) 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g) NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
反应I的平衡常数K1和反应II的平衡常数K2的关系是___ 。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___ mol/(L•min),该温度下K2=___ 。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____ (填“正极”或“负极”),生成气体A的电极反应是____ 。

(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____ 。(用化学用语解释)
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=
| 化学键 | N-N | N=N | N N N | H-F | F-F | N-H | N-F |
| 键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)
 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应ⅠNH4AlF4(s)+3F2(g)
 NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ反应I的平衡常数K1和反应II的平衡常数K2的关系是
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的

(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】人类的一切活动都离不开能量,而能量的产生和利用与化学反应中的能量变化密切相关。回答下列问题:
(1)科学研究表明:NF3存储能量的能力是CO2的12000倍左右,在大气中的寿命可达740年,如表所示是断裂或形成1mol化学键时吸收或释放的能量:
则反应N2(g) + 3F2(g) = 2NF3(g) △H =___________ 。
(2)已知常温时红磷比白磷稳定,在下列反应中:
①4P(白磷,s)+5O2(g)=2P2O5(s) △H1 ②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
则有:△H1___________ △H2 (填“>”,“<”,“=”)。
(3)2.6g C2H2(g)在O2中完全燃烧生成CO2和液态水,放出130kJ的热量。写出C2H2燃烧的热化学方程式___________ 。
(4)微生物脱盐电池既可以处理废水中的铵盐,同时又能实现海水的淡化,原理如图所示,其中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。___________ (填“正”或“负”)极;Y离子交换膜为___________ (填“阴”或者“阳”)离子交换膜。
②电极a的电极反应为___________ 。
③若海水脱盐(NaCl)17.55 g,则在两个电极上产生的气体的物质的量总共为___________ mol。
(1)科学研究表明:NF3存储能量的能力是CO2的12000倍左右,在大气中的寿命可达740年,如表所示是断裂或形成1mol化学键时吸收或释放的能量:
| 化学键 | N≡N | F—F | N—F |
| 能量( kJ) | 946 | 154 | 283 |
(2)已知常温时红磷比白磷稳定,在下列反应中:
①4P(白磷,s)+5O2(g)=2P2O5(s) △H1 ②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
则有:△H1
(3)2.6g C2H2(g)在O2中完全燃烧生成CO2和液态水,放出130kJ的热量。写出C2H2燃烧的热化学方程式
(4)微生物脱盐电池既可以处理废水中的铵盐,同时又能实现海水的淡化,原理如图所示,其中阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
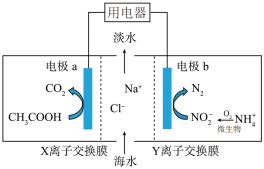
②电极a的电极反应为
③若海水脱盐(NaCl)17.55 g,则在两个电极上产生的气体的物质的量总共为
您最近一年使用:0次
【推荐3】能量、速率和限度是认识和研究化学反应的重要视角。利用所学知识,回答下列问题:
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应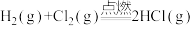 中能量的变化,化学键的键能如表所示:
中能量的变化,化学键的键能如表所示:
则生成1 mol 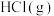 可以放出
可以放出_______ kJ热量。
(2)某温度时,在0.5 L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
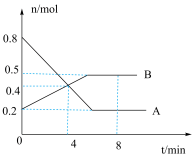
①该反应的化学方程式为_______ 。
②若降低温度,则该反应的正反应速率_______ (填“加快”“减慢”或“不变”,下同),逆反应速率_______ 。
③能判断该反应在一定温度下达到化学平衡状态的依据是_______ 。
a.容器中压强不变 b.混合气体中A的浓度不再改变
c.容器中气体密度不变 d.
④反应从开始至4 min时,用B的浓度变化来表示的反应速率为_______ 。
⑤平衡时A的转化率为_______ 。
(3)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。
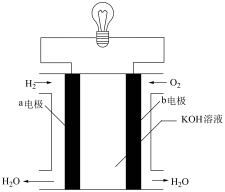
电池工作时,溶液中的 会向
会向_______ 区移动(填“正极”或“负极”),当外电路中转移1 mol电子时,消耗的 在标准状况下体积为
在标准状况下体积为_______ 。
(1)键能是表征化学键强度的物理量,可以用键断裂时所需能量的大小来衡量。从断键和成键的角度分析反应
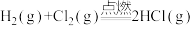 中能量的变化,化学键的键能如表所示:
中能量的变化,化学键的键能如表所示:| 化学键 |  |  |  |
键能(kJ•mol ) ) | 436 | 243 | 431 |
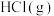 可以放出
可以放出(2)某温度时,在0.5 L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:

①该反应的化学方程式为
②若降低温度,则该反应的正反应速率
③能判断该反应在一定温度下达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中A的浓度不再改变
c.容器中气体密度不变 d.

④反应从开始至4 min时,用B的浓度变化来表示的反应速率为
⑤平衡时A的转化率为
(3)如图装置可以把氢气中蕴含的化学能转化为电能,被称为氢氧燃料电池。

电池工作时,溶液中的
 会向
会向 在标准状况下体积为
在标准状况下体积为
您最近一年使用:0次
【推荐1】2030年实现“碳达峰”,2060年达到“碳中和”的承诺,体现了我国的大国风范。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇涉及的反应可表示为:
①CO2(g)+H2(g) CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1
②CO(g)+2H2(g) CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
(1)根据上述反应求:④CO(g)+H2O(g) CO2(g)+H2(g)的△H4=
CO2(g)+H2(g)的△H4=___________ kJ•mol-1。
(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。
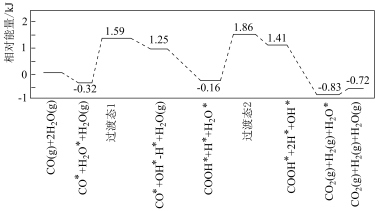
写出该历程中决速步骤的化学方式:___________ 。
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于反应CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
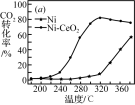
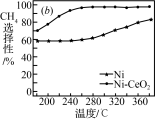
(3)高于320℃后,以Ni为催化剂,CO2转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
Ⅲ.电化学应用
(5)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:
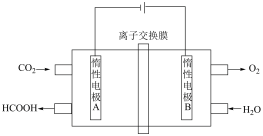
则A极的电极反应式为___________ 。以铅蓄电池为电源进行电解,理论上当有1mol HCOOH生成时,铅蓄电池中消耗H2SO4___________ mol。
Ⅰ.二氧化碳加氢制甲醇涉及的反应可表示为:
①CO2(g)+H2(g)
 CO(g)+H2O(g) △H1
CO(g)+H2O(g) △H1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90kJ•mol-1
CH3OH(g) △H2=-90kJ•mol-1③CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3=-49kJ•mol-1
CH3OH(g)+H2O(g) △H3=-49kJ•mol-1(1)根据上述反应求:④CO(g)+H2O(g)
 CO2(g)+H2(g)的△H4=
CO2(g)+H2(g)的△H4=(2)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上反应④的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。

写出该历程中决速步骤的化学方式:
Ⅱ.CO2和H2合成甲烷也是CO2资源化利用的重要方法。对于反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:
CH4(g)+2H2O(g) △H=-165kJ·mol-l,催化剂的选择是CO2甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得CO2转化率和生成CH4选择性随温度变化的影响如下图所示:

(3)高于320℃后,以Ni为催化剂,CO2转化率仍在上升,其原因是
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
Ⅲ.电化学应用
(5)通过电化学方法可有效实现以CO2和水为原料合成甲酸,其原理示意图如下:

则A极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】 是锂离子电池最早使用的电极材料,利用原钴矿(含
是锂离子电池最早使用的电极材料,利用原钴矿(含 、NiS等质)制备
、NiS等质)制备 的工艺流程如图:
的工艺流程如图:
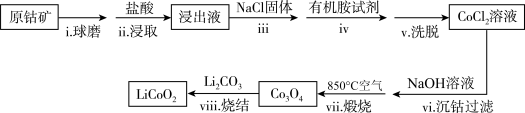
资料:i. 溶于有机胺试剂,有机胺不溶于水
溶于有机胺试剂,有机胺不溶于水
ii.在含一定量 的溶液中,钴离子以
的溶液中,钴离子以 形式存在:
形式存在: 。
。
(1)等物质的量的 和
和 中的
中的 键数之比为
键数之比为_______ 。
(2)步骤iv操作中使用的主要仪器是_______ 。
(3)从平衡移动角度解释步骤iii通中加入 固体的目的
固体的目的_______ 。
(4)已知25℃时 ,若“沉钴过滤”使
,若“沉钴过滤”使 沉淀完全(浓度小于
沉淀完全(浓度小于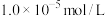 ),当
),当
_______ 时 完全沉淀。
完全沉淀。
(5)设计如图装置回收金属钴。保持细菌所在环境 稳定,借助其降解乙酸盐生成
稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质。完成下列问题:
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质。完成下列问题:
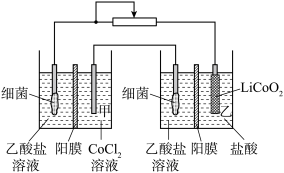
①根据两套装置中含Co化合物中Co元素的化合价可以判断_______ (填“左侧装置”或“右侧装置”)为原电池。装置工作时,甲室溶液pH逐渐_______ (填“增大”或“减小”)。
②装置工作时乙室中的电极反应式为_______ 。
 是锂离子电池最早使用的电极材料,利用原钴矿(含
是锂离子电池最早使用的电极材料,利用原钴矿(含 、NiS等质)制备
、NiS等质)制备 的工艺流程如图:
的工艺流程如图:
资料:i.
 溶于有机胺试剂,有机胺不溶于水
溶于有机胺试剂,有机胺不溶于水ii.在含一定量
 的溶液中,钴离子以
的溶液中,钴离子以 形式存在:
形式存在: 。
。(1)等物质的量的
 和
和 中的
中的 键数之比为
键数之比为(2)步骤iv操作中使用的主要仪器是
(3)从平衡移动角度解释步骤iii通中加入
 固体的目的
固体的目的(4)已知25℃时
 ,若“沉钴过滤”使
,若“沉钴过滤”使 沉淀完全(浓度小于
沉淀完全(浓度小于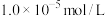 ),当
),当
 完全沉淀。
完全沉淀。(5)设计如图装置回收金属钴。保持细菌所在环境
 稳定,借助其降解乙酸盐生成
稳定,借助其降解乙酸盐生成 ,将废旧锂离子电池的正极材料
,将废旧锂离子电池的正极材料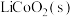 转化为
转化为 ,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质。完成下列问题:
,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质。完成下列问题:
①根据两套装置中含Co化合物中Co元素的化合价可以判断
②装置工作时乙室中的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫酸亚铁(FeSO4)和硫酸亚铁铵[(NH4)2Fe(SO4)2]都是在生产、生活中有重要用途的亚铁盐,探究其饱和溶液稳定性的实验如下:先分别配制FeSO4、(NH4)2Fe(SO4)2饱和溶液,测定pH分别为4.46、4.22,后续实验如图所示。
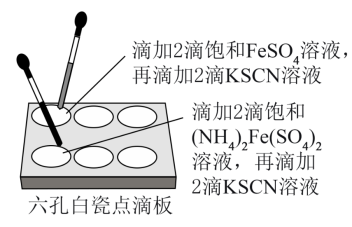
实验结果如表:
回答下列问题:
(1)用白瓷点滴板做上述对比实验的主要优点是____ (答出两条)。
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4____ (NH4)2Fe(SO4)2(填“大于”“小于”或“等于”,下同),物质的量浓度:FeSO4____ (NH4)2Fe(SO4)2。
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为____ 。
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1: 的存在使溶液中Fe2+稳定性增强。
的存在使溶液中Fe2+稳定性增强。
假设2:_____ 使溶液中Fe2+稳定性增强。
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是 具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由
具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由____ 。
(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。
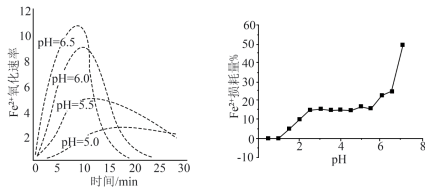
据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是____ (填化学式),其催化活性最强的pH范围是____ (填标号)。
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是____ 。

实验结果如表:
| 硫酸亚铁和硫酸亚铁铵饱和溶液稳定性对比实验研究 | |||||||
| 溶质 | 0min | 1min | 15min | 60min | 3h | 5h | 24h |
| FeSO4 | 淡淡的桔黄色 | 桔红色 | 红色 | 红色 | 深红 | 深红 | 深红 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 米色 | 米色 | 浅黄 | 黄色 | 桔红 | 桔红 |
(1)用白瓷点滴板做上述对比实验的主要优点是
(2)由该实验可以得出两种饱和溶液的稳定性:FeSO4
(3)FeSO4饱和溶液需要新配制,若久置会发黄、变浑浊,且pH减小,发生反应的离子方程式为
(4)影响溶液中Fe2+稳定性的因素可提出3种假设。
假设1:
 的存在使溶液中Fe2+稳定性增强。
的存在使溶液中Fe2+稳定性增强。假设2:
假设3:H+浓度增大使溶液中Fe2+稳定性增强。
假设1的依据是
 具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由
具有一定的还原性,对Fe2+有保护作用,判断该观点是否合理并说明理由(5)实验测得相同浓度的FeSO4溶液在不同pH条件下,Fe2+的损耗量%与pH的关系及Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。

据图分析,开始时Fe2+氧化速率较小,随着产物的生成,速率明显加快,说明产物对反应有催化作用,起催化作用的产物是
A.0~1 B.2~2.4 C.2.4~5.5 D.5.5~7
从趋势上看,pH越小,Fe2+损耗量越小的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或电解法制取。回答下列问题:
Ⅰ、乙烯气相直接水合法制乙醇
(1)已知:
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g) △H2=-29.1 kJ/mol'
③C2H5OH(g)=CH3OCH3(g) △H3= + 50.6 kJ/mol
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=_______ 。
(2)已知等物质的量的C2H4和H2O的混合气体在一定的条件下反应,乙烯的平衡转化率与温度、压强的关系如图。
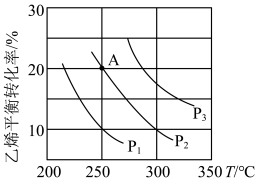
①写出一种提高C2H4平衡转化率的措施_______ 。
②图中压强P1、P2、P3 由小到大的顺序为_______ 。
③乙烯水合制乙醇反应在图中A点(P2=8.1MPa)的平衡常数表达式为:_______ 。
Ⅱ、电解法制乙醇
(3)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电极材料均为惰性电极。该电解池阴极上的电极反应式为_______ ;质子交换膜中H+迁移的方向为_______ 。(选填“从左向右”或“从右向左”)。
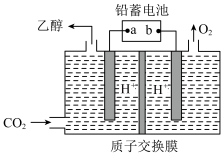
Ⅰ、乙烯气相直接水合法制乙醇
(1)已知:
①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ/mol
②2CH3OH(g)=C2H4(g)+2H2O(g) △H2=-29.1 kJ/mol'
③C2H5OH(g)=CH3OCH3(g) △H3= + 50.6 kJ/mol
则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=
(2)已知等物质的量的C2H4和H2O的混合气体在一定的条件下反应,乙烯的平衡转化率与温度、压强的关系如图。

①写出一种提高C2H4平衡转化率的措施
②图中压强P1、P2、P3 由小到大的顺序为
③乙烯水合制乙醇反应在图中A点(P2=8.1MPa)的平衡常数表达式为:
Ⅱ、电解法制乙醇
(3)以铅蓄电池为电源可将CO2转化为乙醇,其原理如图所示,电极材料均为惰性电极。该电解池阴极上的电极反应式为

您最近一年使用:0次
【推荐2】国家提出2030年前实现碳达峰、2060年前实现碳中和的目标,利用CO或CO2加氢制甲醇将成为实现目标的最佳路径。
(1)利用CO、CO2加氢制甲醇的有关反应如下:
I.2H2(g)+CO(g) CH3OH(g) △H1
CH3OH(g) △H1
II.H2(g)+ CO2(g) CO(g)+ H2O(g) △H 2
CO(g)+ H2O(g) △H 2
III.3H2(g)+CO2(g) CH3OH (g)+H2O(g) △H3
CH3OH (g)+H2O(g) △H3
已知:反应I中的相关的化学键键能数据如下。
由键能可知△H1=___________ kJ·mol-1;若△H2=+41 kJ·mol-1,则△H3=___________ kJ·mol-1。
(2)要使反应I在一定条件下建立的平衡正向移动,可采取的措施有___________ (填字母)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.降低温度
E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(3)在不同温度、压强和相同催化剂条件下,发生反应III,初始时CO2、H2分别为1.0 mol、3.0mol,测得H2的平衡转化率[α(H2)]随温度和压强的变化如图所示。___________ 。
②250 °C、p1条件下,平衡时α(H2)___________ α(CO2)(填“>”“=”或“<”);此时反应的化学平衡常数Kp=___________ (分压=总压×物质的量分数)。
③若在A点平衡状态下,再充入1 mol CO2和1 mol H2O(g), 则速率v正(CO2)___________ (填“>”“<”或“=”)v逆 (CO2)。
(1)利用CO、CO2加氢制甲醇的有关反应如下:
I.2H2(g)+CO(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.H2(g)+ CO2(g)
 CO(g)+ H2O(g) △H 2
CO(g)+ H2O(g) △H 2III.3H2(g)+CO2(g)
 CH3OH (g)+H2O(g) △H3
CH3OH (g)+H2O(g) △H3已知:反应I中的相关的化学键键能数据如下。
| 化学键 | C O O | H-H | C-O | H-O | C-H |
| 键能/(kJ·mol - 1) | 1 071 | 436 | 358 | 467 | 413 |
(2)要使反应I在一定条件下建立的平衡正向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.降低温度
E.使用合适的催化剂 F.从平衡体系中及时分离出CH3OH
(3)在不同温度、压强和相同催化剂条件下,发生反应III,初始时CO2、H2分别为1.0 mol、3.0mol,测得H2的平衡转化率[α(H2)]随温度和压强的变化如图所示。

②250 °C、p1条件下,平衡时α(H2)
③若在A点平衡状态下,再充入1 mol CO2和1 mol H2O(g), 则速率v正(CO2)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物显得尤为重要。

(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H
2NO(g)的△H______ 0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ (N2)=_______________ 。该温度下,若增大压强此反应的平衡常数将______ (填“增大”“减小”“不变”“无法确定”)若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________ 。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_____________________ 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_______________ 。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=______________________ (用含a和b的代数式表示)。

(1)汽车内燃机工作时会引起N2和O2的反应:N2+O2
 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g)
 2NO(g)的△H
2NO(g)的△H②在T3温度下,向2L密闭容器中充入10molN2与5molO2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ (N2)=
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将含a molCH3COOH的醋酸溶液与含b molBa(OH)2的氢氧化钡溶液混合,充分反应后,溶液呈中性,则醋酸的电离常数Ka=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】磺酰氯(SO2Cl2)可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2,制备过程中应用的装置如图(部分夹持装置已省略)
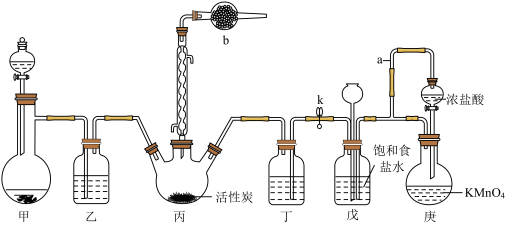
已知:①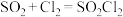
②SO2Cl2熔点为-54.1℃,沸点69.1℃,常温较稳定,100℃以上易分解,遇水剧烈反应。
(1)仪器b中盛放的试剂为_______ ,其作用是_______ 。
(2)甲装置用于制备SO2,则下列试剂组合中合适的是_______ 。
A.18.4mol·L-1的硫酸和Cu
B.10mol·L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
庚装置用于制备Cl2,写出该装置中反应的离子方程式:_______ 。
(3)装置乙和丁中可使用同一种试剂,该试剂为_______ 。
(4)实验过程中需将装置丙置于冷水浴中,其原因是_______ ;向SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色混合盐溶液。写出该过程的离子方程式:_______ 。
(5)某公司开发的Li-SO2Cl2电池,其示意图如下。
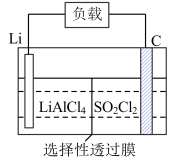
已知电池反应为: 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为_______ 。

已知:①
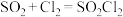
②SO2Cl2熔点为-54.1℃,沸点69.1℃,常温较稳定,100℃以上易分解,遇水剧烈反应。
(1)仪器b中盛放的试剂为
(2)甲装置用于制备SO2,则下列试剂组合中合适的是
A.18.4mol·L-1的硫酸和Cu
B.10mol·L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
庚装置用于制备Cl2,写出该装置中反应的离子方程式:
(3)装置乙和丁中可使用同一种试剂,该试剂为
(4)实验过程中需将装置丙置于冷水浴中,其原因是
(5)某公司开发的Li-SO2Cl2电池,其示意图如下。

已知电池反应为:
 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚
加氢可转化为二甲醚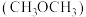 ,反应原理为
,反应原理为 。该反应的能量变化如图1所示。
。该反应的能量变化如图1所示。
(1)该反应为___________ (填“放热”或“吸热”)反应。
(2)在固定体积的密闭容器中发生该反应,能说明该反应达到平衡状态的是___________ (填字母)。
a. 的含量保持不变
的含量保持不变
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.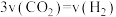
e.四种物质的浓度比为
f.每消耗 ,同时生成
,同时生成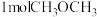
(3)在体积为 密闭容器中充入
密闭容器中充入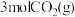 和
和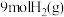 ,测得
,测得 的物质的量随时间变化如图2所示。
的物质的量随时间变化如图2所示。 时,
时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②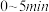 内,
内,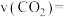
___________ 。
③反应达到平衡状态时,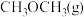 的体积分数为
的体积分数为___________  (保留1位小数)。
(保留1位小数)。
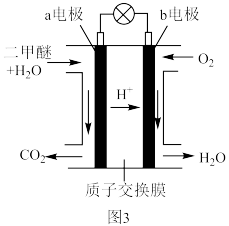
④二甲醚酸性燃料电池的工作原理示意图如图3所示。___________ (填“正”或“负”)极:b电极的电极反应式为___________ 。
 的捕集利用已成为科学家们研究的重要课题。
的捕集利用已成为科学家们研究的重要课题。 加氢可转化为二甲醚
加氢可转化为二甲醚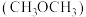 ,反应原理为
,反应原理为 。该反应的能量变化如图1所示。
。该反应的能量变化如图1所示。
(1)该反应为
(2)在固定体积的密闭容器中发生该反应,能说明该反应达到平衡状态的是
a.
 的含量保持不变
的含量保持不变 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.
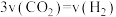
e.四种物质的浓度比为

f.每消耗
 ,同时生成
,同时生成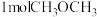
(3)在体积为
 密闭容器中充入
密闭容器中充入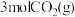 和
和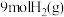 ,测得
,测得 的物质的量随时间变化如图2所示。
的物质的量随时间变化如图2所示。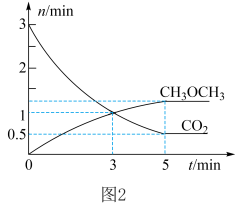
 时,
时,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
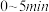 内,
内,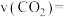
③反应达到平衡状态时,
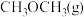 的体积分数为
的体积分数为 (保留1位小数)。
(保留1位小数)。④二甲醚酸性燃料电池的工作原理示意图如图3所示。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
(1)该反应的化学平衡常数表达式为K=________ ;K1______ K2(填“>”“<”或“=”);若增大压强使平衡向正反应方向移动,则平衡常数_________ (填“变”或“不变”)。
(2)判断该反应达到化学平衡状态的依据是____________ (填序号):
A.2υH2(正)= 3υNH3(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.N2的消耗速率等于H2的消耗速率
E.容器中气体的平均相对分子质量不随时间而变化 F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
实验1中以υ(NH3)表示的反应速率为______ ,实验2的速率比实验1快的原因是____________ ;
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图)。则其正极的电极反应为_____________ 。
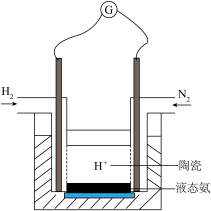
 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表,完成下列问题。| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
(2)判断该反应达到化学平衡状态的依据是
A.2υH2(正)= 3υNH3(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.N2的消耗速率等于H2的消耗速率
E.容器中气体的平均相对分子质量不随时间而变化 F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图)。则其正极的电极反应为

您最近一年使用:0次



