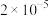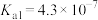由邻苯二甲酸酐和正丁醇制备邻苯二甲酸二丁酯的实验装置(部分装置省略)如图甲,实验操作流程如图乙。
已知:正丁醇的沸点为118℃;
纯邻苯二甲酸二丁酯沸点为340℃,温度超过180℃时易发生分解。

①向三颈烧瓶内依次加入6.0g邻苯二甲酸酐、11.4g正丁醇、少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,升温至160℃,搅拌、保温至反应结束。
③冷却至室温,将反应混合物倒出,通过操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→减压蒸馏。
⑤得到产品6.7g。
请回答下列问题:
(1)仪器a的名称为_____ 。
(2)步骤②中需要不断从分水器(仪器a下面的仪器)下部分离出产物水的目的:_____ ,判断反应已结束的方法是_____ 。
(3)反应Ⅰ进行得迅速而完全,反应Ⅱ是可逆反应,进行得较缓慢,为提高反应速率,可采取的措施是_____ (任写一点即可)。
(4)操作X中,应先用5% 溶液洗涤,其作用是
溶液洗涤,其作用是_____ ;不能使用氢氧化钠洗涤的原因是_____ 。
(5)有机实验中,温度的调控尤为重要,步骤②中温度控制在105℃的目的是:_____ 。
(6)本实验中,邻苯二甲酸二丁酯的产率为_____ %(结果保留小数点后两位)。
已知:正丁醇的沸点为118℃;
纯邻苯二甲酸二丁酯沸点为340℃,温度超过180℃时易发生分解。

①向三颈烧瓶内依次加入6.0g邻苯二甲酸酐、11.4g正丁醇、少量浓硫酸。
②搅拌,升温至105℃,持续搅拌反应2小时,升温至160℃,搅拌、保温至反应结束。
③冷却至室温,将反应混合物倒出,通过操作X,得到粗产品。
④粗产品用无水硫酸镁处理至澄清→取清液(粗酯)→减压蒸馏。
⑤得到产品6.7g。
请回答下列问题:
(1)仪器a的名称为
(2)步骤②中需要不断从分水器(仪器a下面的仪器)下部分离出产物水的目的:
(3)反应Ⅰ进行得迅速而完全,反应Ⅱ是可逆反应,进行得较缓慢,为提高反应速率,可采取的措施是
(4)操作X中,应先用5%
 溶液洗涤,其作用是
溶液洗涤,其作用是(5)有机实验中,温度的调控尤为重要,步骤②中温度控制在105℃的目的是:
(6)本实验中,邻苯二甲酸二丁酯的产率为
更新时间:2023-06-20 10:01:49
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】NOx、SO2的处理对环境保护有着重要意义。
(1)利用反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=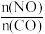 ]的关系如图1所示。
]的关系如图1所示。

①该反应的ΔH___ 0(填“>”、“<”或“=”)。
②投料比m1、m2、m3中,最大的是___ 。
③随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是___ 。
(2)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,主要反应有:
2CO(g)+2NO(g)=2CO2(g)+N2(g)ΔH=akJ·mol-1
4CO(g)+2NO2(g)=4CO2(g)+N2(g)ΔH=bkJ·mol-1
4CO(g)+2SO2(g)=4CO2(g)+S2(g)ΔH=ckJ·mol-1
则2NO2(g)+S2(g)=N2(g)+2SO2(g)的ΔH=___ kJ·mol-1。
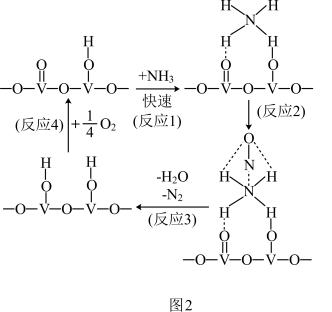
(3)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图2所示,则总反应方程式为___ 。
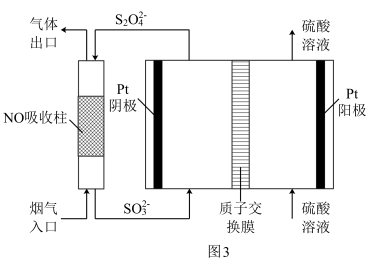
(4)用间接电化学法去除烟气中NO的原理如图3所示。Pt阴极的电极反应式为___ 。
(1)利用反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现汽车尾气的无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比m[m=
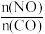 ]的关系如图1所示。
]的关系如图1所示。
①该反应的ΔH
②投料比m1、m2、m3中,最大的是
③随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是
(2)工业生产排放的烟气中同时存在SO2、NOx和CO,利用它们的相互作用可将SO2、NOx还原成无害物质,主要反应有:
2CO(g)+2NO(g)=2CO2(g)+N2(g)ΔH=akJ·mol-1
4CO(g)+2NO2(g)=4CO2(g)+N2(g)ΔH=bkJ·mol-1
4CO(g)+2SO2(g)=4CO2(g)+S2(g)ΔH=ckJ·mol-1
则2NO2(g)+S2(g)=N2(g)+2SO2(g)的ΔH=
(3)NH3催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的V2O5作催化剂,NH3将NO还原成N2的一种反应历程如图2所示,则总反应方程式为

(4)用间接电化学法去除烟气中NO的原理如图3所示。Pt阴极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】将 作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.以 和
和 为原料合成尿素是利用
为原料合成尿素是利用 的成功范例。尿素合成塔中的主要反应如下:
的成功范例。尿素合成塔中的主要反应如下:
反应①: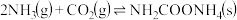

反应②: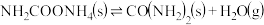
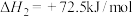
反应③: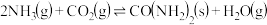
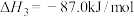
(1)
_______  。
。
(2)对反应③,下列措施中有利于提高 平衡转化率的是_______(填字母)。
平衡转化率的是_______(填字母)。
Ⅱ.可利用 和催化制备合成气(CO、
和催化制备合成气(CO、 )。一定温度下,在容积为1L的密闭容器中,充入等物质的量的和
)。一定温度下,在容积为1L的密闭容器中,充入等物质的量的和 ,加入Ni/Al2O3使其发生反应:
,加入Ni/Al2O3使其发生反应: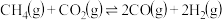 。
。
(3)反应达平衡后,平衡常数K=81,此时测得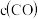 为3mol/L,则
为3mol/L,则 的转化率为
的转化率为_______ 。
(4)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图1所示:

①反应速率:v(步骤①)_______ (填“>”、“<”或“=”)v(步骤②),请依据有效碰撞理论分析其原因_______ 。
②一定温度下,反应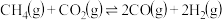 的平衡常数K=
的平衡常数K=_______ (用 、
、 、
、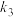 、
、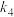 表示)。
表示)。
(5)制备合成气(CO、 )过程中会发生副反应:
)过程中会发生副反应: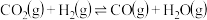
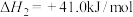 。在刚性密闭容器中,进料比
。在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态时,反应体系中
分别等于1.0、1.5、2.0,且反应达到平衡状态时,反应体系中 随温度变化的关系如图2所示。随着进料比
随温度变化的关系如图2所示。随着进料比 的增加,
的增加, 的值逐渐
的值逐渐_______ (填“增大”、“减小”或“不变”),原因是_______ 。

 作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。Ⅰ.以
 和
和 为原料合成尿素是利用
为原料合成尿素是利用 的成功范例。尿素合成塔中的主要反应如下:
的成功范例。尿素合成塔中的主要反应如下:反应①:
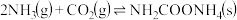

反应②:
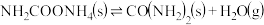
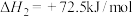
反应③:
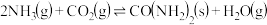
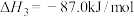
(1)

 。
。(2)对反应③,下列措施中有利于提高
 平衡转化率的是_______(填字母)。
平衡转化率的是_______(填字母)。| A.升高温度 | B.增大压强 |
C.提高原料气中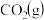 的比例 的比例 | D.及时分离出生成的尿素 |
Ⅱ.可利用
 和催化制备合成气(CO、
和催化制备合成气(CO、 )。一定温度下,在容积为1L的密闭容器中,充入等物质的量的和
)。一定温度下,在容积为1L的密闭容器中,充入等物质的量的和 ,加入Ni/Al2O3使其发生反应:
,加入Ni/Al2O3使其发生反应: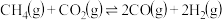 。
。(3)反应达平衡后,平衡常数K=81,此时测得
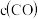 为3mol/L,则
为3mol/L,则 的转化率为
的转化率为(4)制备“合成气”反应历程分两步:
| 反应 | 正反应速率方程 | 逆反应速率方程 | |
| 步骤① | 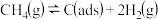 | 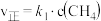 | 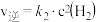 |
| 步骤② | 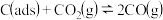 | 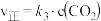 | 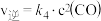 |
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图1所示:

①反应速率:v(步骤①)
②一定温度下,反应
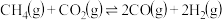 的平衡常数K=
的平衡常数K= 、
、 、
、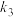 、
、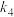 表示)。
表示)。(5)制备合成气(CO、
 )过程中会发生副反应:
)过程中会发生副反应: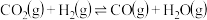
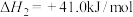 。在刚性密闭容器中,进料比
。在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态时,反应体系中
分别等于1.0、1.5、2.0,且反应达到平衡状态时,反应体系中 随温度变化的关系如图2所示。随着进料比
随温度变化的关系如图2所示。随着进料比 的增加,
的增加, 的值逐渐
的值逐渐
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的Q_______ 0〔填写“>”、“<”、“ = ”〕
(2)前2s内的平均反应速率v (N2) =___________________ 。
(3)在该温度下,反应的平衡常数K =____________ 。(只写出计算结果)
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。_________________

 2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下反应能够自发进行,则反应的Q
(2)前2s内的平均反应速率v (N2) =
(3)在该温度下,反应的平衡常数K =
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |  | NO初始浓度 / 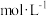 | CO初始浓度 / 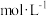 | 催化剂的比 表面积/  |
| I | 280 | 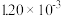 |  | 82 |
| II | 280 | 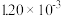 |  | 124 |
| III | 350 | 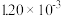 |  | 124 |

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下方法来制备无水FeCl2。有关物质的性质如下:
(1)用H2还原无水FeCl3制取FeCl2。有关装置如图:
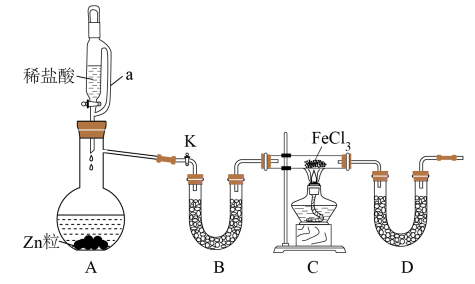
①a的作用是__ ;B中盛放的试剂是__ 。
②H2还原无水FeCl3制取FeCl2的化学方程式为__ 。
③装置D的作用__ 。
④该制备装置的缺点为__ 。
(2)要检验C中的FeCl3是否完全反应的实验操作是__ 。
(3)某学生取C中少量固体溶于水时发现试管中残留少了固体,你认为该固体为_ ;检验该固体可用于试剂__ 。
(4)实验小组同学通过查阅资料,发现利用反应2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,可制取无水FeCl2,设计装置如图。

①该反应的还原剂是__ ;
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用___ 洗涤和干燥后,得到粗产品。
| FeCl3 | FeCl2 | |
| 溶解性 | 不溶于苯、氯苯等,易溶于乙醇,易吸水 | |
| 熔点/℃ | 300℃以上易升华 | 670 |
| 沸点/℃ | 1023 | |

①a的作用是
②H2还原无水FeCl3制取FeCl2的化学方程式为
③装置D的作用
④该制备装置的缺点为
(2)要检验C中的FeCl3是否完全反应的实验操作是
(3)某学生取C中少量固体溶于水时发现试管中残留少了固体,你认为该固体为
(4)实验小组同学通过查阅资料,发现利用反应2FeCl3+C6H5Cl=2FeCl2+C6H4Cl2+HCl↑,可制取无水FeCl2,设计装置如图。

①该反应的还原剂是
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
Ⅰ.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取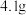 烧碱样品,将样品配成
烧碱样品,将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需__________ 。
(2)取 待测液,用
待测液,用___________ 量取。
(3)用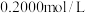 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是___________ 。
(4)根据表中数据,计算样品烧碱的质量分数为___________ (结果保留四位有效数字)。
(5)滴定过程,下列情况会使测定结果偏高的是___________ (填序号)。
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④取待测液时滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下
Ⅱ.在常温时,几种酸的电离平衡常数 如下:
如下:
(6)向 溶液中通入少量
溶液中通入少量 的离子方程式为
的离子方程式为___________ 。
Ⅰ.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取
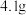 烧碱样品,将样品配成
烧碱样品,将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需(2)取
 待测液,用
待测液,用(3)用
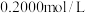 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是(4)根据表中数据,计算样品烧碱的质量分数为
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 5.12 | 28.02 |
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④取待测液时滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下
Ⅱ.在常温时,几种酸的电离平衡常数
 如下:
如下:溶质 |
|
|
|
|
|
|
|
 溶液中通入少量
溶液中通入少量 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】苯佐卡因(对氨基苯甲酸乙酯)常用于创面、溃疡面及痔疮的镇痛。在实验室用对氨基苯甲酸( )与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
)与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
产品合成:在250mL圆底烧瓶中加入8.2g对氨基苯甲酸(0.06mol) 和80mL无水乙醇(约1.4mol),振荡溶解,将烧瓶置于冰水浴并加入10mL浓硫酸,将反应混合物在80℃水浴中加热回流1h,并不时振荡。
分离提纯:冷却后将反应物转移到400mL烧杯中,分批加入10%Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714g·cm-3) 分两次萃取,并向醚层加入无水硫酸镁,蒸出醚层,冷却结晶,最终得到产物3.3g。
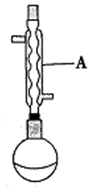
(1)仪器A的名称为______ ,在合成反应进行之前,圆底烧瓶中还应加入适量的______ 。
(2) 该合成反应的化学方程式是______ 。
(3)将烧瓶置于冰水浴中的目的是______ 。
(4)分液漏斗使用之前必须进行的操作是_______ ,乙醚层位于_______ (填“上层”或“下层”);分离提纯操作加入无水硫酸镁的作用是_________ 。
(5)合成反应中加入远过量的乙醇目的是_________ ;分离提纯过程中加入10%Na2CO3溶液的作用是_________ 。
(6)本实验中苯佐卡因的产率为_________ (保留3位有效数字)。该反应产率较低的原因是_________ (填标号)。
a.浓硫酸具有强氧化性和脱水性,导致副反应多 b.催化剂加入量不足
c.产品难溶于水,易溶于乙醇、乙醚 d.酯化反应是可逆反应
 )与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:
)与乙醇反应合成苯佐卡因,有关数据和实验装置图如下:| 相对分子质量 | 密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 乙醇 | 46 | 0.79 | -114.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 399.9 | 微溶于水,易溶于乙醇 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醚类 |
产品合成:在250mL圆底烧瓶中加入8.2g对氨基苯甲酸(0.06mol) 和80mL无水乙醇(约1.4mol),振荡溶解,将烧瓶置于冰水浴并加入10mL浓硫酸,将反应混合物在80℃水浴中加热回流1h,并不时振荡。
分离提纯:冷却后将反应物转移到400mL烧杯中,分批加入10%Na2CO3溶液直至pH=9,转移至分液漏斗中,用乙醚(密度0.714g·cm-3) 分两次萃取,并向醚层加入无水硫酸镁,蒸出醚层,冷却结晶,最终得到产物3.3g。

(1)仪器A的名称为
(2) 该合成反应的化学方程式是
(3)将烧瓶置于冰水浴中的目的是
(4)分液漏斗使用之前必须进行的操作是
(5)合成反应中加入远过量的乙醇目的是
(6)本实验中苯佐卡因的产率为
a.浓硫酸具有强氧化性和脱水性,导致副反应多 b.催化剂加入量不足
c.产品难溶于水,易溶于乙醇、乙醚 d.酯化反应是可逆反应
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】锰铁氧体软磁材料(Fe2O3-MnO)可广泛应用在信息通讯等领域。用软锰矿(主要成分 ,含
,含 、FeO、
、FeO、 、
、 杂质)为主要原料制备锰铁氧体软磁材料的工艺流程如下。
杂质)为主要原料制备锰铁氧体软磁材料的工艺流程如下。
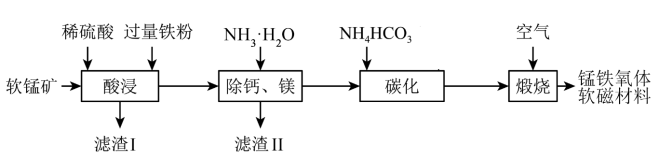
回答下列问题:
(1)滤渣I的主要成分是_______ 。
(2)“酸浸”过程中加入过量铁粉的主要目的是将 还原为
还原为 、
、_______ 。
(3)“碳化”中生成碳酸锰沉淀的离子方程式为_______ 。
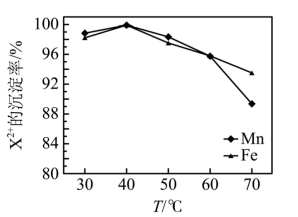
(4)“碳化”时,金属阳离子 的沉淀率与温度关系如图所示。为了使
的沉淀率与温度关系如图所示。为了使 沉淀完全,最适宜的温度是
沉淀完全,最适宜的温度是_____ 。“碳化”过程需加入过量的 ,除了使
,除了使 沉淀完全外,另一原因是
沉淀完全外,另一原因是____ 。
(5)“煅烧”时,碳酸亚铁发生反应的化学方程式为_______ 。
 ,含
,含 、FeO、
、FeO、 、
、 杂质)为主要原料制备锰铁氧体软磁材料的工艺流程如下。
杂质)为主要原料制备锰铁氧体软磁材料的工艺流程如下。
回答下列问题:
(1)滤渣I的主要成分是
(2)“酸浸”过程中加入过量铁粉的主要目的是将
 还原为
还原为 、
、(3)“碳化”中生成碳酸锰沉淀的离子方程式为
(4)“碳化”时,金属阳离子
 的沉淀率与温度关系如图所示。为了使
的沉淀率与温度关系如图所示。为了使 沉淀完全,最适宜的温度是
沉淀完全,最适宜的温度是 ,除了使
,除了使 沉淀完全外,另一原因是
沉淀完全外,另一原因是
(5)“煅烧”时,碳酸亚铁发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水)。
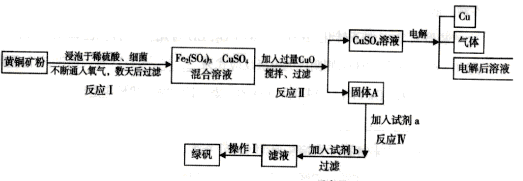
回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:__________________________ ;
(2)反应II中CuO的作用是_________________________ ;
(3)写出加入试剂b发生的反应离子方程式_________________________________________ ;
(4)欲从溶液中获得绿矾晶体,分离操作I应为___________________________ ;
(5)生产过程中,可循环使用的物质有__________________ (写化学式)。

回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:
(2)反应II中CuO的作用是
(3)写出加入试剂b发生的反应离子方程式
(4)欲从溶液中获得绿矾晶体,分离操作I应为
(5)生产过程中,可循环使用的物质有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硼酸三甲酯在工业上用途广泛,以硼镁矿(主要成分为 ,还有少量
,还有少量 、FeO、CaO和
、FeO、CaO和 等)为原料先制备硼酸(
等)为原料先制备硼酸( ),再和甲醇进行酯化反应制备硼酸三甲酯的工艺流程如图所示:
),再和甲醇进行酯化反应制备硼酸三甲酯的工艺流程如图所示:

回答下列问题:
(1)“浸出”时生成硼酸,主要反应的化学方程式为_______ ,为提高浸出速率,除把硼镁矿粉碎外,还可以采取的措施有_______ (写出一条)。
(2)“净化除杂”包含氧化和调pH两个过程,氧化时可加入过氧化氢溶液,其目的是_______ ,氧化后加碳酸钙调pH约为6,滤渣的主要成分为_______ 。
(3)一次母液经过蒸发结晶、过滤可得到的主要副产品为_______ (写名称)。
(4)制备硼酸三甲酯的硼酸纯度需高于99.6%,干燥后所得粗硼酸中含有硫酸镁和硫酸钙杂质,可利用重结晶进行提纯,如图为不同温度对硼酸析结晶率和纯度的影响,则最适宜的温度范围为_______ ℃。

(5)共沸物主要为甲醇和硼酸三甲酯的混合物,精馏后所得釜液可返回步骤_______ (填步骤名称)重复利用。
 ,还有少量
,还有少量 、FeO、CaO和
、FeO、CaO和 等)为原料先制备硼酸(
等)为原料先制备硼酸( ),再和甲醇进行酯化反应制备硼酸三甲酯的工艺流程如图所示:
),再和甲醇进行酯化反应制备硼酸三甲酯的工艺流程如图所示:
回答下列问题:
(1)“浸出”时生成硼酸,主要反应的化学方程式为
(2)“净化除杂”包含氧化和调pH两个过程,氧化时可加入过氧化氢溶液,其目的是
(3)一次母液经过蒸发结晶、过滤可得到的主要副产品为
(4)制备硼酸三甲酯的硼酸纯度需高于99.6%,干燥后所得粗硼酸中含有硫酸镁和硫酸钙杂质,可利用重结晶进行提纯,如图为不同温度对硼酸析结晶率和纯度的影响,则最适宜的温度范围为

(5)共沸物主要为甲醇和硼酸三甲酯的混合物,精馏后所得釜液可返回步骤
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室中制备氯苯的装置如图所示(其中夹持仪器已略去),其原理是苯与氯气在催化剂作用下生成氯苯,同时会有少量苯发生副反应生成二氯苯。苯及其生成物沸点如表所示:
请回答下列问题:
(1)仪器 中盛有
中盛有 晶体,仪器
晶体,仪器 中盛有浓盐酸。打开仪器
中盛有浓盐酸。打开仪器 中活塞,
中活塞, 中产生氯气。仪器
中产生氯气。仪器 名称是
名称是_____________________ 。
(2)仪器 中盛有苯、
中盛有苯、 粉末,仪器
粉末,仪器 中生成的气体经过仪器
中生成的气体经过仪器 进入仪器
进入仪器 中,
中, 中主要反应的化学方程式为
中主要反应的化学方程式为_____________________ 。
(3)仪器 的作用是
的作用是_____________________________ 。
(4) 处应接仪器名称和盛装试剂最好为下列的 。
处应接仪器名称和盛装试剂最好为下列的 。
(5)该方法制备的氯苯中含有很多杂质。可通过如图的流程提纯氯苯:
氯苯混合物
 纯净氯苯
纯净氯苯
①水洗并分液可除去 、部分
、部分  和
和_____________________ (填化学式);
②最后一步分离出纯净氯苯的方法是_________________ (填操作名称)。
(6)工业生产中使用 苯可制得
苯可制得  氯苯,则氯苯的产率为
氯苯,则氯苯的产率为_________________ (保留3位有效数字)。
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点 | 80.0 | 132.2 | 180.4 | 172.0 | 173.4 |
(1)仪器
 中盛有
中盛有 晶体,仪器
晶体,仪器 中盛有浓盐酸。打开仪器
中盛有浓盐酸。打开仪器 中活塞,
中活塞, 中产生氯气。仪器
中产生氯气。仪器 名称是
名称是(2)仪器
 中盛有苯、
中盛有苯、 粉末,仪器
粉末,仪器 中生成的气体经过仪器
中生成的气体经过仪器 进入仪器
进入仪器 中,
中, 中主要反应的化学方程式为
中主要反应的化学方程式为(3)仪器
 的作用是
的作用是(4)
 处应接仪器名称和盛装试剂最好为下列的 。
处应接仪器名称和盛装试剂最好为下列的 。| A.洗气瓶,浓硫酸 | B.烧杯,饱和 溶液 溶液 |
C. 形管,无水 形管,无水 | D. 形管,碱石灰 形管,碱石灰 |
(5)该方法制备的氯苯中含有很多杂质。可通过如图的流程提纯氯苯:
氯苯混合物
 纯净氯苯
纯净氯苯①水洗并分液可除去
 、部分
、部分  和
和②最后一步分离出纯净氯苯的方法是
(6)工业生产中使用
 苯可制得
苯可制得  氯苯,则氯苯的产率为
氯苯,则氯苯的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某同学用如图所示装量制取少量溴苯并证明该反应是取代反应。请回答:
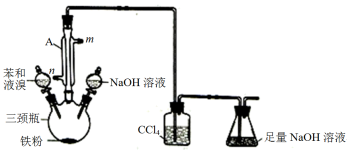
(1)仪器A的名称为_______ 。
(2)制取溴苯的化学方程式为_______ 。
(3)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_______ 。
(4)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用_______ (填仪器名称)分离出溴苯(仍含有少量苯)。
(5)设计实验证明制取溴苯的反应是取代反应_______ 。

(1)仪器A的名称为
(2)制取溴苯的化学方程式为
(3)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出
(4)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用
(5)设计实验证明制取溴苯的反应是取代反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮( )。已知:环己醇、环己酮、水和苯的部分物理性质(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)如下:
)。已知:环己醇、环己酮、水和苯的部分物理性质(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)如下:
回答下列问题:
(1)酸化 时不能选用盐酸,原因是
时不能选用盐酸,原因是_______ (用离子方程式表示)。
(2)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60℃范围内,可采取的措施一是加热方式选用_______ ,二是在加入反应物时将_______ (填化学式)缓慢滴加到另一份试剂中。
(3)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是_______ 。
(4)环己酮的提纯过程为:
①在馏分中加 固体至饱和,静置,分液;加
固体至饱和,静置,分液;加 的目的是
的目的是_______ 。
②加入无水 块状固体;目的是
块状固体;目的是_______ 。
③_______ (填操作名称)后进行蒸馏,收集151~156℃的馏分。
(5)合成环己酮缩乙二醇的原理为 。该反应正向进行的程度较小,实验室常使用如图所示装置(夹持、加热装置已略去)提高产物的产率。下列说法正确的是
。该反应正向进行的程度较小,实验室常使用如图所示装置(夹持、加热装置已略去)提高产物的产率。下列说法正确的是_______ (填标号)。

A.管口A是冷凝水的出水口
B.苯可将反应产生的水及时带出
C.工作一段时间后,当苯即将流回烧瓶中时,必须将分水器中的水和苯放出
D.工作一段时间后,苯可在烧瓶与分水器中循环流动
 )。已知:环己醇、环己酮、水和苯的部分物理性质(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)如下:
)。已知:环己醇、环己酮、水和苯的部分物理性质(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)如下:| 物质 | 沸点(℃,1 ) ) | 密度( ,20℃) ,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.96 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.94 | 微溶于水 |
| 水 | 100.0 | 0.998 | |
| 苯 | 80.1(69) | 0.88 | 难溶于水 |
(1)酸化
 时不能选用盐酸,原因是
时不能选用盐酸,原因是(2)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60℃范围内,可采取的措施一是加热方式选用
(3)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是
(4)环己酮的提纯过程为:
①在馏分中加
 固体至饱和,静置,分液;加
固体至饱和,静置,分液;加 的目的是
的目的是②加入无水
 块状固体;目的是
块状固体;目的是③
(5)合成环己酮缩乙二醇的原理为
 。该反应正向进行的程度较小,实验室常使用如图所示装置(夹持、加热装置已略去)提高产物的产率。下列说法正确的是
。该反应正向进行的程度较小,实验室常使用如图所示装置(夹持、加热装置已略去)提高产物的产率。下列说法正确的是
A.管口A是冷凝水的出水口
B.苯可将反应产生的水及时带出
C.工作一段时间后,当苯即将流回烧瓶中时,必须将分水器中的水和苯放出
D.工作一段时间后,苯可在烧瓶与分水器中循环流动
您最近一年使用:0次