冰晶石(Na3AlF6)是电解铝的助熔剂,一种以H2SiF6(氟硅酸)为原料制取冰晶石的工艺流程如图所示:
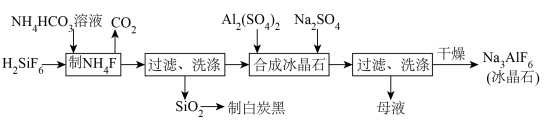
已知:
Ⅰ.无水氟硅酸(H2SiF6)是无色气体,不稳定,易分解为SiF4和HF,水溶液呈强酸性。
Ⅱ.冰晶石微溶于水;实验条件下, 开始沉淀和沉淀完全的pH分别为4.0、5.2。
开始沉淀和沉淀完全的pH分别为4.0、5.2。
回答下列问题:
(1)氟硅酸可贮存在_______ 容器中(填“塑料”“玻璃”或“铝制”)。
(2)“制NH4F”时,配料的物质的量之比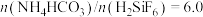 。
。
①生成氟化铵的化学方程式为_______ 。
②反应液在酸性条件下易生成硅酸胶体,工业上需控制反应液的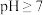 。适宜的加料方式是
。适宜的加料方式是_______ 。
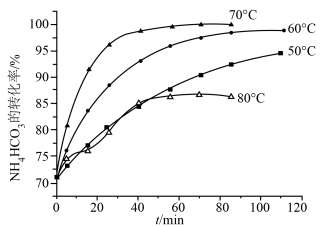
③NH4HCO3转化为NH4F的转化率与温度的关系如图所示,80℃时的转化率反而降低的原因可能是_______ 。
(3)“合成冰晶石”时,控制温度为92.5℃,不断搅拌下,加入饱和 溶液,最后加入Na2SO4粉末,整个过程中保持溶液的pH在3~4。
溶液,最后加入Na2SO4粉末,整个过程中保持溶液的pH在3~4。
①生成冰晶石的化学方程式为_______ 。
②实验时控制溶液pH不超过4的目的是_______ 。
(4)从母液中回收副产品硫酸铵,还需进行的操作是_______ 、过滤、洗涤及干燥。

已知:
Ⅰ.无水氟硅酸(H2SiF6)是无色气体,不稳定,易分解为SiF4和HF,水溶液呈强酸性。
Ⅱ.冰晶石微溶于水;实验条件下,
 开始沉淀和沉淀完全的pH分别为4.0、5.2。
开始沉淀和沉淀完全的pH分别为4.0、5.2。回答下列问题:
(1)氟硅酸可贮存在
(2)“制NH4F”时,配料的物质的量之比
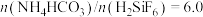 。
。①生成氟化铵的化学方程式为
②反应液在酸性条件下易生成硅酸胶体,工业上需控制反应液的
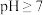 。适宜的加料方式是
。适宜的加料方式是③NH4HCO3转化为NH4F的转化率与温度的关系如图所示,80℃时的转化率反而降低的原因可能是

(3)“合成冰晶石”时,控制温度为92.5℃,不断搅拌下,加入饱和
 溶液,最后加入Na2SO4粉末,整个过程中保持溶液的pH在3~4。
溶液,最后加入Na2SO4粉末,整个过程中保持溶液的pH在3~4。①生成冰晶石的化学方程式为
②实验时控制溶液pH不超过4的目的是
(4)从母液中回收副产品硫酸铵,还需进行的操作是
更新时间:2023/09/13 09:56:51
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某实验小组通过以下实验,探究镀件表面镀铜的最佳条件。
【查阅资料】①Cu2++2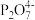
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109
②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是_______ (填仪器名称)。
(2)镀件表面的油污可用_______ 清洗。
(3)电镀时阴极上发生的主要反应的电极反应式为_______ 。
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
(4)实验3中,铜镀层的沉积速率v(Cu)=_______ mol/min(保留两位有效数字)。
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是_______ 。
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是_______ 。
(7)本实验电镀的最佳条件是pH为8.5、_______ 、_______ 。
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为_______ ,通空气搅拌可防止红色固体沉积物形成。
【查阅资料】①Cu2++2
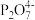
 [Cu(P2O7)2]6-K=1×109
[Cu(P2O7)2]6-K=1×109②Cu+在溶液中不稳定,容易发生歧化。
【实验设计】用CuSO4·5H2O、Na4P2O7·10H2O(焦磷酸钠)、添加剂配制一定浓度的电镀液,分别用纯铜和镀件作为两极材料,探究电镀液的pH、电流密度、电极板间距对层的影响。
(1)要配制一定体积40g/L的CuSO4溶液,以下仪器不需要用到的是

(2)镀件表面的油污可用
(3)电镀时阴极上发生的主要反应的电极反应式为
【实验结果与数据分析】
ⅰ.其他条件不变时,电位10min,pH对电镀的影响如下表:
| 实验信号 | pH值 | 镀膜质量/g | 镀层外观 |
| 1 | 3 | 0.0136 | 表面斑驳 |
| 2 | 7 | 0.0258 | 光亮,不光滑 |
| 3 | 8.5 | 0.0356 | 光亮,光滑 |
| 4 | 10 | 0.0216 | 表面部分斑驳 |
(5)实验1和实验4中,酸性或碱性较强时,镀层出现斑驳的可能原因是
ⅱ.电流密度、电极板间距与镀膜质量的关系

(6)电流密度小于0.50A/dm2时镀膜质量随电流密度增大而增大的原因是
(7)本实验电镀的最佳条件是pH为8.5、
(8)使用最佳条件电镀时,在阳极附近的电镀液中出现红色固体沉积物,其可能原因用离子方程式表示为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮元素有多种氢化物,如氨 、肼
、肼 、氢叠氮酸
、氢叠氮酸 等,它们在工农业生产、生活中有着重大作用。
等,它们在工农业生产、生活中有着重大作用。
(1)新型氨燃料电池因具备价格低廉、释放能量多、产物无污染等优点,发展潜力具大。电池总反应为 ,写出碱性条件下电池负极反应式:
,写出碱性条件下电池负极反应式:___ 。
(2) 与
与 是常用的火箭推进剂.已知
是常用的火箭推进剂.已知 时,
时,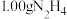 (1)与足量的
(1)与足量的 (l)发生反应,生成液态水和氮气,放出
(l)发生反应,生成液态水和氮气,放出 的热量,则该反应的热化学方程式为
的热量,则该反应的热化学方程式为____ 。
(3)氢叠氮酸 是无色有刺激性气味的液体,在水中略有电离,它的酸性类似于醋酸,
是无色有刺激性气味的液体,在水中略有电离,它的酸性类似于醋酸,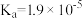 。
。
①若 与
与 溶液充分混合后溶液恰好呈中性,则溶液中
溶液充分混合后溶液恰好呈中性,则溶液中
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②若等浓度的 与
与 溶液按体积比
溶液按体积比 充分混合后,溶液中离子浓度由大到小的顺序是
充分混合后,溶液中离子浓度由大到小的顺序是______ ,溶液中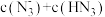
_______ 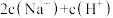 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③常温下, 均为10的
均为10的 溶液与
溶液与 溶液中,水电离出的
溶液中,水电离出的 的比为
的比为_______ 。
④均为 的
的 溶液,
溶液, 由大到小的顺序是
由大到小的顺序是___ 。
 、肼
、肼 、氢叠氮酸
、氢叠氮酸 等,它们在工农业生产、生活中有着重大作用。
等,它们在工农业生产、生活中有着重大作用。(1)新型氨燃料电池因具备价格低廉、释放能量多、产物无污染等优点,发展潜力具大。电池总反应为
 ,写出碱性条件下电池负极反应式:
,写出碱性条件下电池负极反应式:(2)
 与
与 是常用的火箭推进剂.已知
是常用的火箭推进剂.已知 时,
时,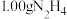 (1)与足量的
(1)与足量的 (l)发生反应,生成液态水和氮气,放出
(l)发生反应,生成液态水和氮气,放出 的热量,则该反应的热化学方程式为
的热量,则该反应的热化学方程式为(3)氢叠氮酸
 是无色有刺激性气味的液体,在水中略有电离,它的酸性类似于醋酸,
是无色有刺激性气味的液体,在水中略有电离,它的酸性类似于醋酸,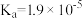 。
。①若
 与
与 溶液充分混合后溶液恰好呈中性,则溶液中
溶液充分混合后溶液恰好呈中性,则溶液中
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②若等浓度的
 与
与 溶液按体积比
溶液按体积比 充分混合后,溶液中离子浓度由大到小的顺序是
充分混合后,溶液中离子浓度由大到小的顺序是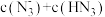
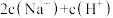 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③常温下,
 均为10的
均为10的 溶液与
溶液与 溶液中,水电离出的
溶液中,水电离出的 的比为
的比为④均为
 的
的 溶液,
溶液, 由大到小的顺序是
由大到小的顺序是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2和H2反应生成乙烯和水蒸气的热化学方程式为__________________________________ 。
(2)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
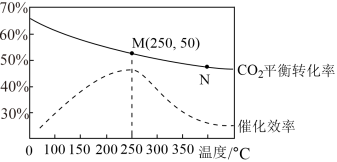
①平衡常数:KM__________ KN (填“>”“<”或“=”)。
②下列说法正确的是_________ (填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或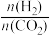 不变时,均可证明反应已达平衡状态
不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________ 。
(3)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____ 移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______ (填“增大”“减小”或“不变”)。
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2和H2反应生成乙烯和水蒸气的热化学方程式为
(2)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。

①平衡常数:KM
②下列说法正确的是
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或
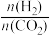 不变时,均可证明反应已达平衡状态
不变时,均可证明反应已达平衡状态C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为
④图中M点对应乙烯的质量分数为
(3)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某含镍(NiO)废料中有FeO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4的工艺流程如图1所示:
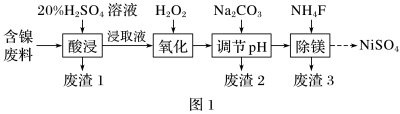
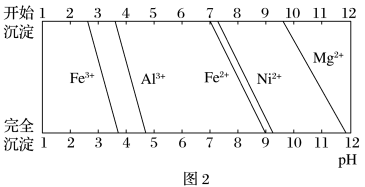
已知:①有关金属离子生成氢氧化物沉淀时溶液的pH如图2所示。
②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是_______ (填化学式)。
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理加以解释:__________________ (用必要的文字和离子方程式回答)。
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=___________ (列出计算式即可) mol·L-1。NH4F溶液呈____ (填“酸性”“碱性”或“中性”)。
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3 mol·L-1,当除镁率达到99%时,溶液中c(F-)=____ mol·L-1。

已知:①有关金属离子生成氢氧化物沉淀时溶液的pH如图2所示。

②25 ℃时,NH3·H2O的电离常数Kb=1.8×10-5。HF的电离常数Ka=7.2×10-4,Ksp(MgF2)=7.4×10-11。
(1)加Na2CO3调节溶液的pH至5,得到废渣2的主要成分是
(2)Mg能与饱和NH4Cl溶液反应产生NH3,请用化学平衡移动原理加以解释:
(3)25 ℃时,1 mol·L-1的NaF溶液中c(OH-)=
(4)已知沉淀前溶液中c(Mg2+)=1.85×10-3 mol·L-1,当除镁率达到99%时,溶液中c(F-)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______ (填标号)。
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______ ,与直接用废铜和浓硫酸反应相比,该方法的优点是_______ 。
(3)待 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______ 、乙醇洗涤、_______ ,得到胆矾。其中,控制溶液 为3.5~4的目的是
为3.5~4的目的是_______ ,煮沸 的作用是
的作用是_______ 。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为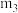 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为_______ (写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是_______ (填标号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
 )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的
)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有
A.烧杯 B.容量瓶 C.蒸发皿 D.移液管
(2)将
 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为
加入到适量的稀硫酸中,加热,其主要反应的化学方程式为(3)待
 完全反应后停止加热,边搅拌边加入适量
完全反应后停止加热,边搅拌边加入适量 ,冷却后用
,冷却后用 调
调 为3.5~4,再煮沸
为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、 为3.5~4的目的是
为3.5~4的目的是 的作用是
的作用是(4)结晶水测定:称量干燥坩埚的质量为
 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为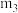 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为(5)下列操作中,会导致结晶水数目测定值偏高的是
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾迸溅出来
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】钪(Sc)及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸(含TiO2+、Sc3+、Fe3+等离子的硫酸废液)和拜尔法赤泥(含有Sc2O3、Al2O3、Fe2O3、SiO2等)联合提取钪的工艺流程如下。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是_______ 。
(2)“洗钛”中H2O2的作用是_______ (填标号)。
A.作氧化剂 B.作还原剂 C.作配体
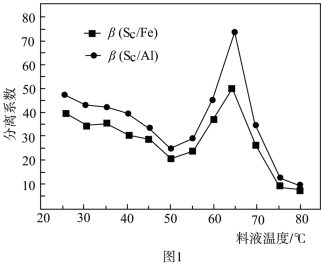
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为_______ 、_______ 。
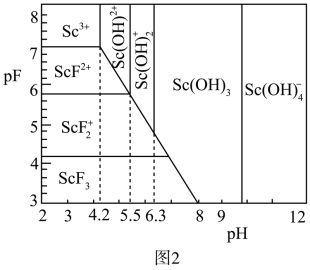
(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于_______ ,“沉钪”所得滤液中c(F–)应大于_______ mol·L1。
(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是_______ (用化学方程式表示)。已知该流程中“沉钪”所得滤渣是ScF3与NH4Cl形成的水合复盐沉淀,“脱水除铵”可制得高纯度ScF3的原因是_______ 。

回答下列问题:
(1)“酸浸”所得浸渣的主要成分是
(2)“洗钛”中H2O2的作用是
A.作氧化剂 B.作还原剂 C.作配体
(3)“萃取”是用酸性磷酸酯萃取剂(P507)、苯乙酮、磺化煤油配得的混合液作萃取剂,P507质量分数(w)对萃取率的影响如表所示、料液温度对分离系数(β)的影响如图1所示,萃取时P507最佳质量分数及料液温度分别为
| w(P507)/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1 | 分相容易 | 90.74 | 14.89 |
| 2 | 分相容易 | 91.74 | 19.88 |
| 3 | 分相容易 | 92.14 | 13.30 |
| 5 | 有第三相 | 90.59 | 28.47 |
| 8 | 轻微乳化 | 90.59 | 34.85 |

(4)含钪元素的微粒与pF[pF=–lgc(F–)]、pH的关系如图2所示,用氨水调节溶液的pH最好小于

(5)传统制备ScF3的方法是先得到ScF3·6H2O,再高温脱水得到ScF3,但所得ScF3通常含有ScOF杂质,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
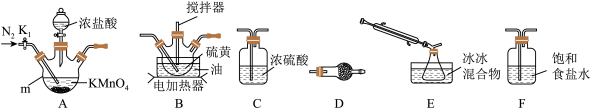
①仪器m的名称为___ ,装置F中试剂的作用是___ 。
②装置连接顺序:A→___ →E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___ 。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___ 。
(2)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___ 。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2  2SCl2 2SCl2③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为
②装置连接顺序:A→
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
④为了提高S2Cl2的纯度,实验的关键是控制好温度和
(2)S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】 溴化钙是一种溴化物, 用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、
制冷剂等。制备CaBr2 ·2H2O的主要流程如下:
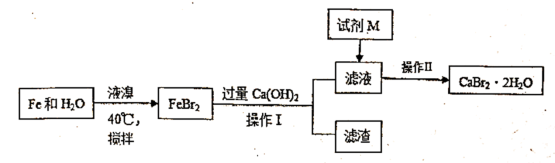
(1)与液溴的反应温度不能超过40℃的原因是_______________________________ 。
(2)加入M的目的是________________________________ 。
(3)操作II的步骤为蒸发浓缩、____________________ 、洗涤、干燥
(4)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式________________________________________ 。
(5)制得的CaBr2:2H2O可以通过以下方法测定纯度:称取5. 00g 样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g 固体,则CaBr2 2H2O的质量分数为________________________ 。
制冷剂等。制备CaBr2 ·2H2O的主要流程如下:

(1)与液溴的反应温度不能超过40℃的原因是
(2)加入M的目的是
(3)操作II的步骤为蒸发浓缩、
(4)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式
(5)制得的CaBr2:2H2O可以通过以下方法测定纯度:称取5. 00g 样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g 固体,则CaBr2 2H2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】用下面两种方法可以制得白色的Fe(OH)2沉淀:
【方法一】用不含Fe3+的FeSO4 溶液与用不含O2的蒸馏水配制的NaOH 溶液反应来制备。
(1)实验室用硫酸亚铁晶体配制上述FeSO4溶液时,一般需加入铁粉和稀硫酸,加入铁粉的目的是_____________ 。
【方法二】在如图所示的装置中,用NaOH 溶液、铁屑、稀H2SO4 等试剂来制备。
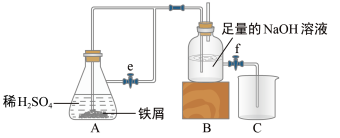
(2)实验开始时,止水夹e 是______ (填“打开”或“关闭”)的。
(3)如何检验装置内空气已经排尽?________________ 。
(4)排尽装置内空气后,为了制得白色Fe(OH)2 沉淀,操作步骤是________ 。
(5)开启活塞f放掉约2/3 液体,此时装置B 中试剂瓶中发生的化学反应方程式为________ 。
(6)下列各图示中________ (填序号)能较长时间看到Fe(OH)2白色沉淀。

【方法一】用不含Fe3+的FeSO4 溶液与用不含O2的蒸馏水配制的NaOH 溶液反应来制备。
(1)实验室用硫酸亚铁晶体配制上述FeSO4溶液时,一般需加入铁粉和稀硫酸,加入铁粉的目的是
【方法二】在如图所示的装置中,用NaOH 溶液、铁屑、稀H2SO4 等试剂来制备。

(2)实验开始时,止水夹e 是
(3)如何检验装置内空气已经排尽?
(4)排尽装置内空气后,为了制得白色Fe(OH)2 沉淀,操作步骤是
(5)开启活塞f放掉约2/3 液体,此时装置B 中试剂瓶中发生的化学反应方程式为
(6)下列各图示中

您最近一年使用:0次



