25 ℃时部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________ 。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为________________ 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为____________________ 。
(4)下列离子方程式书写正确的是__________ (填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________ 。
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数/(mol·L-1) | Ka=1.8×10-4 | Ka=4.7×10-8 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO
 、CO
、CO 、HSO
、HSO 、HCO
、HCO 浓度由大到小的顺序为
浓度由大到小的顺序为(4)下列离子方程式书写正确的是
a.2ClO-+H2O+CO2=2HClO+CO

b.2HCOOH+CO
 =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑c.H2SO3+2HCOO-=2HCOOH+SO

d.Cl2+H2O+2CO
 =2HCO
=2HCO +Cl-+ClO-
+Cl-+ClO-(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为
更新时间:2023-09-21 01:31:27
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题:
(1)有下列物质:①NaOH②Fe③NaHCO3④CH3COOH⑤NH4Cl⑥H2O⑦稀硫酸⑧ NH3·H2O
属于强电解质的有__________ ;属于弱电解质的有__________ 。(填序号)
(2)纯净的乙酸又称冰醋酸。在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
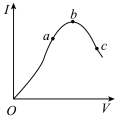
① “O”点导电能力为0的理由是__________ 。
②a、b、c三点处,溶液的c(H+)由小到大的顺序为__________ 。
③a、b、c三点处,电离程度最大的是__________ 。
④食用白醋中,醋酸浓度约为1mol/L,能证明醋酸为弱电解质的是( )
A.白醋中滴入石蕊试液呈红色
B. pH试纸显示醋酸的pH为2—3
C.蛋壳浸泡在白醋中有气体放出
D. 白醋加入豆浆中有沉淀产生
E. 取出10 mL醋酸,用pH计测出其pH为a,然后用蒸馏水稀释至100 mL,再用pH计测出其pH为b ,b﹤a+1
(1)有下列物质:①NaOH②Fe③NaHCO3④CH3COOH⑤NH4Cl⑥H2O⑦稀硫酸⑧ NH3·H2O
属于强电解质的有
(2)纯净的乙酸又称冰醋酸。在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

① “O”点导电能力为0的理由是
②a、b、c三点处,溶液的c(H+)由小到大的顺序为
③a、b、c三点处,电离程度最大的是
④食用白醋中,醋酸浓度约为1mol/L,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色
B. pH试纸显示醋酸的pH为2—3
C.蛋壳浸泡在白醋中有气体放出
D. 白醋加入豆浆中有沉淀产生
E. 取出10 mL醋酸,用pH计测出其pH为a,然后用蒸馏水稀释至100 mL,再用pH计测出其pH为b ,b﹤a+1
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是_______ (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显_______ (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)_______ ;
(3)NaHA 溶液显_______ (填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)_______ ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能_______ 0.11mol·L-1(填“<”、“>”或“=”),理由是:_______ ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是_______ 。
 A2-+H+。回答下列问题:
A2-+H+。回答下列问题:(1)H2A是
(2)Na2A 溶液显
(3)NaHA 溶液显
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1H2A溶液中氢离子的物质的量浓度可能
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】醋酸和盐酸是日常生活中常见的酸。
(1)用化学用语表示醋酸显酸性的原因_______ ,该过程的
________ 0(填“>”“<”或“=”)
(2)25℃、常压下,在 的稀醋酸溶液中,由水电离出的
的稀醋酸溶液中,由水电离出的
___________ mol/L。下列方法中,可以使上述醋酸溶液的电离程度增大的是________ (填字母)。
A.加入少量0.10mol/L的稀盐酸 B.加入少量氯化钠晶体
C.加入少量纯 D.加入少量0.10mol/L的NaOH溶液
D.加入少量0.10mol/L的NaOH溶液
(3)将等质量的锌粉投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)________ V(醋酸)(填“>”、“<”或“=”)。
(4)25℃向体积为 的醋酸溶液中滴加
的醋酸溶液中滴加 的NaOH溶液,溶液恰好呈中性,则
的NaOH溶液,溶液恰好呈中性,则 与
与 的关系是:
的关系是:
________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)25℃将 的盐酸和
的盐酸和 的氢氧化钠溶液混合,若混合后溶液呈中性,则盐酸与氢氧化钠溶液的体积比为
的氢氧化钠溶液混合,若混合后溶液呈中性,则盐酸与氢氧化钠溶液的体积比为___________ 。
(6)向aL 溶液中加入bmol
溶液中加入bmol ,恢复至25℃,混合液呈中性,该溶液中离子浓度的大小排序为
,恢复至25℃,混合液呈中性,该溶液中离子浓度的大小排序为_______ ,混合溶液中
________ mol/L(忽略溶液体积变化)。
(7)铜和盐酸的反应在通常状况下不能自发进行,可以利用电化学手段使其发生,在下面方框中画出装置示意图,标出电极材料和电解质溶液名称___________ 。

(1)用化学用语表示醋酸显酸性的原因

(2)25℃、常压下,在
 的稀醋酸溶液中,由水电离出的
的稀醋酸溶液中,由水电离出的
A.加入少量0.10mol/L的稀盐酸 B.加入少量氯化钠晶体
C.加入少量纯
 D.加入少量0.10mol/L的NaOH溶液
D.加入少量0.10mol/L的NaOH溶液(3)将等质量的锌粉投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)
(4)25℃向体积为
 的醋酸溶液中滴加
的醋酸溶液中滴加 的NaOH溶液,溶液恰好呈中性,则
的NaOH溶液,溶液恰好呈中性,则 与
与 的关系是:
的关系是:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)25℃将
 的盐酸和
的盐酸和 的氢氧化钠溶液混合,若混合后溶液呈中性,则盐酸与氢氧化钠溶液的体积比为
的氢氧化钠溶液混合,若混合后溶液呈中性,则盐酸与氢氧化钠溶液的体积比为(6)向aL
 溶液中加入bmol
溶液中加入bmol ,恢复至25℃,混合液呈中性,该溶液中离子浓度的大小排序为
,恢复至25℃,混合液呈中性,该溶液中离子浓度的大小排序为
(7)铜和盐酸的反应在通常状况下不能自发进行,可以利用电化学手段使其发生,在下面方框中画出装置示意图,标出电极材料和电解质溶液名称

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】在一定温度下,将冰醋酸加水稀释,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答下列问题:

(1)“0"点冰醋酸不能导电的原因是_____________ 。
(2)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为____________ 。
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是___________ 。
(4)若使c点对应的溶液中的c(CH3COO-)增大,在下列措施中,可行的是_______ (填字母)。
A.加热 B.加KOH固体 C.加水 D.加CH3COONa固体 E.加锌粒
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的是_________ 。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
(6)由表格中的电离平衡常数判断可以发生的反应是____________ 。
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3

(1)“0"点冰醋酸不能导电的原因是
(2)a、b、c三点对应的溶液中,c(H+)由小到大的顺序为
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是
(4)若使c点对应的溶液中的c(CH3COO-)增大,在下列措施中,可行的是
A.加热 B.加KOH固体 C.加水 D.加CH3COONa固体 E.加锌粒
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的是
A.c(H+) B.H+个数 C.CH3COOH分子数 D.

(6)由表格中的电离平衡常数判断可以发生的反应是
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.NaClO+NaHCO3=HClO+Na2CO3
B.2HClO+Na2CO3=2NaClO+CO2↑+H2O
C.2NaClO+CO2+H2O=2HClO+Na2CO3
D.NaClO+CO2+H2O=HClO+NaHCO3
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。现有 时,浓度均为
时,浓度均为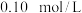 的
的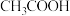 和
和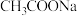 的缓冲溶液,
的缓冲溶液, 。回答下列问题:
。回答下列问题:  为盐的水解常数
为盐的水解常数
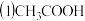 的电离方程式
的电离方程式________________ 。
 该缓冲溶液中离子浓度由大到小的顺序是
该缓冲溶液中离子浓度由大到小的顺序是________________ 。
 时,
时,
________ 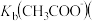 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
 向
向 上述缓冲溶液中滴加几滴NaOH稀溶液
上述缓冲溶液中滴加几滴NaOH稀溶液 忽略溶液体积的变化
忽略溶液体积的变化 ,反应后溶液中
,反应后溶液中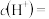
________  。
。
 人体血液存在
人体血液存在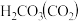 和
和 的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是
的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是________  填写选项字母
填写选项字母 。
。
 代谢产生的
代谢产生的 被
被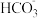 结合形成
结合形成
 血液中的缓冲体系可抵抗大量酸、碱的影响
血液中的缓冲体系可抵抗大量酸、碱的影响
 代谢产生的碱被
代谢产生的碱被 中和,
中和, 又由
又由 电离补充
电离补充
 时,浓度均为
时,浓度均为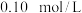 的
的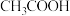 和
和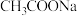 的缓冲溶液,
的缓冲溶液, 。回答下列问题:
。回答下列问题:  为盐的水解常数
为盐的水解常数
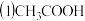 的电离方程式
的电离方程式 该缓冲溶液中离子浓度由大到小的顺序是
该缓冲溶液中离子浓度由大到小的顺序是 时,
时,
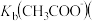 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。 向
向 上述缓冲溶液中滴加几滴NaOH稀溶液
上述缓冲溶液中滴加几滴NaOH稀溶液 忽略溶液体积的变化
忽略溶液体积的变化 ,反应后溶液中
,反应后溶液中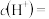
 。
。 人体血液存在
人体血液存在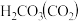 和
和 的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是
的缓冲体系,能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定,有关机理说法正确的是 填写选项字母
填写选项字母 。
。 代谢产生的
代谢产生的 被
被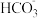 结合形成
结合形成
 血液中的缓冲体系可抵抗大量酸、碱的影响
血液中的缓冲体系可抵抗大量酸、碱的影响 代谢产生的碱被
代谢产生的碱被 中和,
中和, 又由
又由 电离补充
电离补充
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】次磷酸(H3PO2)是一元弱酸,常温下,电离平衡常数Ka(H3PO2)=5.9×10-2,Ka(CH3COOH)=1.8×10-5。
(1)写出次磷酸电离方程式__ 。
(2)将0.1 mol•L-1的H3PO2溶液加水稀释,有关稀释后H3PO2溶液的说法中,正确的是__ (填字母)。
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中H3PO2分子增多
(3)将少量次磷酸溶液与CH3COONa溶液混合,写出该反应离子方程式__ 。
(1)写出次磷酸电离方程式
(2)将0.1 mol•L-1的H3PO2溶液加水稀释,有关稀释后H3PO2溶液的说法中,正确的是
a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中H3PO2分子增多
(3)将少量次磷酸溶液与CH3COONa溶液混合,写出该反应离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数Ka=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度=
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数Ka=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度=______ 。(计算结果保留小数点后一位)
(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-x,则x=______ 。
H3BO3(aq)+H2O(l)
 [B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数Ka=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度=
[B(OH)4]-(aq)+H+(aq)。已知25℃时它的电离常数Ka=5.7×10-10。则此温度下0.7 mol·L-1硼酸溶液中H+的浓度=(2)常温下,0.1 mol·L-1的氯化铵溶液pH=5.1.若常温下氨水的电离常数Kb=10-x,则x=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学上把外加少量酸、碱而pH基本不变的溶液称为缓冲溶液。回答下列问题:
I.25℃时,浓度均为0.1mol·L-1的CH3COOH和CH3COONa的缓冲溶液的pH=4.76。
(1)改变下列条件,能使CH3COONa稀溶液中 的值增大的是
的值增大的是___________ (填字母)。
a.加入少量CH3COONa固体 b.升温 c.稀释 d.加入NaOH固体 e.加入冰醋酸(忽略体积变化)
(2)该缓冲溶液中各离子浓度由小到大的顺序为___________ 。
(3)请用化学语言解释CH3COOH和CH3COONa组成的溶液具有一定的缓冲作用的原理________
II.人体血液里主要通过碳酸氢盐缓冲体系(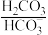 )维持pH稳定。
)维持pH稳定。
(4)已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1, ≈20,lg2=0.3,此时溶液的pH=
≈20,lg2=0.3,此时溶液的pH=___________ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将___________ (填“变大”、“变小”或“不变”)。
(5)某同学将0.1mol·L-1的NaHCO3溶液滴加到0.1mol·L-1的CaCl2溶液中,产生了白色沉淀和气体,试用离子方程式表示该过程:___________ 。
I.25℃时,浓度均为0.1mol·L-1的CH3COOH和CH3COONa的缓冲溶液的pH=4.76。
(1)改变下列条件,能使CH3COONa稀溶液中
 的值增大的是
的值增大的是a.加入少量CH3COONa固体 b.升温 c.稀释 d.加入NaOH固体 e.加入冰醋酸(忽略体积变化)
(2)该缓冲溶液中各离子浓度由小到大的顺序为
(3)请用化学语言解释CH3COOH和CH3COONa组成的溶液具有一定的缓冲作用的原理
II.人体血液里主要通过碳酸氢盐缓冲体系(
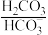 )维持pH稳定。
)维持pH稳定。(4)已知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
 ≈20,lg2=0.3,此时溶液的pH=
≈20,lg2=0.3,此时溶液的pH= 的值将
的值将(5)某同学将0.1mol·L-1的NaHCO3溶液滴加到0.1mol·L-1的CaCl2溶液中,产生了白色沉淀和气体,试用离子方程式表示该过程:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】近期发现, 是继
是继 、
、 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
常温时,某些弱电解质的电离常数如下表:
按要求回答下列问题:
(1) 属于
属于_______ 酸,在水中的二级电离常数表达式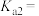
_______ 。
(2)室温下,将浓度为 的
的 溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是_______。
溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是_______。
(3)常温下,向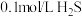 溶液中通入
溶液中通入 或加入
或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。
的挥发)。

①当溶液中 时,溶液中
时,溶液中
_______ ,由水电离产生的
_______ 。
②当 时,溶液中的
时,溶液中的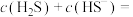
_______ 。
(4)下列有关溶液中的反应化学方程式正确的是_______。
 是继
是继 、
、 之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温时,某些弱电解质的电离常数如下表:
| 弱电解质 |  |  |  |
| 电离常数 | 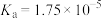 | 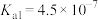  | 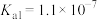 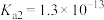 |
(1)
 属于
属于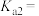
(2)室温下,将浓度为
 的
的 溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是_______。
溶液不断加水稀释(忽略溶液温度的变化),下列各量始终保持增大的是_______。A.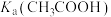 | B. |
C. | D. |
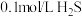 溶液中通入
溶液中通入 或加入
或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。
的挥发)。
①当溶液中
 时,溶液中
时,溶液中

②当
 时,溶液中的
时,溶液中的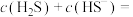
(4)下列有关溶液中的反应化学方程式正确的是_______。
A. |
B. |
C. |
D. |
您最近一年使用:0次



