SO2和H2S是大气污染物,这两种气体的转化研究对资源综合利用和环境保护有重要意义。
Ⅰ.水煤气还原法
已知:①2H2(g)+SO2(g)=S(1)+2H2O(g) ΔH1=+45.4kJ·mol-1
②2CO(g)+SO2(g)=S(1)+2CO2(g) ΔH2=-37.0kJ·mol-1
(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式___________ ;若该反应在恒温恒容体系中进行,则其达到平衡的标志为___________ (填字母)。
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应①2H2(g)+SO2(g)=S(1)+2H2O(g),反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率α(SO2)=___________ 。

(3)某密闭容器中发生上述反应②2CO(g)+SO2(g)=S(1)+2CO2(g),平衡时CO的体积分数(%)与压强和温度的关系如图所示。

则T1、T2、T3由小到大的关系顺序是___________ ,判断的理由是___________ 。
Ⅱ.碱液吸收法
(4)用K2CO3溶液吸收H2S,其原理为CO +H2S=HS-+HCO
+H2S=HS-+HCO 。该反应的平衡常数K=
。该反应的平衡常数K=___________ 。(已知H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
Ⅰ.水煤气还原法
已知:①2H2(g)+SO2(g)=S(1)+2H2O(g) ΔH1=+45.4kJ·mol-1
②2CO(g)+SO2(g)=S(1)+2CO2(g) ΔH2=-37.0kJ·mol-1
(1)写出CO(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
A.单位时间内,生成nmolCO的同时生成nmolCO2
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D.CO2(g)与H2(g)的体积比保持不变
(2)在温度为T℃下,将1.4molH2和1molSO2通入2L恒容密闭容器中发生上述反应①2H2(g)+SO2(g)=S(1)+2H2O(g),反应体系中气体的总压强随时间变化如图所示。SO2的平衡转化率α(SO2)=

(3)某密闭容器中发生上述反应②2CO(g)+SO2(g)=S(1)+2CO2(g),平衡时CO的体积分数(%)与压强和温度的关系如图所示。

则T1、T2、T3由小到大的关系顺序是
Ⅱ.碱液吸收法
(4)用K2CO3溶液吸收H2S,其原理为CO
 +H2S=HS-+HCO
+H2S=HS-+HCO 。该反应的平衡常数K=
。该反应的平衡常数K=
更新时间:2023-10-03 16:11:04
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
【推荐1】I.钛(Ti)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由金红石(TiO2)制取单质Ti的步骤如下:
TiO2→TiCl4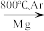 Ti
Ti
已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=_______
(2)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是_______
Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
(3)依据该学生的实验数据计算,该实验测得的中和热ΔH=_______ (结果保留一位小数)。如用0.5 mol∙L−1的盐酸与NaOH固体进行实验,则实验中测得的中和热数值将_______ (填“偏大”、“偏小”或“不变”)。
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。
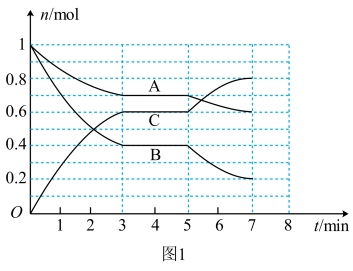
(4)根据图1数据,写出该反应的化学方程式:_______ 。此反应的平衡常数表达式K=_______ 。
(5)在5~7min内,若K不变,则此处曲线变化的原因是_______ 。
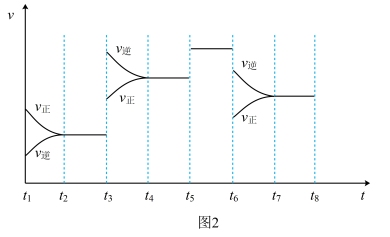
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为_______ (用“>”、“<”或“=”连接)
TiO2→TiCl4
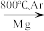 Ti
Ti已知:i. C(s)+O2(g)=CO2(g) ΔH=−393.5 kJ∙mol−1
ii. 2CO(g)+O2(g)=2CO2(g) ΔH=−566 kJ∙mol−1
ⅲ. TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) ΔH=+141 kJ∙mol−1
(1)TiO2(s)+2Cl2(g)+2 C(s)=TiCl(s)+2CO(g)的ΔH=
(2)反应TiCl4+2Mg
 2MgCl2+Ti在Ar气氛中进行的理由是
2MgCl2+Ti在Ar气氛中进行的理由是Ⅱ. 50mL 0.50 mol∙L−1盐酸与50mL 0.55 mol∙L−1 NaOH溶液在简易量热计中进行中和反应,假设盐酸和氢氧化钠溶液的密度都是1g·cm−3,又知中和反应后生成溶液的比热容c=4.18J·g−1·℃−1。为了计算中和热,某学生实验记录的数据如下:
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
Ⅲ.25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。

(4)根据图1数据,写出该反应的化学方程式:
(5)在5~7min内,若K不变,则此处曲线变化的原因是
(6)此反应的反应速率v和时间t的关系如图2,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为

| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】火山爆发时会喷出SO2,SO2是大气主要污染物之一,在工业中可用于制备硫酸。回答下列问题:
(1)SO2是_____ (填“电解质”或“非电解质”)。
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+ O2(g)=CuO(s) △H=x kJ∙mol-1
O2(g)=CuO(s) △H=x kJ∙mol-1
Cu(s)+ S(s)=
S(s)= Cu2S(s) △H=y kJ∙mol-1
Cu2S(s) △H=y kJ∙mol-1
S(s)+O2(g)=SO2(g) △H=z kJ∙mol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式__________________________ 。
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)⇌2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为_____ 。
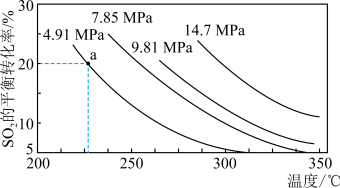
关于该反应,下列说法正确的是____ 。
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中, =
=___ 。
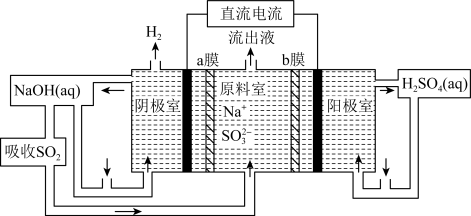
(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为____ 。
(1)SO2是
(2)Cu2S与O2反应可生成SO2,已知:
Cu(s)+
 O2(g)=CuO(s) △H=x kJ∙mol-1
O2(g)=CuO(s) △H=x kJ∙mol-1Cu(s)+
 S(s)=
S(s)= Cu2S(s) △H=y kJ∙mol-1
Cu2S(s) △H=y kJ∙mol-1S(s)+O2(g)=SO2(g) △H=z kJ∙mol-1
写出Cu2S与O2反应生成CuO和SO2的热化学方程式
(3)硫酸工业中涉及反应:2SO2(g)+O2(g)⇌2SO3(g)△H=Q kJ·mol-1。一定条件下,在2L恒容密闭容器中,通入2molSO2和1molO2发生上述反应,SO2的平衡转化率与压强、温度的关系如图所示。a点时此反应的平衡常数的数值为

关于该反应,下列说法正确的是
A.容器内混合气体的密度不再变化时,反应达到平衡
B.相同时间内生成2molSO2同时消耗1molO2,反应达到平衡
C.Q大于0
D.相同温度下,压强越大,SO2的平衡转化率就越大,该反应的平衡常数就越大
E.反应达到平衡后保持温度不变,再充入2molSO2和1molO2,SO2的平衡转化率增大
F.反应达到平衡后保持温度不变,再充入He(g),SO2的平衡转化率增大
(4)将SO2通入酸化的硝酸钡溶液可生成硫酸钡沉淀,25℃时,KSP(BaSO4)=1×10-10。KSP(BaCO3)=2.6×10-9。该温度下,BaSO4和BaCO3沉淀共存的悬浊液中,
 =
=(5)用如图装置回收SO2可制得硫酸,电极为惰性电极,a、b膜分别为阳离子交换膜、阴离子交换膜。阳极的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】氮及其化合物与人们的生活生产密切相关。回答下列问题:
(1)微生物作用下,废水中的NH 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:
Ⅰ步:2 NH (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
Ⅱ步:2NO (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。
则低浓度氨氮废水中的NH (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=___________ kJ/mol。
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g) 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
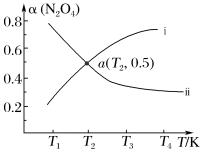
α(N2O4)随温度的变化的正确曲线是___________ (填“i”或“ii”)。若该容器中通入N2O4的起始浓度为2mol/L,则a点温度下的平衡常数K=___________ 。若加入催化剂,图中的曲线会___________ (填“上移”、“下移”或“不移”)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
则反应温度高的容器是___________ (填“甲”或“乙”);甲容器中,0~120 min的速率v(N2)=___________ mol/(L·min),达到化学平衡后,乙容器中各物质均加倍,则平衡向___________ (“正反应”或“逆反应”)方向移动。
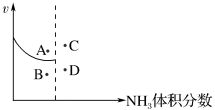
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为___________ (从点“A、B、C、D”中选择)。
(1)微生物作用下,废水中的NH
 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:Ⅰ步:2 NH
 (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/molⅡ步:2NO
 (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。则低浓度氨氮废水中的NH
 (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g)
 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:| t/min | 0 | 40 | 80 | 120 | 160 |
| n甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可合成甲醇,发生的主要反应如下:
I.CO(g)+2H2(g) CH3OH(g) △H1=−129.0 kJ∙mol−1
CH3OH(g) △H1=−129.0 kJ∙mol−1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41 kJ∙mol−1
CO(g)+H2O(g) △H2=+41 kJ∙mol−1
Ⅲ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
回答下列问题:
(1)△H3=______ 。
(2)将2.0molCO2和3.0molH2通入容积为3L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。
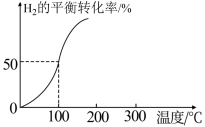
①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用H2表示该反应的平均反应速率为______ 。
②100℃时,反应Ⅱ的平衡常数K=______ 。
③下列可用来判断该反应已达到平衡状态的有______ (填标号)。
A.CO的含量保持不变 B.容器中c(CO2)=c(CO)
C.容器中混合气体的密度保持不变 D.υ正(H2)= υ逆(H2O)
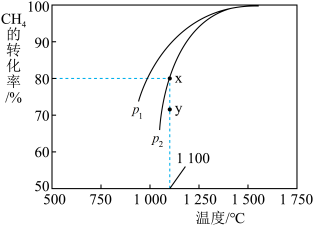
(3)利用天然气制取合成气的原理CO2(g)+CH4(g) 2CO(g)+2H2(g),在密闭容器中通入物质的量浓度均为1 mol∙L−1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则p1
2CO(g)+2H2(g),在密闭容器中通入物质的量浓度均为1 mol∙L−1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则p1______ p2(填“大于”或“小于”);压强为p2时,在Y点:υ正______ υ逆。(填“大于”“小于”“等于”)
I.CO(g)+2H2(g)
 CH3OH(g) △H1=−129.0 kJ∙mol−1
CH3OH(g) △H1=−129.0 kJ∙mol−1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41 kJ∙mol−1
CO(g)+H2O(g) △H2=+41 kJ∙mol−1Ⅲ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3回答下列问题:
(1)△H3=
(2)将2.0molCO2和3.0molH2通入容积为3L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得H2的平衡转化率与温度的关系如图所示。

①100℃时反应达到平衡所需的时间为5min,则反应从起始至5min内,用H2表示该反应的平均反应速率为
②100℃时,反应Ⅱ的平衡常数K=
③下列可用来判断该反应已达到平衡状态的有
A.CO的含量保持不变 B.容器中c(CO2)=c(CO)
C.容器中混合气体的密度保持不变 D.υ正(H2)= υ逆(H2O)
(3)利用天然气制取合成气的原理CO2(g)+CH4(g)
 2CO(g)+2H2(g),在密闭容器中通入物质的量浓度均为1 mol∙L−1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则p1
2CO(g)+2H2(g),在密闭容器中通入物质的量浓度均为1 mol∙L−1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则p1
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】I.下表是某小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用10 mL H2O2制取150 mL O2所需的时间(秒)
(1)该研究小组在设计方案时,考虑了浓度、___________ 、___________ 等因素对过氧化氢分解速率的影响。
II.某反应在体积为5 L的恒温恒容密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A.B、C均为气体,A气体有颜色)。

(2)该反应的化学方程式为___________ 。
(3)反应开始至2分钟时,B的平均反应速率为___________ 。
(4)能说明该反应已达到平衡状态的是___________ 。
A.容器内气体的颜色保持不变
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
(5)由图求得平衡时A的转化率为___________ 。
(6)平衡时体系内的压强是初始时___________ 倍。
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360s | 480s | 540s | 720s |
| MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
II.某反应在体积为5 L的恒温恒容密闭容器中进行,各物质的量随时间的变化情况如图所示(已知A.B、C均为气体,A气体有颜色)。

(2)该反应的化学方程式为
(3)反应开始至2分钟时,B的平均反应速率为
(4)能说明该反应已达到平衡状态的是
A.容器内气体的颜色保持不变
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
(5)由图求得平衡时A的转化率为
(6)平衡时体系内的压强是初始时
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:CH4(g)+H2O(g) CO(g)+3H2(g) △H=x
CO(g)+3H2(g) △H=x
已知:标准状态下,由最稳定的单质生成1mol化合物的焓变,称为该化合物的标准摩尔生成焓,几种物质的标准摩尔生成焓如下。则x=__ kJ·mol-1。(标准摩尔生成焓:CH4(g)-75kJ/mol;H2O(g)-240kJ/mol;CO(g)-110kJ/mol;H2(g)-0kJ/mol)
(2)为了探究温度、压强对反应(1)的影响,在恒温恒容下,向下列三个容器中均充入4molCH4和4molH2O。
①平衡前,容器甲中反应的平均速率 (H2)=
(H2)=__ mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__ (填序号);
A.3v(CH4)正=v(H2)逆 B.CH4和H2O的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
②平衡后,乙容器中CH4的转换率较丙低,其原因是__ ,其中t1__ t2(填“>”、 “<”或“=”)。
(3)pC是指极稀溶液中溶质物质的量浓度的负对数。已知常温下,H2CO3溶液中加入强酸或强碱后达到平衡时溶液中三种成分的pC-pH图,据图分析:

常温下,碳酸的一级电离常数Ka1的数量级为__ ;其中碳酸的Ka1>>Ka2,其原因是__ 。
(4)我国科学家根据反应CO2 C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和
C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__ ;C2O52-在阳极发生电极反应,其方程式为__ 。
(1)已知:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=x
CO(g)+3H2(g) △H=x已知:标准状态下,由最稳定的单质生成1mol化合物的焓变,称为该化合物的标准摩尔生成焓,几种物质的标准摩尔生成焓如下。则x=
(2)为了探究温度、压强对反应(1)的影响,在恒温恒容下,向下列三个容器中均充入4molCH4和4molH2O。
| 容器 | 温度/℃ | 体积/L | CH4平衡浓度/mol·L-1 | 平衡时间/min |
| 甲 | 400 | 1 | 1.5 | 5.0 |
| 乙 | 500 | 1 | x | t1 |
| 丙 | 400 | 2 | y | t2 |
 (H2)=
(H2)=A.3v(CH4)正=v(H2)逆 B.CH4和H2O的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
②平衡后,乙容器中CH4的转换率较丙低,其原因是
(3)pC是指极稀溶液中溶质物质的量浓度的负对数。已知常温下,H2CO3溶液中加入强酸或强碱后达到平衡时溶液中三种成分的pC-pH图,据图分析:

常温下,碳酸的一级电离常数Ka1的数量级为
(4)我国科学家根据反应CO2
 C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和
C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】在化学研究和工业生产中,我们不仅关注化学反应中的物质变化和能量变化,还需要关注化学反应的快慢和进行的程度等。
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
进行反应 ,当生成
,当生成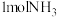 时,将
时,将___________ (填“吸收”或“放出”)___________ kJ的能量。
(2)在体积为5L的恒温密闭容器中,气体X、Y、Z物质的量随时间变化关系曲线如下图所示。
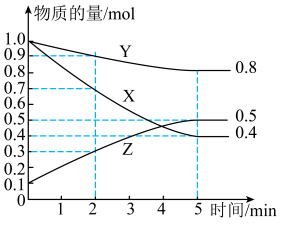
①该反应的化学方程式为:___________ 。
②0-2min内Z的化学反应速率为:___________ 。
③2min时的 与5min时的
与5min时的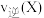 的大小关系为:
的大小关系为:
___________ 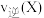 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
④下列描述能表示该反应达平衡状态的是___________ 。
A.Z的体积分数不再改变
B.容器内气体压强不再发生变化
C.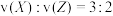
D.容器内混合气体的密度不再发生变化
E.容器内混合气体的平均相对分子质量不再发生变化
(1)断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
| 共价键 |  |  |  |
能量变化/( ) ) | 436.0 | 390.8 | 946.0 |
进行反应
 ,当生成
,当生成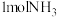 时,将
时,将(2)在体积为5L的恒温密闭容器中,气体X、Y、Z物质的量随时间变化关系曲线如下图所示。

①该反应的化学方程式为:
②0-2min内Z的化学反应速率为:
③2min时的
 与5min时的
与5min时的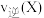 的大小关系为:
的大小关系为:
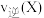 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。④下列描述能表示该反应达平衡状态的是
A.Z的体积分数不再改变
B.容器内气体压强不再发生变化
C.
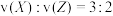
D.容器内混合气体的密度不再发生变化
E.容器内混合气体的平均相对分子质量不再发生变化
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】化学反应原理与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
求2~4min时间段以盐酸的浓度变化来表示的该反应速率为________ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中等体积的下列溶液以减慢反应速率,你认为可行的是________ (填字母)。
A.蒸馏水 B.KNO3溶液 C.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
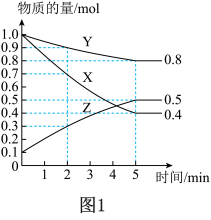
①该反应的化学方程式是_______ 。
②能判断该反应达到平衡状态的标志有_______ (填字母)。
A.Y在混合气体中的体积分数保持不变 B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变 D.生成3molY的同时生成2molZ
③4min时,正反应速率_______ 逆反应速率(填“>”“<”或“=”)。
④5min内Y的转化率为_______ 。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 200 | 480 | 928 | 1152 | 1240 |
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中等体积的下列溶液以减慢反应速率,你认为可行的是
A.蒸馏水 B.KNO3溶液 C.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是
②能判断该反应达到平衡状态的标志有
A.Y在混合气体中的体积分数保持不变 B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变 D.生成3molY的同时生成2molZ
③4min时,正反应速率
④5min内Y的转化率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.25℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如下表。
(1)则该温度下,
___________  ;K3=
;K3=___________ (用 和
和 表示)。
表示)。
Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
___________ (填“>”“<”或“=”)0;
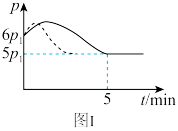
(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是___________ ;
(4)5min时,再充入0.08molNO和0.04mol ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将___________ (填“增大”“减小”或“不变”)。
(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(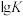 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是___________ (填“甲”或“乙”)。
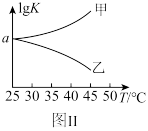
Ⅲ.在300℃下,将 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,
(6)该反应条件下的平衡常数为
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
| 热化学方程式 | 平衡常数 | |
| ① | 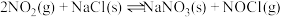 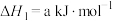 |  |
| ② | 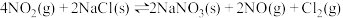 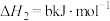 |  |
| ③ |  |  |
(1)则该温度下,

 ;K3=
;K3= 和
和 表示)。
表示)。Ⅱ.完成下列问题
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08molNO和0.04mol
 发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则
发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则

(3)若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是
(4)5min时,再充入0.08molNO和0.04mol
 ,则达平衡后NO的体积分数将
,则达平衡后NO的体积分数将(5)图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(
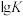 )与温度的变化关系图,其中正确的曲线是
)与温度的变化关系图,其中正确的曲线是
Ⅲ.在300℃下,将
 和
和 按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应
按物质的量之比为1:3通入一恒容密闭容器中,容器压强为8MPa,发生反应 ,达到平衡时,测得
,达到平衡时,测得 的平衡转化率为50%,
的平衡转化率为50%,(6)该反应条件下的平衡常数为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】有以下多种物质,请回答相关问题:
①硫酸钠②氢氧化钡③醋酸④一水合氨⑤次氯酸钠⑦乙醇
(1)上述物质的水溶液显碱性的是___________ 。(填序号)
(2)从显碱性的溶液中任选一种,用化学用语说明其显碱性的原因___________ 。(写表达式)
(3)室温下,配制浓度均为0.1 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。
① ②
② ③
③ ④
④ ⑤
⑤
资料:某些弱酸在25℃时的电离常数如下:
①写出碳酸的第一级电离平衡常数 的计算公式
的计算公式___________ 。
②上述酸中酸性最强的是___________ 。(填化学式)
③25℃时,若次氯酸中初始 的物质的量浓度为0.01
的物质的量浓度为0.01 ,达到电离平衡时溶液中。
,达到电离平衡时溶液中。
___________ (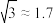 )
)
④下列反应可以发生的是___________ (填字母)。
A.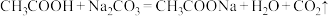
B.
C.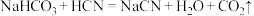
①硫酸钠②氢氧化钡③醋酸④一水合氨⑤次氯酸钠⑦乙醇
(1)上述物质的水溶液显碱性的是
(2)从显碱性的溶液中任选一种,用化学用语说明其显碱性的原因
(3)室温下,配制浓度均为0.1
 的下列五种溶液,请回答问题。
的下列五种溶液,请回答问题。①
 ②
② ③
③ ④
④ ⑤
⑤
资料:某些弱酸在25℃时的电离常数如下:
| 化学式 |  |  |  |  |  |
| 电离常数 |  | 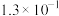 |  |  | 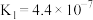  |
 的计算公式
的计算公式②上述酸中酸性最强的是
③25℃时,若次氯酸中初始
 的物质的量浓度为0.01
的物质的量浓度为0.01 ,达到电离平衡时溶液中。
,达到电离平衡时溶液中。
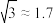 )
)④下列反应可以发生的是
A.
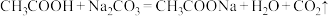
B.

C.
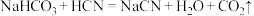
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】Ⅰ.25℃时,部分弱酸的电离平衡常数如下表:
(1)H2S的二级电离平衡常数的表达式为_________ 。
(2)相同c(H+)浓度的HCOOH和HClO溶液中:c(HCOOH)______ c(HClO) (填“>”、“<”或“=”)。
Ⅱ.现将pH=3,体积均为V0的盐酸和醋酸溶液分别加水稀释至体积V,pH随lg( )的变化如图所示。
)的变化如图所示。

(3)醋酸的电离平衡常数表达式为Ka=________ ;加水稀释过程中,醋酸的电离平衡向______ (填“正”或“逆”)反应方向移动,Ka______ 填“增大”“减小”或“不变”)。
(4)比较b、c两点溶液的导电能力强弱:b_______ c(填大于、小于、等于)。
(5)已知HA的电离常数Ka1=4.9×10-10,H2B的电离常数Ka1=4.3×10-7,Ka2=5.6×10-12,试写出NaA与少量H2B反应的离子方程式___________ 。
| 弱酸 | HCOOH | H2S | H2CO3 | HClO |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 |
(2)相同c(H+)浓度的HCOOH和HClO溶液中:c(HCOOH)
Ⅱ.现将pH=3,体积均为V0的盐酸和醋酸溶液分别加水稀释至体积V,pH随lg(
 )的变化如图所示。
)的变化如图所示。
(3)醋酸的电离平衡常数表达式为Ka=
(4)比较b、c两点溶液的导电能力强弱:b
(5)已知HA的电离常数Ka1=4.9×10-10,H2B的电离常数Ka1=4.3×10-7,Ka2=5.6×10-12,试写出NaA与少量H2B反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写)______→_______→F→______→______→______→D。______
(2)操作F中应该选择图中滴定管___________ (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察___________ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为___________ (精确至0.0001)。
(5)下列操作会导致测定结果偏高的是___________。
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10−4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式___________ ,判断滴定终点是___________ 。
(7)已知常温下:
①Ka1(H2CO3)=4.4×10−7,Ka2(H2CO3)=4.7×10−11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱___________ 。
②NaHR溶液中存在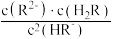 =
=___________ 。
(8)学习小组用50mL 0.50 mol/L NaOH溶液和30mL0.50 mol/L硫酸溶液进行中和热的测定。
①大小烧杯之间填满碎纸条的作用是___________ ,从实验装置上看,图中缺少的一种玻璃仪器___________ 。
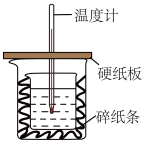
②写出该反应用中和热表示的热化学方程式___________ [中和热测得为57.3kJ/mol。
③实验中若用60mL 0.25mol/L 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________ (填“相等”、“不相等”);若用50mL 0.50 mol/L醋酸代替 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热 的绝对值
的绝对值___________ (填“偏大”、“偏小”、“不受影响)”。

A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写)______→_______→F→______→______→______→D。
(2)操作F中应该选择图中滴定管
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是___________。
| A.碱式滴定管在装液前未用标准NaOH溶液润洗 |
| B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出 |
| C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡 |
| D.达到滴定终点时,仰视读数 |
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20 mL1.0×10−4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式
(7)已知常温下:
①Ka1(H2CO3)=4.4×10−7,Ka2(H2CO3)=4.7×10−11;
②H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH的变化关系如图所示。

①比较H2R、HR-、H2CO3三者的酸性强弱
②NaHR溶液中存在
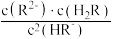 =
=(8)学习小组用50mL 0.50 mol/L NaOH溶液和30mL0.50 mol/L硫酸溶液进行中和热的测定。
①大小烧杯之间填满碎纸条的作用是

②写出该反应用中和热表示的热化学方程式
③实验中若用60mL 0.25mol/L
 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热 的绝对值
的绝对值
您最近一年使用:0次



