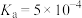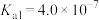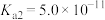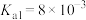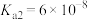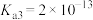我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一、CO2耦合乙苯(C6H5-C2H5,简称EB)脱氢制备苯乙烯(C6H5-C2H3,简称ST)是综合利用CO2的热点研究领域。制备ST涉及的主要反应如下。回答下列问题:
a.EB(g)=ST(g)+H2(g)ΔH1
b.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g)ΔH3=+158.8kJ·mol-1
(1)为提高EB平衡转化率,应选择的反应条件为___________(填标号)。
(2)在一定条件下,选择合适的催化剂只进行b反应:CO2(g)+H2(g) CO(g)+H2O(g)。
CO(g)+H2O(g)。
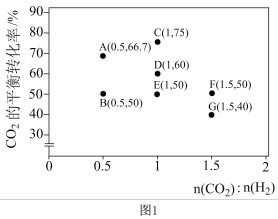
①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图1。已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是___________ 点,计算E点所示的投料比在从起始到平衡的过程中,当CO2转化率达到40%时, =
=___________ 。
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图2所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[H2(g)]的曲线是___________ (填“甲”“乙”“丙”或“丁”);在温度T2、反应时间20min时,反应的正反应速率v正___________ (填“>”“=”或“<”)逆反应速率v逆。
(3)恒压0.1MPa下,改变原料气配比为下列三种情况:仅EB、n(EB)︰n(CO2)=1︰10、n(EB)︰n(N2)=1︰10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图3所示。
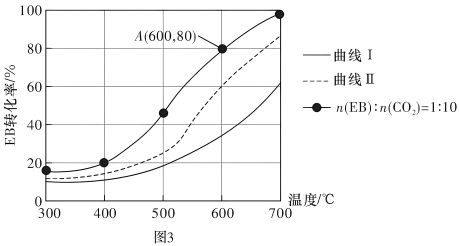
①图3中,表示原料气配比n(EB)︰n(N2)=1︰10的曲线是曲线___________ (填“I”或“Ⅱ”)。
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:___________ 。
③设 为相对压力平衡常数,其表达式写法:
为相对压力平衡常数,其表达式写法: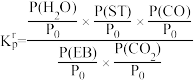 ,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的
,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的 为
为___________ 。
a.EB(g)=ST(g)+H2(g)ΔH1
b.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2=+41.2kJ·mol-1
c.EB(g)+CO2(g)=ST(g)+CO(g)+H2O(g)ΔH3=+158.8kJ·mol-1
(1)为提高EB平衡转化率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
 CO(g)+H2O(g)。
CO(g)+H2O(g)。①调整CO2和H2初始投料比,测得在一定投料比和一定温度下,该反应CO2的平衡转化率如图1。已知:Kx是以物质的量分数表示的化学平衡常数;反应速率v=v正-v逆=k正x(CO2)x(H2)-k逆x(CO)x(H2O),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数。B、E、F三点反应温度最高的是
 =
=
②在容积不变的密闭容器中,分别在温度T1、T2(T2>T1>E点温度)发生上述反应,反应中H2(g)和CO(g)的体积分数(ω)随时间(t)的变化关系如图2所示。已知:起始时密闭容器中ω[CO2(g)]和ω[H2(g)]、ω[CO(g)]和ω[H2O(g)]分别相等。则表示T1时ω[H2(g)]的曲线是

(3)恒压0.1MPa下,改变原料气配比为下列三种情况:仅EB、n(EB)︰n(CO2)=1︰10、n(EB)︰n(N2)=1︰10进行以上a、b反应,测得EB的平衡转化率与温度的变化关系如图3所示。

①图3中,表示原料气配比n(EB)︰n(N2)=1︰10的曲线是曲线
②CO2能显著提高EB的平衡转化率,从平衡移动的角度解释CO2的作用:
③设
 为相对压力平衡常数,其表达式写法:
为相对压力平衡常数,其表达式写法: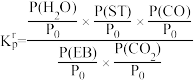 ,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的
,在浓度平衡常数表达式中,用相对分压(分压除以p0,p0=0.1MPa)代替浓度进行计算。A点时,H2的物质的量分数为0.01,该条件下反应a的 为
为
更新时间:2023-09-16 23:04:43
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】(一)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H 1=-49.1 kJ·mol -1
CH3OH(g)+H2O(g) △H 1=-49.1 kJ·mol -1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-24.5 kJ·mol -1
CH3OCH3(g)+H2O(g) △H 2=-24.5 kJ·mol -1
(1)写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________ 。
(2)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________ 。
(3)欲用2LNa2CO3溶液将4.66 g BaSO4 (233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________ 。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp (BaCO3)=1×10 -10]。(忽略溶液体积的变化)
(二)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。
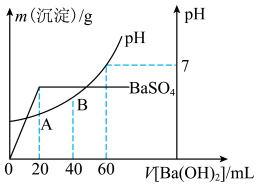
计算:(1)原混合溶液中c(Cl-)=________ 。
(2)A点的pH=________ 。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H 1=-49.1 kJ·mol -1
CH3OH(g)+H2O(g) △H 1=-49.1 kJ·mol -12CH3OH(g)
 CH3OCH3(g)+H2O(g) △H 2=-24.5 kJ·mol -1
CH3OCH3(g)+H2O(g) △H 2=-24.5 kJ·mol -1(1)写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式
(2)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(3)欲用2LNa2CO3溶液将4.66 g BaSO4 (233 g/moL)固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
(二)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。

计算:(1)原混合溶液中c(Cl-)=
(2)A点的pH=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)  H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)  H =
H =_____ kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____ 。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
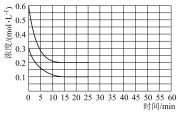
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________ 。

② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______ v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________ 。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______ 。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)  H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)  H =
H =A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式
您最近一年使用:0次
【推荐3】1-丁烯[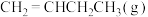 ]为重要的基础化工原料之一,可以利用正丁烷(
]为重要的基础化工原料之一,可以利用正丁烷( )催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
)催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
Ⅰ.无氧催化脱氢反应原理:

(1)已知 、
、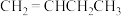 、
、 的燃烧热分别为2878
的燃烧热分别为2878 ,2720
,2720 ,286
,286 ,则
,则
___________  。
。
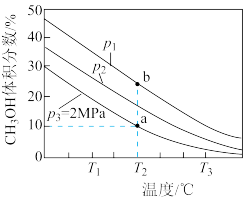
(2)一定温度下,向1L恒容密闭容器中充入1 mol ,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为
,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为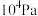 和
和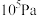 )。
)。___________ (填字母)。
A.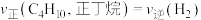 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变
C.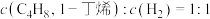 D.容器内气体的总质量保持不变
D.容器内气体的总质量保持不变
②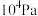 时,表示
时,表示 的曲线是
的曲线是___________ (填图中字母序号,下同),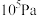 时,表示
时,表示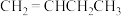 的曲线是
的曲线是___________ 。
Ⅱ.有氧催化脱氢通常选择 或
或 为氧化剂,反应原理如下:
为氧化剂,反应原理如下:
ⅰ.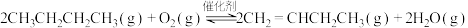
ⅱ.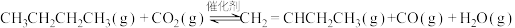
(3)其他条件相同,与无氧脱氢相比,有氧脱氢( 为氧化剂)时,
为氧化剂)时, 的平衡转化率要高一些的可能原因是
的平衡转化率要高一些的可能原因是___________ 。
(4)一定温度和压强下,向初始体积为2L的密闭容器中加入2 mol 、l mol
、l mol  、1 mol
、1 mol  ,同时仅发生反应ⅰ、ⅱ,测得平衡时
,同时仅发生反应ⅰ、ⅱ,测得平衡时 ,体积增大20%,则平衡时
,体积增大20%,则平衡时
①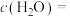
___________  ;
;
②该温度下,反应ⅰ的平衡常数
___________ 。
(5)有氧催化脱氢时,假设上述反应ⅰ和反应ⅱ均有副反应发生。已知 为氧化剂时,
为氧化剂时,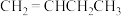 的选择性(生成
的选择性(生成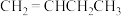 的物质的量与转化的
的物质的量与转化的 的物质的量之比)明显低于
的物质的量之比)明显低于 为氧化剂时的选择性,可能原因是
为氧化剂时的选择性,可能原因是___________ 。
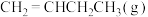 ]为重要的基础化工原料之一,可以利用正丁烷(
]为重要的基础化工原料之一,可以利用正丁烷( )催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
)催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:Ⅰ.无氧催化脱氢反应原理:


(1)已知
 、
、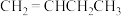 、
、 的燃烧热分别为2878
的燃烧热分别为2878 ,2720
,2720 ,286
,286 ,则
,则
 。
。(2)一定温度下,向1L恒容密闭容器中充入1 mol
 ,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为
,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为 和
和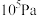 )。
)。
A.
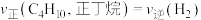 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变C.
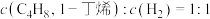 D.容器内气体的总质量保持不变
D.容器内气体的总质量保持不变②
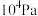 时,表示
时,表示 的曲线是
的曲线是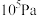 时,表示
时,表示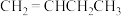 的曲线是
的曲线是Ⅱ.有氧催化脱氢通常选择
 或
或 为氧化剂,反应原理如下:
为氧化剂,反应原理如下:ⅰ.
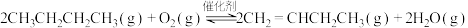
ⅱ.
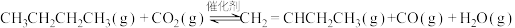
(3)其他条件相同,与无氧脱氢相比,有氧脱氢(
 为氧化剂)时,
为氧化剂)时, 的平衡转化率要高一些的可能原因是
的平衡转化率要高一些的可能原因是(4)一定温度和压强下,向初始体积为2L的密闭容器中加入2 mol
 、l mol
、l mol  、1 mol
、1 mol  ,同时仅发生反应ⅰ、ⅱ,测得平衡时
,同时仅发生反应ⅰ、ⅱ,测得平衡时 ,体积增大20%,则平衡时
,体积增大20%,则平衡时①
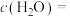
 ;
;②该温度下,反应ⅰ的平衡常数

(5)有氧催化脱氢时,假设上述反应ⅰ和反应ⅱ均有副反应发生。已知
 为氧化剂时,
为氧化剂时,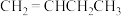 的选择性(生成
的选择性(生成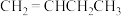 的物质的量与转化的
的物质的量与转化的 的物质的量之比)明显低于
的物质的量之比)明显低于 为氧化剂时的选择性,可能原因是
为氧化剂时的选择性,可能原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】碳的氧化物在金属冶炼、有机合成中有着广泛的应用。回答下列问题:
(1)已知有关热化学方程式如下:
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ΔH =+646kJ·mol-1
则铁在O2中燃烧的热化学方程式为___________ 。
(2)向某密闭实验炉中加入足量Fe2O3(s)、适量的CO(g),控制适当条件使其反应得到Fe(s)、CO2(g),实验表明,无论如何调控反应条件及反应时间,最终混合气体中总会含有一定量的CO(设体积分数为a%),最可能的原因是___________ 。若维持温度不变,再向该容器中充入一定量的CO,经过充分反应,体系中CO的体积分数___________ a%(填“>”、y或“=”)。
(3)在催化剂存在下,反应开始时,向密闭容器中加入6molH2、2molCO2,发生反应:6H2(g)+2CO2(g)⇌CH2=CH2(g)+4H2O(g) ΔH。在恒压(4MPa)下测得CO2的平衡转化率、催化剂催化效率与温度的关系如下图所示。

①该反应的△H___________ 0.(填“>”、“<”或“=”),转化中应将温度控制在___________ ℃较好。
②已知在恒压(4MPa)、恒温(250℃)下,经过10min后反应达到平衡状态,则v(H2)=___________ MPa·min-1(保留到小数点后三位数字)。用气体分压代替浓度计算出的平衡常数用Kp表示,某气体的分压等于总压与其物质的量分数的乘积,则Kp=___________ (列出算式即可)。
(1)已知有关热化学方程式如下:
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g) ΔH =+646kJ·mol-1
则铁在O2中燃烧的热化学方程式为
(2)向某密闭实验炉中加入足量Fe2O3(s)、适量的CO(g),控制适当条件使其反应得到Fe(s)、CO2(g),实验表明,无论如何调控反应条件及反应时间,最终混合气体中总会含有一定量的CO(设体积分数为a%),最可能的原因是
(3)在催化剂存在下,反应开始时,向密闭容器中加入6molH2、2molCO2,发生反应:6H2(g)+2CO2(g)⇌CH2=CH2(g)+4H2O(g) ΔH。在恒压(4MPa)下测得CO2的平衡转化率、催化剂催化效率与温度的关系如下图所示。

①该反应的△H
②已知在恒压(4MPa)、恒温(250℃)下,经过10min后反应达到平衡状态,则v(H2)=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】当今研发二氧化碳利用技术降低空气中二氧化碳含量成了研究热点。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体 ,总反应可表示为:
,总反应可表示为:
 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:
①

②
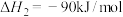
(1)
_______  。
。
(2)一定条件下,向体积为1L的恒容密闭容器中通入1
 和3
和3
 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为a
为a ,
, 为b
为b ,反应①的平衡常数为
,反应①的平衡常数为_______ (用含a,b的代数式表示)。
(3)总反应 在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中,
在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中, 的转化率[
的转化率[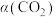 ]随时间(t)的变化曲线如图。活化能:过程Ⅰ
]随时间(t)的变化曲线如图。活化能:过程Ⅰ_______ 过程Ⅱ(填“<”,“>”,“=”), 时刻改变了某一反应条件,下列说法正确的是
时刻改变了某一反应条件,下列说法正确的是_______ 。

A.恒温恒压, 时刻通入惰性气体
时刻通入惰性气体
B.恒温恒容, 时刻通入一定量氢气
时刻通入一定量氢气
C.n点的v(正)一定大于m点的v(逆)
D. 时刻,可能是移走了一部分水蒸气
时刻,可能是移走了一部分水蒸气
Ⅱ.以 和
和 为原料合成尿素[
为原料合成尿素[ ]是固定和利用
]是固定和利用 的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示:
的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示:
反应Ⅰ: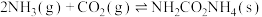

反应Ⅱ:

反应Ⅲ:

(4)某研究小组为探究反应Ⅲ影响 转化率的因素,在其它条件一定时,下图为
转化率的因素,在其它条件一定时,下图为 转化率受温度变化影响的曲线。当温度高于T℃后,
转化率受温度变化影响的曲线。当温度高于T℃后, 转化率变化趋势如图所示,其原因是
转化率变化趋势如图所示,其原因是_______ 。(不考虑催化剂活性变化)

(5)在某恒定温度下,将 和
和 物质的量之比按2:1充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15min达到平衡,各物质浓度的变化曲线下图所示。若保持平衡的温度和体积不变,25min时再向该容器中充入2
物质的量之比按2:1充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15min达到平衡,各物质浓度的变化曲线下图所示。若保持平衡的温度和体积不变,25min时再向该容器中充入2
 和1
和1
 ,在40min时重新达到平衡,请在下图中画出25-50min内
,在40min时重新达到平衡,请在下图中画出25-50min内 的浓度变化趋势曲线
的浓度变化趋势曲线_______ 。
Ⅰ.二氧化碳催化加氢制甲醇,有利于减少温室气体
 ,总反应可表示为:
,总反应可表示为:
 。该反应一般认为通过如下步骤来实现:
。该反应一般认为通过如下步骤来实现:①


②

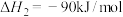
(1)

 。
。(2)一定条件下,向体积为1L的恒容密闭容器中通入1

 和3
和3
 发生上述反应,达到平衡时,容器中
发生上述反应,达到平衡时,容器中 为a
为a ,
, 为b
为b ,反应①的平衡常数为
,反应①的平衡常数为(3)总反应
 在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中,
在Ⅰ、Ⅱ两种不同催化剂作用下建立平衡过程中, 的转化率[
的转化率[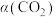 ]随时间(t)的变化曲线如图。活化能:过程Ⅰ
]随时间(t)的变化曲线如图。活化能:过程Ⅰ 时刻改变了某一反应条件,下列说法正确的是
时刻改变了某一反应条件,下列说法正确的是
A.恒温恒压,
 时刻通入惰性气体
时刻通入惰性气体B.恒温恒容,
 时刻通入一定量氢气
时刻通入一定量氢气C.n点的v(正)一定大于m点的v(逆)
D.
 时刻,可能是移走了一部分水蒸气
时刻,可能是移走了一部分水蒸气Ⅱ.以
 和
和 为原料合成尿素[
为原料合成尿素[ ]是固定和利用
]是固定和利用 的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示:
的成功范例。在尿素合成塔中的主要反应(均自发进行)可表示:反应Ⅰ:
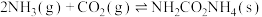

反应Ⅱ:


反应Ⅲ:


(4)某研究小组为探究反应Ⅲ影响
 转化率的因素,在其它条件一定时,下图为
转化率的因素,在其它条件一定时,下图为 转化率受温度变化影响的曲线。当温度高于T℃后,
转化率受温度变化影响的曲线。当温度高于T℃后, 转化率变化趋势如图所示,其原因是
转化率变化趋势如图所示,其原因是
(5)在某恒定温度下,将
 和
和 物质的量之比按2:1充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15min达到平衡,各物质浓度的变化曲线下图所示。若保持平衡的温度和体积不变,25min时再向该容器中充入2
物质的量之比按2:1充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计且只发生反应Ⅰ),经15min达到平衡,各物质浓度的变化曲线下图所示。若保持平衡的温度和体积不变,25min时再向该容器中充入2
 和1
和1
 ,在40min时重新达到平衡,请在下图中画出25-50min内
,在40min时重新达到平衡,请在下图中画出25-50min内 的浓度变化趋势曲线
的浓度变化趋势曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】甲烷及其衍生物在国民经济中有着重要的作用。
I.
(1)工业上甲烷可用于制造合成气,常温常压下其反应为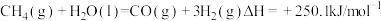 。
。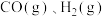 的燃烧热依次为
的燃烧热依次为 。常温常压下,
。常温常压下,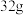 甲烷完全燃烧生成液态水放出的热量为
甲烷完全燃烧生成液态水放出的热量为_______  。
。
(2)天然气制氢气是工业制氢气的主要方法之一,其主要反应如下:
i.
ii.
在一定温度下,恒容的密闭容器中加入 CH4和
CH4和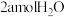 发生反应,
发生反应, min时反应达平衡。下列可判断体系达到平衡状态的是_______。
min时反应达平衡。下列可判断体系达到平衡状态的是_______。
II.工业上还可以用催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
(3) ,在恒容的密闭容器中不同温度下发生该反应,
,在恒容的密闭容器中不同温度下发生该反应,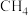 的浓度变化如图所示,下列说法正确的是_______(填序号)。
的浓度变化如图所示,下列说法正确的是_______(填序号)。

III. 也是一种重要的化工原料,用煤化工生产中产生的
也是一种重要的化工原料,用煤化工生产中产生的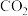 和
和 制取
制取 的反应为:
的反应为: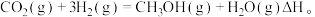
已知相关物质的化学键键能数据如下表所示(视 与
与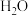 中
中 键的键能相等):
键的键能相等):
(4)
_______  。(用含字母的代数式表示)
。(用含字母的代数式表示)
(5)将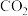 和
和 按物质的量之比为
按物质的量之比为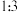 通入某刚性密闭容器中,只发生反应
通入某刚性密闭容器中,只发生反应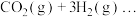
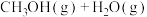 ,平衡状态时
,平衡状态时 的体积分数与温度、气体总压强的关系如图所示。
的体积分数与温度、气体总压强的关系如图所示。
 从大到小的顺序是
从大到小的顺序是_______ 。温度为 、气体总压强为
、气体总压强为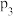 的条件下,反应达到平衡时
的条件下,反应达到平衡时 的转化率为
的转化率为_______ , 点的平衡常数
点的平衡常数 =
=_______ 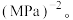 (
( 结果保留2位有效数字;已知:混合气体中某组分的分压
结果保留2位有效数字;已知:混合气体中某组分的分压 总压
总压 该组分的物质的量分数,
该组分的物质的量分数, 总
总 )
)
(6)用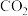 与
与 制备
制备 时有副产物
时有副产物 生成。其他条件相同时,测得不同温度下
生成。其他条件相同时,测得不同温度下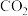 平衡转化率及含碳生成物的选择性数据如下表:
平衡转化率及含碳生成物的选择性数据如下表:
制备 的适宜温度为
的适宜温度为_______ ,理由是_______ 。
I.
(1)工业上甲烷可用于制造合成气,常温常压下其反应为
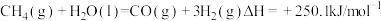 。
。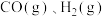 的燃烧热依次为
的燃烧热依次为 。常温常压下,
。常温常压下,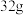 甲烷完全燃烧生成液态水放出的热量为
甲烷完全燃烧生成液态水放出的热量为 。
。(2)天然气制氢气是工业制氢气的主要方法之一,其主要反应如下:
i.

ii.

在一定温度下,恒容的密闭容器中加入
 CH4和
CH4和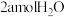 发生反应,
发生反应, min时反应达平衡。下列可判断体系达到平衡状态的是_______。
min时反应达平衡。下列可判断体系达到平衡状态的是_______。A. 的体积分数不变 的体积分数不变 | B.容器内气体密度不变 |
C.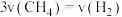 | D. 不再变化 不再变化 |
II.工业上还可以用催化还原
 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。(3)
 ,在恒容的密闭容器中不同温度下发生该反应,
,在恒容的密闭容器中不同温度下发生该反应,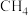 的浓度变化如图所示,下列说法正确的是_______(填序号)。
的浓度变化如图所示,下列说法正确的是_______(填序号)。
A. 大于 大于 |
B.c点时二氧化碳的浓度为 |
C.a点正反应速率大于 点的逆反应速率 点的逆反应速率 |
D. 点的反应速率一定比 点的反应速率一定比 点的反应速率小 点的反应速率小 |
III.
 也是一种重要的化工原料,用煤化工生产中产生的
也是一种重要的化工原料,用煤化工生产中产生的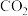 和
和 制取
制取 的反应为:
的反应为: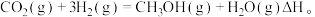
已知相关物质的化学键键能数据如下表所示(视
 与
与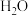 中
中 键的键能相等):
键的键能相等):化学键 | C=O | H-H | C-O | H-O | C-H |
| E/(kJ∙mol-1) | a | b | c | d | e |

 。(用含字母的代数式表示)
。(用含字母的代数式表示)(5)将
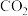 和
和 按物质的量之比为
按物质的量之比为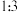 通入某刚性密闭容器中,只发生反应
通入某刚性密闭容器中,只发生反应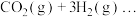
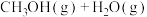 ,平衡状态时
,平衡状态时 的体积分数与温度、气体总压强的关系如图所示。
的体积分数与温度、气体总压强的关系如图所示。
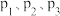 从大到小的顺序是
从大到小的顺序是 、气体总压强为
、气体总压强为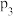 的条件下,反应达到平衡时
的条件下,反应达到平衡时 的转化率为
的转化率为 点的平衡常数
点的平衡常数 =
=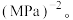 (
( 结果保留2位有效数字;已知:混合气体中某组分的分压
结果保留2位有效数字;已知:混合气体中某组分的分压 总压
总压 该组分的物质的量分数,
该组分的物质的量分数, 总
总 )
)(6)用
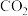 与
与 制备
制备 时有副产物
时有副产物 生成。其他条件相同时,测得不同温度下
生成。其他条件相同时,测得不同温度下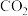 平衡转化率及含碳生成物的选择性数据如下表:
平衡转化率及含碳生成物的选择性数据如下表:| T/℃ | CO2的平衡转化率/% | 选择性/% | |
| CO | CH3OH | ||
| 230 | 12.83 | 47.75 | 52.25 |
| 250 | 17.63 | 36.22 | 63.77 |
| 270 | 15.96 | 59.78 | 40.22 |
 的适宜温度为
的适宜温度为
您最近一年使用:0次
【推荐1】回答下列问题:
(1)泡沫灭火器(里面装饱和 溶液和
溶液和 溶液)的工作原理(用离子方程式表示)
溶液)的工作原理(用离子方程式表示)______ 。
(2) 是一种无色气体,遇到空气能发生爆炸性自燃,生成
是一种无色气体,遇到空气能发生爆炸性自燃,生成 固体和
固体和 。已知室温下2g
。已知室温下2g 自燃放出热量89.2kJ,该反应的热化学方程式为:
自燃放出热量89.2kJ,该反应的热化学方程式为:______ 。
(3)氨基甲酸铵 是合成尿素的一种中间产物。已知某温度下,往一密闭容器中加入a mol
是合成尿素的一种中间产物。已知某温度下,往一密闭容器中加入a mol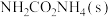 ,反应
,反应 在45min时达到平衡,
在45min时达到平衡,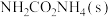 的平衡转化率为45%,此时容器容积为V L,则该温度下此反应的平衡常数为
的平衡转化率为45%,此时容器容积为V L,则该温度下此反应的平衡常数为______ (用含a、V的式子表示)。
(4)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
①向 溶液中加入少量的
溶液中加入少量的 溶液反应的离子方程式是
溶液反应的离子方程式是______ 。
② 的
的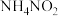 溶液中离子浓度大小关系是
溶液中离子浓度大小关系是______ 。
(1)泡沫灭火器(里面装饱和
 溶液和
溶液和 溶液)的工作原理(用离子方程式表示)
溶液)的工作原理(用离子方程式表示)(2)
 是一种无色气体,遇到空气能发生爆炸性自燃,生成
是一种无色气体,遇到空气能发生爆炸性自燃,生成 固体和
固体和 。已知室温下2g
。已知室温下2g 自燃放出热量89.2kJ,该反应的热化学方程式为:
自燃放出热量89.2kJ,该反应的热化学方程式为:(3)氨基甲酸铵
 是合成尿素的一种中间产物。已知某温度下,往一密闭容器中加入a mol
是合成尿素的一种中间产物。已知某温度下,往一密闭容器中加入a mol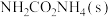 ,反应
,反应 在45min时达到平衡,
在45min时达到平衡,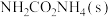 的平衡转化率为45%,此时容器容积为V L,则该温度下此反应的平衡常数为
的平衡转化率为45%,此时容器容积为V L,则该温度下此反应的平衡常数为(4)25℃时,部分弱碱、弱酸的电离平衡常数如下表:
弱酸 |
|
|
|
|
电离平衡常数(25℃) |
|
|
|
|
 溶液中加入少量的
溶液中加入少量的 溶液反应的离子方程式是
溶液反应的离子方程式是②
 的
的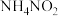 溶液中离子浓度大小关系是
溶液中离子浓度大小关系是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】将 应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为
应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为 。
。
回答下列问题:
(1)如图为 平衡转化率和温度、压强的关系,其中压强分别为
平衡转化率和温度、压强的关系,其中压强分别为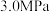 、4.0MPa和5.0MPa。
、4.0MPa和5.0MPa。________ (填“放热”或“吸热”)。设 的初始浓度为
的初始浓度为 ,根据
,根据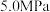 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数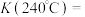
________ (列出计算式即可)。若在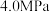 时减小投料比
时减小投料比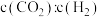 ,则
,则 的平衡转化率曲线可能位于Ⅱ线的
的平衡转化率曲线可能位于Ⅱ线的________ (填“上方”或“下方”)。实际工业生产中往往按照化学计量比进料,原因是________ (任写一点)。
(2)已知: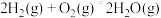
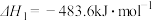 ;
;

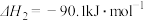 ;
;

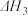 。
。
利用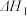 和
和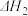 计算
计算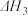 时,还需要知道反应
时,还需要知道反应________ (填方程式)的 。
。
(3)一定温度下,下列措施一定能加快反应 的速率的是
的速率的是________ (填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(4)电解法制取有广泛用途的 ,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。阳极区的电极反应式为
,镍电极有气泡产生。阳极区的电极反应式为________ ,当铁电极质量减少11.2g时,镍电极产生气体的体积为________ L(标准状况)。
 应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为
应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为 。
。回答下列问题:
(1)如图为
 平衡转化率和温度、压强的关系,其中压强分别为
平衡转化率和温度、压强的关系,其中压强分别为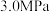 、4.0MPa和5.0MPa。
、4.0MPa和5.0MPa。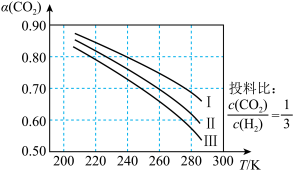
 的初始浓度为
的初始浓度为 ,根据
,根据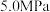 时的数据计算该反应的平衡常数
时的数据计算该反应的平衡常数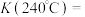
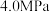 时减小投料比
时减小投料比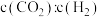 ,则
,则 的平衡转化率曲线可能位于Ⅱ线的
的平衡转化率曲线可能位于Ⅱ线的(2)已知:
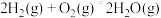
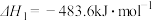 ;
;
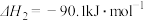 ;
;
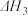 。
。利用
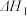 和
和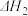 计算
计算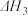 时,还需要知道反应
时,还需要知道反应 。
。(3)一定温度下,下列措施一定能加快反应
 的速率的是
的速率的是A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(4)电解法制取有广泛用途的
 ,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,同时获得氢气,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。阳极区的电极反应式为
,镍电极有气泡产生。阳极区的电极反应式为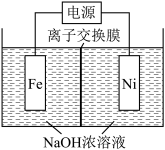
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】将甲烷转化为既可作为液体燃料又可用作化工基本原料的甲醇,具有广泛的应用前景以及重要的经济价值和社会意义。甲烷部分氧化反应主要有气固相催化氧化、液相催化氧化等。回答下列问题:
(1)科研人员对O2直接将CH4氧化为甲醇的气固相催化体系进行了多年探索,在密闭容器中充入2molCH4和1molO2,在不同条件下发生反应:2CH4(g)+O2(g) 2CH3OH(g),平衡时甲醇的物质的量随温度、压强的变化如图所示,根据图象填空。
2CH3OH(g),平衡时甲醇的物质的量随温度、压强的变化如图所示,根据图象填空。
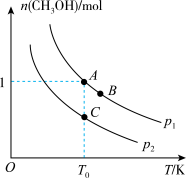
①p1_______ p2(选填“>”、“<”或“=”),该反应的△H_______ 0(选填“>”或“<”)。
②A、B、C点对应的化学反应速率由大到小的顺序为_______ 。[用v(A)、v(B)、v(C)表示]
③若A点,n(CH3OH)=1mol,总压强为2.5MPa,则T0时A点用分压强代替浓度表示的平衡常数Kp=_______ 。
(2)CH4在102%发烟硫酸溶剂中以配合物Pt(bpym)Cl2为催化剂的气液相催化体系,能达到较大的CH4转化率及选择性,原理为:CH4先转化为CH3OSO3H(CH4+H2SO4+SO3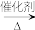 CH3OSO3H+H2SO4+SO2),SO2再与O2生成H2SO4,CH3OSO3H再水解生成甲醇,写出该水解反应的方程式:
CH3OSO3H+H2SO4+SO2),SO2再与O2生成H2SO4,CH3OSO3H再水解生成甲醇,写出该水解反应的方程式:_______ 。Pt(bpym)Cl2成本昂贵,HgSO4也可以作为该反应的催化剂,且催化活性及稳定性较好,HgSO4的突出缺点是_______ 。
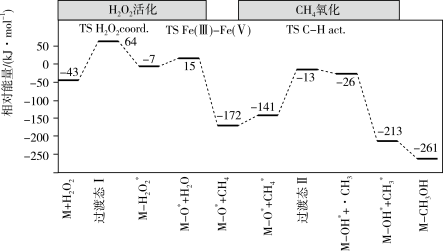
(3)Osadchi等合成了Fe/MIL-53催化剂,并用于H2O2催化氧化甲烷合成甲醇的研究(CH4+H2O2 CH3OH+H2O),反应历程如图所示,其中催化剂用M表示,•CH3为甲基自由基,结合在催化剂表面上的物质或基团用*标注。该历程中“H2O2活化”与“CH4氧化”较难发生的是
CH3OH+H2O),反应历程如图所示,其中催化剂用M表示,•CH3为甲基自由基,结合在催化剂表面上的物质或基团用*标注。该历程中“H2O2活化”与“CH4氧化”较难发生的是_______ ,试解释你的理由_______ 。
(1)科研人员对O2直接将CH4氧化为甲醇的气固相催化体系进行了多年探索,在密闭容器中充入2molCH4和1molO2,在不同条件下发生反应:2CH4(g)+O2(g)
 2CH3OH(g),平衡时甲醇的物质的量随温度、压强的变化如图所示,根据图象填空。
2CH3OH(g),平衡时甲醇的物质的量随温度、压强的变化如图所示,根据图象填空。
①p1
②A、B、C点对应的化学反应速率由大到小的顺序为
③若A点,n(CH3OH)=1mol,总压强为2.5MPa,则T0时A点用分压强代替浓度表示的平衡常数Kp=
(2)CH4在102%发烟硫酸溶剂中以配合物Pt(bpym)Cl2为催化剂的气液相催化体系,能达到较大的CH4转化率及选择性,原理为:CH4先转化为CH3OSO3H(CH4+H2SO4+SO3
 CH3OSO3H+H2SO4+SO2),SO2再与O2生成H2SO4,CH3OSO3H再水解生成甲醇,写出该水解反应的方程式:
CH3OSO3H+H2SO4+SO2),SO2再与O2生成H2SO4,CH3OSO3H再水解生成甲醇,写出该水解反应的方程式:(3)Osadchi等合成了Fe/MIL-53催化剂,并用于H2O2催化氧化甲烷合成甲醇的研究(CH4+H2O2
 CH3OH+H2O),反应历程如图所示,其中催化剂用M表示,•CH3为甲基自由基,结合在催化剂表面上的物质或基团用*标注。该历程中“H2O2活化”与“CH4氧化”较难发生的是
CH3OH+H2O),反应历程如图所示,其中催化剂用M表示,•CH3为甲基自由基,结合在催化剂表面上的物质或基团用*标注。该历程中“H2O2活化”与“CH4氧化”较难发生的是
您最近一年使用:0次