Ⅰ.利用
 催化加氢制二甲醚,可以实现
催化加氢制二甲醚,可以实现 的再利用,涉及以下主要反应:
的再利用,涉及以下主要反应:ⅰ.
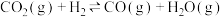
ⅱ.

相关物质及能量变化如图1:
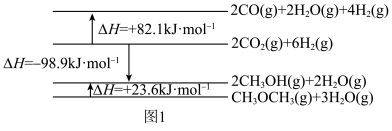
(1)反应ⅱ的

(2)恒压条件下,当
 、
、 起始量相等时,平衡时,
起始量相等时,平衡时, 的转化率和
的转化率和 的选择性随温度变化如图2。已知:
的选择性随温度变化如图2。已知: 的选择性
的选择性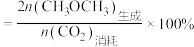 。
。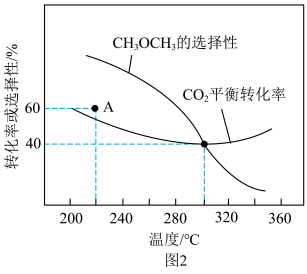
①220°C时,
 和
和 反应一段时间后,测得A点
反应一段时间后,测得A点 的选择性为60%,不改变反应时间和温度,能提高
的选择性为60%,不改变反应时间和温度,能提高 的选择性的措施有
的选择性的措施有②300°C后,
 的选择性下降,
的选择性下降, 的平衡转化率上升,原因是
的平衡转化率上升,原因是③300°C时,通入
 、
、 各1 mol,若只考虑反应ⅰ、ⅱ,平衡时
各1 mol,若只考虑反应ⅰ、ⅱ,平衡时 的选择性、
的选择性、 的平衡转化率均为40%,平衡时生成
的平衡转化率均为40%,平衡时生成 的物质的量为
的物质的量为
Ⅱ.
 直接催化加氢生成甲酸是实现碳中和的另一种途径,在纳米金催化剂上,
直接催化加氢生成甲酸是实现碳中和的另一种途径,在纳米金催化剂上, 直接催化加氢生成甲酸。其反应历程如图3,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。
直接催化加氢生成甲酸。其反应历程如图3,其中吸附在催化剂表面上的物质用*标注,TS为过渡态。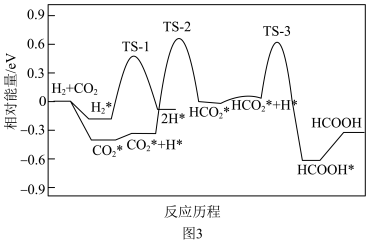
(3)①该历程中决速步骤的化学方程式是
②催化剂Au的晶胞结构如图4,若以一个Au原子为中心,其周围最多有
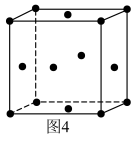
相似题推荐
 )既是一种有机燃料,又是一种重要的有机化工原料。利用
)既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下;
催化氢化制备二甲醚的反应原理如下;Ⅰ.


Ⅱ.
Ⅲ.


回答下列问题;
(1)

(2)向起始温度为T℃的某绝热恒容密闭容器中充入2mol
 (g),只发生反应Ⅲ,平衡时
(g),只发生反应Ⅲ,平衡时 的转化率为
的转化率为 。
。①下列事实能说明反应Ⅲ已经达到平衡的是
A.混合气体的密度不再发生变化 B.容器内混合气体的压强不再发生变化
C.
 的消耗速率等于
的消耗速率等于 的消耗速率 D.
的消耗速率 D. 的体积分数不再发生变化
的体积分数不再发生变化②若向起始温度为T℃的该绝热恒容密闭容器中充入
 (g)和
(g)和 (g)各1mol,平衡时
(g)各1mol,平衡时 的转化率为
的转化率为 ,则
,则
③在有催化剂存在的条件下,反应Ⅲ的反应过程如图1所示,吸附在催化剂表面上的物种用“*”标注。该反应过程的决速步骤为

 反应制取二甲醚,反应原理为
反应制取二甲醚,反应原理为
△H。一定条件下,将
 和CO按投料比
和CO按投料比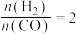 通入1L反应器中发生该反应,其中CO的平衡转化率随温度、压强的变化关系如图2所示(催化剂在320℃左右时的活性最大)。
通入1L反应器中发生该反应,其中CO的平衡转化率随温度、压强的变化关系如图2所示(催化剂在320℃左右时的活性最大)。 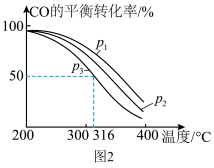
②实际生产中,当温度选择为316℃时,采用的压强为
 ,而不采用
,而不采用 ,原因是
,原因是(4)高温时二甲醚蒸气发生分解反应:
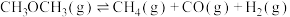 。迅速将二甲醚引入一个500℃的抽成真空的恒温恒容的密闭瓶中,在不同时刻测得的瓶内气体压强
。迅速将二甲醚引入一个500℃的抽成真空的恒温恒容的密闭瓶中,在不同时刻测得的瓶内气体压强 如下表所示。
如下表所示。t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
②500℃时,该反应的平衡常数

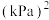 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 转化为高附加值化学品成为科学家研究的重要课题。异丁烯
转化为高附加值化学品成为科学家研究的重要课题。异丁烯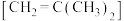 作为汽油添加剂的主要成分,可利用异丁烷与
作为汽油添加剂的主要成分,可利用异丁烷与 反应来制备。
反应来制备。反应Ⅰ:

反应Ⅱ:
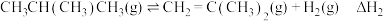
反应Ⅲ:
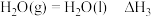
回答下列问题:
(1)已知:异丁烷、异丁烯、
 的燃烧热热化学方程式的焓变分别为
的燃烧热热化学方程式的焓变分别为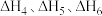 ,则
,则
(2)向
 恒容密闭容器中加入
恒容密闭容器中加入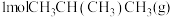 和
和 ,利用反应Ⅰ制备异丁烯。已知
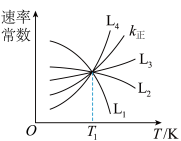
,利用反应Ⅰ制备异丁烯。已知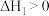 ;正反应速率表示为
;正反应速率表示为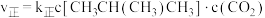 ,逆反应速率表示为
,逆反应速率表示为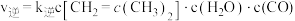 ,其中
,其中 、
、 为速率常数。
为速率常数。①图中能够代表
 的曲线为
的曲线为 ”“
”“ ”“
”“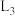 ”或“
”或“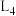 ”)。
”)。
②温度为
 时,该反应化学平衡常数
时,该反应化学平衡常数
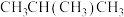 转化率
转化率(3)
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,反应为:
利用技术,反应为: 。在
。在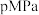 时,将
时,将 和
和 按物质的量之比为
按物质的量之比为 充入密闭容器中,分别在无催化剂及
充入密闭容器中,分别在无催化剂及 催化下反应相同时间,测得
催化下反应相同时间,测得 的转化率与温度的关系如图所示:
的转化率与温度的关系如图所示:
①a点时有催化剂和无催化剂的
 转化率相等的原因是
转化率相等的原因是②在
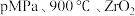 催化条件下,将
催化条件下,将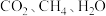 按物质的量之比为
按物质的量之比为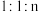 充入密闭容器,
充入密闭容器, 的平衡转化率为a,此时平衡常数
的平衡转化率为a,此时平衡常数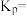
(4)相比于反应Ⅱ直接脱氢,有人提出加入适量空气。采用异丁烷氧化脱氢的方法制备异丁烯,发生反应
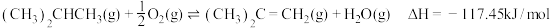 ,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是
,相比于异丁烷直接脱氢制备丁烯更好。从产率角度分析该方法的优点是(5)利用电化学可以将
 有效转化为
有效转化为 ,装置如图所示(忽略电解前后溶液的体积变化):
,装置如图所示(忽略电解前后溶液的体积变化):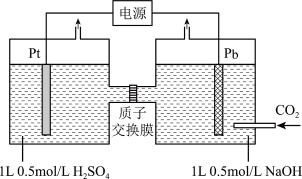
①已知:电解效率
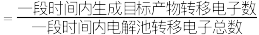 。装置工作时,阴极除有
。装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为 时,测得整个阴极区内的
时,测得整个阴极区内的 ,电解效率为
,电解效率为②研究表明,溶液
 会影响
会影响 转化为
转化为 的效率。如图是
的效率。如图是 (以
(以 计)在水溶液中各种存在形式的物质的量分数δ随
计)在水溶液中各种存在形式的物质的量分数δ随 变化的情况。
变化的情况。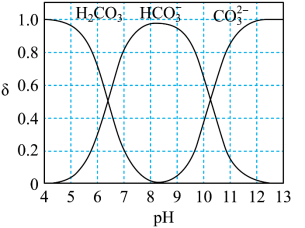
 时,
时, 的转化效率较高,溶液中相应的电极反应式为
的转化效率较高,溶液中相应的电极反应式为
sabatior反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g)
CH4(g)+2H2O(g)水电解反应:2H2O(l)
 2H2(g) + O2(g)
2H2(g) + O2(g)(1)将原料气按nCO2∶nH2=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
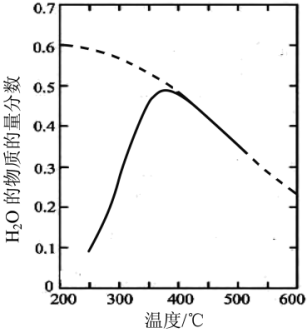
①已知H2(g)、CH4(g)的燃烧热分别为A kJ/mol、BkJ/mol, H2O(l)=H2O(g) △H =C kJ/mol。计算Sabatier反应的△H=
②温度过高或过低均不利于该反应的进行,原因是
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化效率的是
A.适当减压 B.增大催化剂的比表面积
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
E.合理控制反应器中气体的流速
(3) 一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)
 C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。在250℃,向体积为2L且带气压计的恒容密闭容器中通入0.08molH2和0.04molCO2发生Bosch 反应CO2(g)+2H2(g)
 C(s)+2H2O(g) △ H
C(s)+2H2O(g) △ H①若反应起始和平衡时温度相同(均为250℃),测得反应过程中压强(P)随时间(t)的变化如图I 曲线a所示,则△H
②图II是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是

③Bosch反应必须在高温下才能启动,原因是
(1)CO2催化加氢制CH4是CO2的有机资源转化途径之一、
反应I:
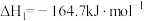
反应Ⅱ:

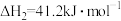
①反应:
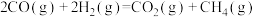


②在密闭容器中,1.01×105Pa、n起始(CO2)∶n起始(H2)=1∶4时,CO2平衡转化率、在催化剂作用下反应相同时间所测得的CO2实际转化率随温度的变化如图所示。CO2的平衡转化率在600℃之后随温度升高而增大的主要原因是
(2)金属锰分解水原位还原CO2产生甲酸是CO2有机资源转化新途径。锰与水反应生成MnO与活性氢原子,MnO结合活性氢原子形成中间体Q;
 吸附到具有催化活性中间体Q后被活化产生甲酸的部分机理如图所示。
吸附到具有催化活性中间体Q后被活化产生甲酸的部分机理如图所示。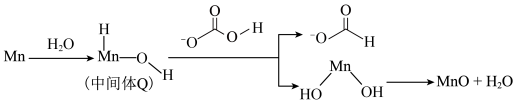
①从电负性角度描述中间体Q与
 生成
生成 的过程:
的过程:②实验中将锰粉、碳酸氢钠和去离子水添加到反应器中,反应一段时间后产生甲酸的速率迅速上升的原因可能是
(3)电催化还原法是CO2的有机资源化的研究热点。控制其他条件相同,将一定量的CO2通入盛有酸性溶液的电催化装置中,CO2可转化为有机物,阴极所得产物及其物质的量与电压的关系如图所示。
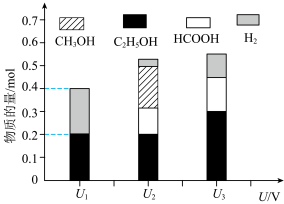
①电解电压为U1时,电解时转移电子的物质的量为
②电解电压为U2时,阴极由CO2生成甲醇的电极反应式为
③在实际生产中发现当pH过低时,有机物产率降低,可能的原因是
Ⅰ.电解法制氢:甲醇电解可制得H2,其原理如图所示。
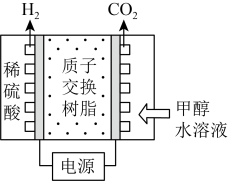
Ⅱ.催化重整法制氢
(2)已知
反应1:CH3OH(g)
 CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1
CO(g)+2H2(g)ΔH1=+90.6kJ·mol-1反应2:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH2=-41.2kJ·mol-1反应3:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1
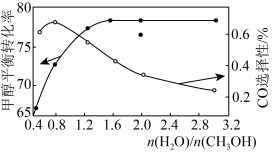
CO2(g)+3H2(g)ΔH3=+49.4kJ·mol-1以CuOZnOAl2O3为催化剂进行甲醇重整制氢时,固定其他条件不变,改变水、甲醇的物质的量比,甲醇平衡转化率及CO选择性的影响如图所示。
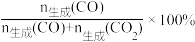 ]
]①当水、甲醇比大于0.8时,CO选择性下降的原因是
②当水、甲醇比一定时,温度升高,CO选择性有所上升,可能原因是
(3)铜基催化剂(Cu/CeO2)能高效进行甲醇重整制氢,但因原料中的杂质或发生副反应生成的物质会使催化剂失活。
①甲醇中混有少量的甲硫醇(CH3SH),重整制氢时加入ZnO可有效避免铜基催化剂失活,其原理用化学方程式表示为
②将失活的铜基催化剂分为两份,第一份直接在氢气下进行还原,第二份先在空气中高温煅烧后再进行氢气还原。结果只有第二份催化剂活性恢复。说明催化剂失活的另外可能的原因是
(4)在PtPd合金表面上甲醇与水蒸气重整反应的机理如图所示(“*”表示此微粒吸附在催化剂表面,M为反应过程中的中间产物)。
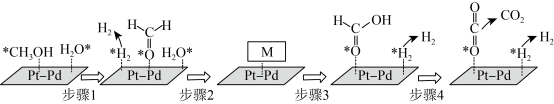
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),酸性K2Cr2O7溶液可将这种碳纳米颗粒氧化为无毒气体而除去,该反应的还原产物为Cr3+,请写出相应的离子方程式:
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO (g) + 2H2 (g)
 CH3OH (g) ΔH1=-116 kJ·mol-1
CH3OH (g) ΔH1=-116 kJ·mol-1 ①下列措施中可增大H2的平衡转化率的是
A.升高反应温度 B.增大体系压强
C.使用高效催化剂 D.及时将CH3OH与反应混合物分离
②向2L的恒容密闭容器中充入1mol CO和2mol H2,进行上述反应,5min后达到平衡状态,此时体系的压强变为原来的 。则此段时间v(H2)=
。则此段时间v(H2)=
③已知:
2CO (g) + O2 (g)  2CO2 (g) ΔH2=-566 kJ·mol-1
2CO2 (g) ΔH2=-566 kJ·mol-1
2H2 (g) + O2 (g)  2H2O (g) ΔH3=-484 kJ·mol-1
2H2O (g) ΔH3=-484 kJ·mol-1
则气态甲醇燃烧生成CO2和水蒸气时的热化学方程式为
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
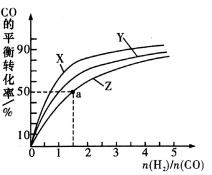
请回答:
ⅰ.在上述三种温度中,曲线Z对应的温度是
ⅱ.利用图中a点对应的数据,计算出曲线Z在对应温度下
CO (g) + 2H2 (g) CH3OH (g)的平衡常数K的值为 =
CH3OH (g)的平衡常数K的值为 =
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为
(1)与汽油、煤炭相比,氢气作为燃料的优点是:
(2)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图所示:
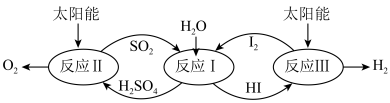
相关反应的热化学方程式为
反应Ⅰ:
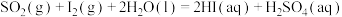
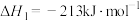
反应Ⅱ:
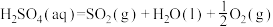
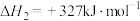
反应Ⅲ:

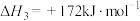
则反应
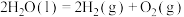

(3)利用水煤气转化法制氢涉及的反应如下:
反应Ⅰ:


反应Ⅱ:


反应Ⅱ在不同进气比[
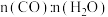 ]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。
]、不同温度下,测得相应的CO平衡转化率见下表(各点对应的其他反应条件都相同)。| 平衡点 | a | b | c | d |
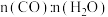 | 0.5 | 0.5 | 1 | 1 |
| CO平衡转化率/% | 50 | 66.7 | 50 | 80 |
a点平衡混合物中CO的体积分数为
(4)一种“分步法电解制氢气”的装置如图。该方法制氢气分两步,第一步在惰性电极产生
 ,
,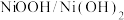 电极发生氧化反应;第二步在另一个惰性电极产生
电极发生氧化反应;第二步在另一个惰性电极产生 。
。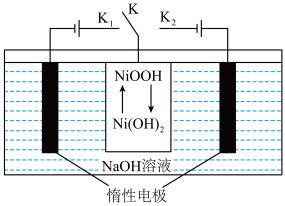
①第一步反应时,开关K应该连接
 ”或“
”或“ ”)。
”)。②第二步反应时,
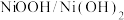 发生的电极反应方程式:
发生的电极反应方程式: 、
、 )和氮的氢化物都有广泛的用途,如:
)和氮的氢化物都有广泛的用途,如: 和
和 可作为运载火箭的推进剂。
可作为运载火箭的推进剂。(1)已知:

 。现将2mol
。现将2mol  放入1L恒容密闭容器中,平衡体系中
放入1L恒容密闭容器中,平衡体系中 的体积分数(
的体积分数( )随温度的变化如图所示。
)随温度的变化如图所示。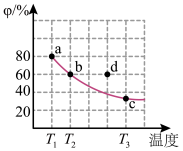
②a、b、c三点中平衡常数
 、
、 、
、 由小到大是
由小到大是③在
 时,
时, 的平衡转化率为
的平衡转化率为
(2)NO氧化为
 的反应为:
的反应为: ,该反应分如下两步进行:
,该反应分如下两步进行:Ⅰ.

 (较快)
(较快)Ⅱ.

 (较慢)
(较慢)在恒容的密闭容器中充入一定量的NO和
 ,保持其它条件不变,控制反应温度分别为
,保持其它条件不变,控制反应温度分别为 和
和 ,c(NO)随t(时间)的变化如图所示。
,c(NO)随t(时间)的变化如图所示。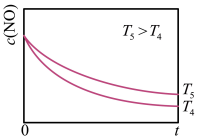
 条件下转化的NO量
条件下转化的NO量 条件下转化的NO量,其本质原因是
条件下转化的NO量,其本质原因是(3)肼除了可作火箭的推进剂外,还可用于新型环保电池中,电池工作原理如图所示。
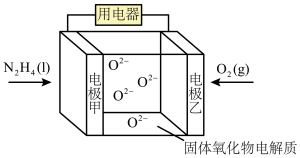
 向
向②该电池的负极反应式为
(1)1962年,化学家巴特利特合成了氙的第一个化合物
 ,其在熔化时电离出
,其在熔化时电离出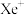 和
和 。Xe和
。Xe和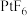 混合制得
混合制得 的反应可以表示如下:
的反应可以表示如下:
 )和1mol气态阴离子(
)和1mol气态阴离子( )所需要的能量叫做晶格能,
)所需要的能量叫做晶格能, 的晶格能为
的晶格能为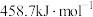 。
。②Xe的第一电离能为
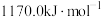 。
。③

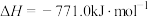 。
。根据以上信息,计算反应
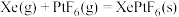

 。
。(2)不久,在三个不同实验室里又分别合成了
 、
、 、
、 三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,
三种简单化合物。其中一种化合物的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°, 表示阿伏伽德罗常数的值。则该化合物的化学式为
表示阿伏伽德罗常数的值。则该化合物的化学式为
 混合气体,反应体系中存在的平衡及相应部分数据如下表所示。
混合气体,反应体系中存在的平衡及相应部分数据如下表所示。已知:分压=总压×该组分物质的量分数;
对于反应
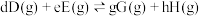
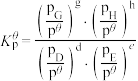
其中
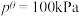 ,
,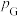 、
、 、
、 、
、 为各组分的平衡分压。
为各组分的平衡分压。标准压强平衡常数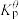 反应平衡 | 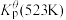 | 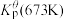 |
反应I: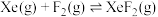  | 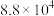 | 360 |
反应II: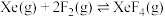  | ||
反应III:  | 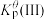 |

 的含量,应
的含量,应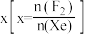 (填“增大”或“减小”)。
(填“增大”或“减小”)。②673K时充入23.77molXe和
 ,达平衡时容器内总压强
,达平衡时容器内总压强 ,各产物的物质的量如下表所示:
,各产物的物质的量如下表所示:| 化学式 |  |  |  |
| 物质的量/mol | 3.60 | 19.80 | 0.36 |
 平衡转化率
平衡转化率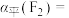
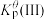
已知:
①
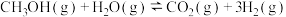
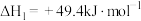
②


回答下列问题:
(1)甲醇裂解制氢的反应为
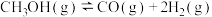

(2)一定温度下,
 增大,甲醇重整制氢反应中CH3OH的平衡转化率
增大,甲醇重整制氢反应中CH3OH的平衡转化率(3)在一定温度下,向恒容密闭容器内通入一定量的
 ,发生甲醇裂解制氢反应,反应前测得容器内的压强为100
,发生甲醇裂解制氢反应,反应前测得容器内的压强为100 ,反应后测得容器内的压强为140
,反应后测得容器内的压强为140 ,该反应的压强平衡常数
,该反应的压强平衡常数
(4)在一定温度下,向2L恒容密闭容器中加入
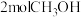 和
和 发生反应①②,平衡时
发生反应①②,平衡时 为
为 、
、 为
为 ,
, 的物质的量浓度是
的物质的量浓度是(5)甲醇重整制氢过程中,
 的选择性
的选择性 ,一定温度和压强下,选择合适的条件,降低
,一定温度和压强下,选择合适的条件,降低 的选择性的原因可能是
的选择性的原因可能是(6)将
 的原料气以相同速率通过装有不同催化剂的反应器,
的原料气以相同速率通过装有不同催化剂的反应器, 的转化率随催化剂的使用时常的变化如图所示。
的转化率随催化剂的使用时常的变化如图所示。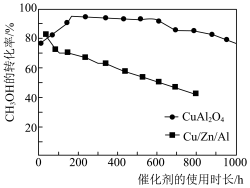
催化剂
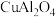 与催化剂
与催化剂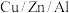 相比,优点有
相比,优点有(7)已知阿伦尼乌斯公式为
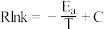 (
( 为活化能,k为速率常数,R和C为常数),催化剂
为活化能,k为速率常数,R和C为常数),催化剂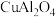 、
、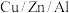 的催化效能
的催化效能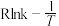 ,图像如图所示。图中直线
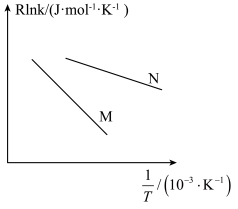
,图像如图所示。图中直线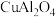 。
。
Ⅰ.氮氧化物的研究
(1)一定条件下,将
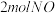 与
与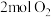 置于恒容密闭容器中发生反应:
置于恒容密闭容器中发生反应: ,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。
,下列状态能说明该反应达到化学平衡的是_______(填字母编号)。| A.混合气体的密度保持不变 | B.NO的转化率保持不变 |
C.NO和 的物质的量之比保持不变 的物质的量之比保持不变 | D. 的消耗速率和 的消耗速率和 的消耗速率相等 的消耗速率相等 |
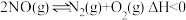 ,在不同条件时
,在不同条件时 的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线
的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线 表示的是
表示的是A.压强B.温度C.催化剂
根据图2中的能量变化数据,计算反应
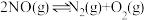 的
的
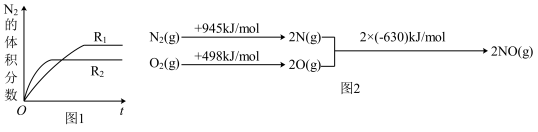
Ⅱ.碳氧化物研究
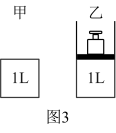
(3)图3甲为恒温恒容装置,乙为恒温恒压装置。已知CO和
 在一定条件下可以合成甲醇:
在一定条件下可以合成甲醇: 。
。
相同温度下,将
 和
和 分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲
分别通入体积为1L的图3甲、乙装置中,一段时间后均达到平衡,此时CO的转化率:甲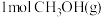 ,重新达到平衡后,
,重新达到平衡后, 在体系中的百分含量
在体系中的百分含量 )可以净化空气、改善环境,是环境保护的主要课题。
)可以净化空气、改善环境,是环境保护的主要课题。(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.
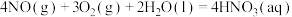

ⅱ.


ⅲ.



 。
。(2)2.00g甲烷气体完全燃烧,生成
 和液态
和液态 ,放出111.2kJ的热量,写出表示甲烷燃烧热的热化学方程式:
,放出111.2kJ的热量,写出表示甲烷燃烧热的热化学方程式:Ⅱ.

 是制备硫酸的重要反应。将
是制备硫酸的重要反应。将 与
与 放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时
放入2L的密闭容器中,在一定条件下反应5min达到平衡,测得平衡时 的浓度为
的浓度为 。
。(3)用
 表示的平均速率为
表示的平均速率为 的转化率为
的转化率为(4)写出该反应的化学平衡常数表达式

(5)若不改变反应温度和反应物中
 的起始浓度,使
的起始浓度,使 的平衡转化率达到90%,则
的平衡转化率达到90%,则 的起始浓度为
的起始浓度为 。
。(6)若保持体系温度、体积不变,若往相同的密闭容器中加入
 、
、 和
和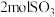 ,则达化学平衡时
,则达化学平衡时 的浓度为
的浓度为 。
。



