试运用所学知识,研究CO等气体的性质,请回答:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g) 2CO(g) ΔH1;
2CO(g) ΔH1;
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;
③C(s)+ H2O(g) CO(g)+ H2(g) ΔH3;
CO(g)+ H2(g) ΔH3;
反应③的平衡常数表达式为K=___________ ;上述反应中ΔH1、ΔH2、ΔH3之间的关系为ΔH3=___________ 。
(2)在一定体积的密闭容器中,进行反应②: CO(g)+H2O(g) H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______
H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______
(3)不同温度下反应②的平衡常数如下表所示。则ΔH2___________ 0(填“<”“>”);
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为___________ 。
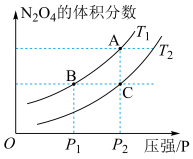
(4)对于反应2NO2(g) N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1
N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1___________ T2(填“>”或“<”);增大压强,平衡向___________ 反应方向移动;B、C两点的平衡常数B___________ C(填“>”或“<”)。
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)
 2CO(g) ΔH1;
2CO(g) ΔH1; ②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;③C(s)+ H2O(g)
 CO(g)+ H2(g) ΔH3;
CO(g)+ H2(g) ΔH3;反应③的平衡常数表达式为K=
(2)在一定体积的密闭容器中,进行反应②: CO(g)+H2O(g)
 H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______
H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是______| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
(3)不同温度下反应②的平衡常数如下表所示。则ΔH2
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)对于反应2NO2(g)
 N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1
N2O4(g) ΔH<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1
23-24高三上·广东汕头·阶段练习 查看更多[3]
更新时间:2023-09-29 12:38:29
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
【推荐1】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为__________ 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的△H3__________ 0(填“>”、“<”或“=”)。

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右下图所示。下列说法正确的是__________ (填字母代号)。

E.升高温度将使n(CH3OH)/n(CO2)减小
③直接甲醇燃料电池结构如右下图所示。其工作时正极的电极反应式可表
示为____________ 。

(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:________________________ ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)__________ c(NO3-)+c(OH-)(填写“>”“=”或“<”)
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇的反应的△H3

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右下图所示。下列说法正确的是

| A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5 mol/L |
| B.0~10 min内,氢气的平均反应速率[为0.075 mol/(L·min) |
| C.达到平衡时,氢气的转化率为0.75 |
D.该温度下,反应的平衡常数的值为 |
③直接甲醇燃料电池结构如右下图所示。其工作时正极的电极反应式可表
示为

(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】氢能是一种极具发展潜力的清洁能源。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
(2)氢能是一种极具发展潜力的清洁能源,图中是一种以太阳能为热源,高效无污染的制氢方法。
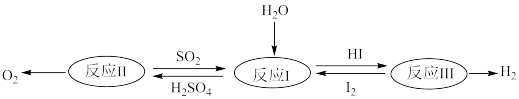
该过程实现了太阳能向_____ 能的转化,反应I的化学方程式为______ 。
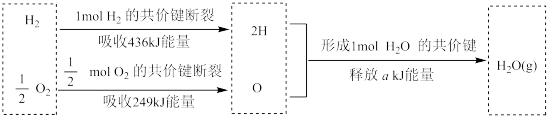
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是____ ,计算a=_____ 。
(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+ O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2
C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系___________ 。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
| A.氢燃料电池中H2在正极反应,O2在负极反应 |
| B.理论上氢能源汽车使用时不会产生污染物 |
| C.氢燃料电池可以将化学能完全转化为电能 |
| D.水分解产生氢气的同时放出热量供汽车使用 |

该过程实现了太阳能向
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是

(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+
 O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐3】乙烯是重要的基础化工原料,工业上利用乙烷脱氢制乙烯的相关反应如下:
反应Ⅰ: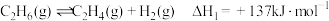
反应Ⅱ:
(1)反应 的
的
_______  。
。
(2)以 和
和 的混合气体为起始投料(
的混合气体为起始投料( 不参与反应),保持混合气体总物质的量不变,在恒容的容器中对反应Ⅰ进行研究。下列说法正确的是_______。
不参与反应),保持混合气体总物质的量不变,在恒容的容器中对反应Ⅰ进行研究。下列说法正确的是_______。
(3)科研人员研究催化剂对乙烷无氧脱氢的影响
①在一定条件下, 催化乙烷脱氢转化为乙烯的反应历程如图所示,该历程的各步反应中,生成下列物质速率最慢的是
催化乙烷脱氢转化为乙烯的反应历程如图所示,该历程的各步反应中,生成下列物质速率最慢的是_______ 。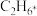 B.
B.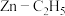 C.
C.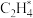 D.
D.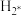
②用 基催化剂研究
基催化剂研究 催化脱氢,该催化剂对
催化脱氢,该催化剂对 键和
键和 键的断裂均有高活性,易形成碳单质。一定温度下,
键的断裂均有高活性,易形成碳单质。一定温度下, 基催化剂在短时间内会失活,其失活的原因是
基催化剂在短时间内会失活,其失活的原因是_______ 。
(4)在 和催化剂条件下,向体积固定的容器中充入
和催化剂条件下,向体积固定的容器中充入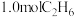 与一定量
与一定量 发生反应(忽略反应Ⅰ和反应Ⅱ外的其它反应),平衡时
发生反应(忽略反应Ⅰ和反应Ⅱ外的其它反应),平衡时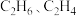 和
和 的物质的量分数随起始投料比
的物质的量分数随起始投料比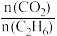 的变化关系如图所示。
的变化关系如图所示。 ,表示
,表示 的曲线为
的曲线为_______ (填“a”或“b”),判断依据是_______ 。
②当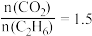 时,平衡时体系压强为P,计算反应Ⅰ的平衡常数
时,平衡时体系压强为P,计算反应Ⅰ的平衡常数
_______ (写出计算过程,结果保留2位有效数字;对于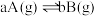 ,
,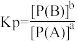 ,
, )。
)。
反应Ⅰ:
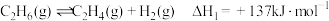
反应Ⅱ:

(1)反应
 的
的
 。
。(2)以
 和
和 的混合气体为起始投料(
的混合气体为起始投料( 不参与反应),保持混合气体总物质的量不变,在恒容的容器中对反应Ⅰ进行研究。下列说法正确的是_______。
不参与反应),保持混合气体总物质的量不变,在恒容的容器中对反应Ⅰ进行研究。下列说法正确的是_______。| A.升高温度,正、逆反应速率同时增大 |
B.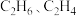 和 和 的物质的量相等时,反应达到平衡状态 的物质的量相等时,反应达到平衡状态 |
C.增加起始投料时 的体积分数,单位体积的活化分子数增加 的体积分数,单位体积的活化分子数增加 |
D.增加起始投料时 的体积分数, 的体积分数, 平衡转化率增大 平衡转化率增大 |
①在一定条件下,
 催化乙烷脱氢转化为乙烯的反应历程如图所示,该历程的各步反应中,生成下列物质速率最慢的是
催化乙烷脱氢转化为乙烯的反应历程如图所示,该历程的各步反应中,生成下列物质速率最慢的是
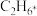 B.
B.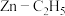 C.
C.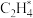 D.
D.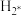
②用
 基催化剂研究
基催化剂研究 催化脱氢,该催化剂对
催化脱氢,该催化剂对 键和
键和 键的断裂均有高活性,易形成碳单质。一定温度下,
键的断裂均有高活性,易形成碳单质。一定温度下, 基催化剂在短时间内会失活,其失活的原因是
基催化剂在短时间内会失活,其失活的原因是(4)在
 和催化剂条件下,向体积固定的容器中充入
和催化剂条件下,向体积固定的容器中充入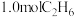 与一定量
与一定量 发生反应(忽略反应Ⅰ和反应Ⅱ外的其它反应),平衡时
发生反应(忽略反应Ⅰ和反应Ⅱ外的其它反应),平衡时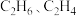 和
和 的物质的量分数随起始投料比
的物质的量分数随起始投料比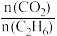 的变化关系如图所示。
的变化关系如图所示。
 ,表示
,表示 的曲线为
的曲线为②当
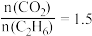 时,平衡时体系压强为P,计算反应Ⅰ的平衡常数
时,平衡时体系压强为P,计算反应Ⅰ的平衡常数
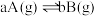 ,
,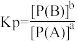 ,
, )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】Ⅰ.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如表,回答下列问题:
(1)实验①②研究的是______ 对化学反应速率的影响,V1=______ 。
(2)实验①③研究的是______ 对化学反应速率的影响,V2=______ 。
(3)t1、t2、t3由大到小的顺序是______ 。
Ⅱ.炼铁高炉中存在可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
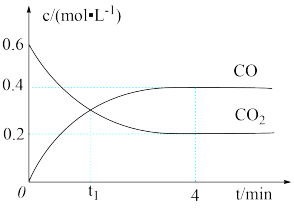
(4)t1时,反应是否达到化学平衡?______ (填“是”或“否”);4min时,正反应速率______ (填“>”“<”或“=”)逆反应速率。
(5)CO2的平衡转化率为______ (保留三位有效数字)。
(6)下列叙述能说明上述反应已达平衡的是______ (填序号)。
| 实验序号 | 反应温度 | 加入0.1mol/LNa2S2O3溶液的体积 | 加入0.1mol/LH2SO4溶液的体积 | 加入水的体积 | 出现浑浊的时间 |
| ℃ | mL | mL | mL | s | |
| ① | 20 | 2 | 2 | 0 | t1 |
| ② | 40 | 2 | V1 | 0 | t2 |
| ③ | 20 | 1 | 2 | V2 | t3 |
(2)实验①③研究的是
(3)t1、t2、t3由大到小的顺序是
Ⅱ.炼铁高炉中存在可逆反应Fe(s)+CO2(g)
 FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
(4)t1时,反应是否达到化学平衡?
(5)CO2的平衡转化率为
(6)下列叙述能说明上述反应已达平衡的是
| A.反应速率:v(CO2)=v(CO) |
| B.单位时间内生成nmolCO2的同时生成nmolCO |
| C.容器中混合气体的总压强不随时间变化而变化 |
| D.容器中混合气体的密度不随时间变化而变化 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】综合利用化石燃料,提高利用率,有助于实现“碳达峰、碳中和”。回答下列问题:
Ⅰ.利用 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
①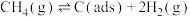
②
上述反应中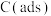 为吸附活性炭,反应历程的能量变化如图所示:
为吸附活性炭,反应历程的能量变化如图所示:
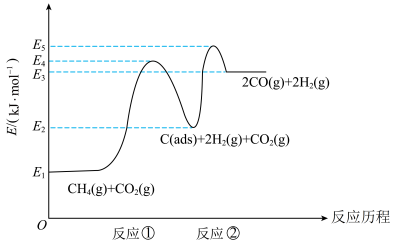
(1) 干重整反应的热化学方程式为
干重整反应的热化学方程式为_______ (选用 、
、 、
、 、
、 、
、 的关系式表示反应热),反应Ⅱ是
的关系式表示反应热),反应Ⅱ是_______ (填“慢”或“快”)反应。
(2)在恒压条件下,等物质的量的 和
和 发生干重整反应时,各物质的平衡转化率随温度变化如图所示。已知在干重整中还发生了副反应:
发生干重整反应时,各物质的平衡转化率随温度变化如图所示。已知在干重整中还发生了副反应:
 ,则表示
,则表示 平衡转化率的是曲线
平衡转化率的是曲线_______ (填“A”或“B”)。

Ⅱ.在一密闭容器中,通入1 mol 和3 mol
和3 mol  发生甲烷的水蒸气重整反应。甲烷的水蒸气重整涉及以下反应:
发生甲烷的水蒸气重整反应。甲烷的水蒸气重整涉及以下反应:
③
④
(3)如图1所示,压强为 kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中
kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中 的物质的量,原因是
的物质的量,原因是_______ 。

(4)500℃时,反应相同时间后测得 的转化率随压强的变化如图2所示。则图中E点和G点
的转化率随压强的变化如图2所示。则图中E点和G点 的浓度大小关系为
的浓度大小关系为
_______  (填“>”“<”或“=”),结合两图中的相关数据,计算此温度下反应③的压强平衡常数
(填“>”“<”或“=”),结合两图中的相关数据,计算此温度下反应③的压强平衡常数
_______ 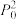 (用分压代替浓度,分压=总压×物质的量分数,计算结果用分数表示即可)。
(用分压代替浓度,分压=总压×物质的量分数,计算结果用分数表示即可)。
Ⅰ.利用
 干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:
干重整反应不仅可以对天然气资源综合利用,还可以缓解温室效应对环境的影响。该反应一般认为通过如下步骤来实现:①
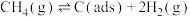
②

上述反应中
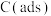 为吸附活性炭,反应历程的能量变化如图所示:
为吸附活性炭,反应历程的能量变化如图所示:
(1)
 干重整反应的热化学方程式为
干重整反应的热化学方程式为 、
、 、
、 、
、 、
、 的关系式表示反应热),反应Ⅱ是
的关系式表示反应热),反应Ⅱ是(2)在恒压条件下,等物质的量的
 和
和 发生干重整反应时,各物质的平衡转化率随温度变化如图所示。已知在干重整中还发生了副反应:
发生干重整反应时,各物质的平衡转化率随温度变化如图所示。已知在干重整中还发生了副反应:
 ,则表示
,则表示 平衡转化率的是曲线
平衡转化率的是曲线
Ⅱ.在一密闭容器中,通入1 mol
 和3 mol
和3 mol  发生甲烷的水蒸气重整反应。甲烷的水蒸气重整涉及以下反应:
发生甲烷的水蒸气重整反应。甲烷的水蒸气重整涉及以下反应:③

④

(3)如图1所示,压强为
 kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中
kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中 的物质的量,原因是
的物质的量,原因是
(4)500℃时,反应相同时间后测得
 的转化率随压强的变化如图2所示。则图中E点和G点
的转化率随压强的变化如图2所示。则图中E点和G点 的浓度大小关系为
的浓度大小关系为
 (填“>”“<”或“=”),结合两图中的相关数据,计算此温度下反应③的压强平衡常数
(填“>”“<”或“=”),结合两图中的相关数据,计算此温度下反应③的压强平衡常数
 (用分压代替浓度,分压=总压×物质的量分数,计算结果用分数表示即可)。
(用分压代替浓度,分压=总压×物质的量分数,计算结果用分数表示即可)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】《自然》杂志报道,科学家设计出了“空气燃料实验系统”,其过程分三步:
第一步,利用太阳能收集空气中的 和
和 ;
;
第二步,在太阳能作用下将 和
和 转化成合成气(CO、H2);
转化成合成气(CO、H2);
第三步,利用合成气合成液态烃和甲醇。
Ⅰ.模拟制备合成气的装置如图所示。
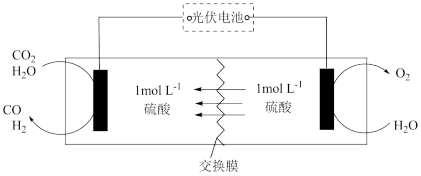
回答下列问题:
(1)交换膜是_______ (填“阴离子”或“阳离子”)交换膜。b极是_______ (填“正极”或“负极”)。
Ⅱ.利用合成气合成甲醇、甲烷等。已知:
反应ⅰ:
反应ⅱ:
(2)在 和一定温度下,由最稳定单质生成
和一定温度下,由最稳定单质生成 纯物质的热效应,称为该物质的标准生成热(
纯物质的热效应,称为该物质的标准生成热(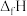 )。相关物质的标准生成热数据如表所示:
)。相关物质的标准生成热数据如表所示:

_______  。
。
(3)在某温度、催化剂作用下,仅发生反应ⅱ,该反应的速率方程为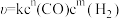 (k为速率常数,与温度、催化剂有关,与浓度无关)。测得速率与CO、H2的浓度关系如表所示:
(k为速率常数,与温度、催化剂有关,与浓度无关)。测得速率与CO、H2的浓度关系如表所示:
下列推断正确的是_______ (填标号)。
A. B.
B. C.其他条件不变,升高温度,速率增大
C.其他条件不变,升高温度,速率增大
(4)在一定温度下,向某恒容密闭容器中充入CO和H2,仅发生反应ⅰ,测得平衡体系中 的体积分数
的体积分数 与
与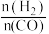 的关系如图1所示。
的关系如图1所示。

在a、b、c三点中,CO的平衡转化率最大的是_______ 。(填标号)
(5)向1L恒容密闭容器中充入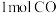 和
和 ,在催化剂作用下同时发生反应ⅰ和反应ⅱ,测得产物甲醇、甲烷的选择性(甲醇或甲烷的物质的量占两者总物质的量的百分数)与温度的关系如图2所示。
,在催化剂作用下同时发生反应ⅰ和反应ⅱ,测得产物甲醇、甲烷的选择性(甲醇或甲烷的物质的量占两者总物质的量的百分数)与温度的关系如图2所示。

①当温度高于 时,该催化剂选择性较大的产物是
时,该催化剂选择性较大的产物是_______ 。(填化学式)
② 时反应达到平衡,此时
时反应达到平衡,此时 ,
, 的选择性为80%,则该温度下反应ⅰ的平衡常数K=
的选择性为80%,则该温度下反应ⅰ的平衡常数K=_______ 。(结果取整数)
第一步,利用太阳能收集空气中的
 和
和 ;
;第二步,在太阳能作用下将
 和
和 转化成合成气(CO、H2);
转化成合成气(CO、H2);第三步,利用合成气合成液态烃和甲醇。
Ⅰ.模拟制备合成气的装置如图所示。

回答下列问题:
(1)交换膜是
Ⅱ.利用合成气合成甲醇、甲烷等。已知:
反应ⅰ:

反应ⅱ:

(2)在
 和一定温度下,由最稳定单质生成
和一定温度下,由最稳定单质生成 纯物质的热效应,称为该物质的标准生成热(
纯物质的热效应,称为该物质的标准生成热(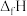 )。相关物质的标准生成热数据如表所示:
)。相关物质的标准生成热数据如表所示:| 物质 |  |  |  |  |  |
 | 0 | −75 | −110 | −201 | −242 |

 。
。(3)在某温度、催化剂作用下,仅发生反应ⅱ,该反应的速率方程为
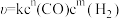 (k为速率常数,与温度、催化剂有关,与浓度无关)。测得速率与CO、H2的浓度关系如表所示:
(k为速率常数,与温度、催化剂有关,与浓度无关)。测得速率与CO、H2的浓度关系如表所示:| 实验 |  |  | 速率 |
| Ⅰ | 0.10 | 0.10 | υ |
| Ⅱ | 0.20 | 0.10 | 2υ |
| Ⅲ | 0.20 | 0.20 | 8υ |
| Ⅳ | 0.40 | x | 36υ |
下列推断正确的是
A.
 B.
B. C.其他条件不变,升高温度,速率增大
C.其他条件不变,升高温度,速率增大(4)在一定温度下,向某恒容密闭容器中充入CO和H2,仅发生反应ⅰ,测得平衡体系中
 的体积分数
的体积分数 与
与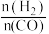 的关系如图1所示。
的关系如图1所示。
在a、b、c三点中,CO的平衡转化率最大的是
(5)向1L恒容密闭容器中充入
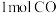 和
和 ,在催化剂作用下同时发生反应ⅰ和反应ⅱ,测得产物甲醇、甲烷的选择性(甲醇或甲烷的物质的量占两者总物质的量的百分数)与温度的关系如图2所示。
,在催化剂作用下同时发生反应ⅰ和反应ⅱ,测得产物甲醇、甲烷的选择性(甲醇或甲烷的物质的量占两者总物质的量的百分数)与温度的关系如图2所示。
①当温度高于
 时,该催化剂选择性较大的产物是
时,该催化剂选择性较大的产物是②
 时反应达到平衡,此时
时反应达到平衡,此时 ,
, 的选择性为80%,则该温度下反应ⅰ的平衡常数K=
的选择性为80%,则该温度下反应ⅰ的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐1】在2L密闭容器中,800°C时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:

(1)A点处,v(正)_______ v (逆),A点正反应速率_______ B点正反应速率(用“大于”、“小于”或“等于”填空);
(2)图中表示O2变化的曲线是_______ ;
(3)能说明该反应已经达到平衡状态的是_______;
(4)能使该反应的反应速率增大的是_______。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)A点处,v(正)
(2)图中表示O2变化的曲线是
(3)能说明该反应已经达到平衡状态的是_______;
| A.NO、O2、NO2的浓度不变 | B.v(NO)=2v(O2) |
| C.NO、O2、NO2的分子数之比为2:1 :2 | D.v逆(NO2) =2v正(O2) |
| A.适当升高温度 | B.及时分离出NO2气体 |
| C.减小O2的浓度 | D.选择高效的催化剂 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】化学反应中的物质和能量变化,化学反应的快慢和程度,都是认识和研究化学反应的重要视角。回答下列有关问题:
Ⅰ.某兴趣小组同学设计了如图所示装置。

(1)开关K闭合后,该装置可以将化学能转化为_______ (填能量类型)。
(2)开关K闭合前,可以观察到的现象是_______ ,其原因是_______ (用化学方程式表示);开关K闭合后,可以观察到有气体生成的电极是_______ (填“Mg”或“Al”)电极,该电极的反应式为_______ 。
Ⅱ.为探究合成氨反应进行的速率和限度,在一定温度下,向容积为1L的恒容密闭容器中充入1mol 和3mol
和3mol ,并加入少量催化剂,测定不同时间内该容器中
,并加入少量催化剂,测定不同时间内该容器中 ,实验数据如下表:
,实验数据如下表:
(3)8min内,
_______  ;平衡时,
;平衡时, 的转化率为
的转化率为_______ 。
(4)下列选项中可以判断反应达到限度的是_______(填字母)。
Ⅰ.某兴趣小组同学设计了如图所示装置。

(1)开关K闭合后,该装置可以将化学能转化为
(2)开关K闭合前,可以观察到的现象是
Ⅱ.为探究合成氨反应进行的速率和限度,在一定温度下,向容积为1L的恒容密闭容器中充入1mol
 和3mol
和3mol ,并加入少量催化剂,测定不同时间内该容器中
,并加入少量催化剂,测定不同时间内该容器中 ,实验数据如下表:
,实验数据如下表:| t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
 | 0 | 0.5 | 0.85 | 1.02 | 1.16 | 1.2 | 1.2 |

 ;平衡时,
;平衡时, 的转化率为
的转化率为(4)下列选项中可以判断反应达到限度的是_______(填字母)。
A. | B. 不变 不变 |
| C.容器内压强不变 | D.容器内气体密度不变 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】Ⅰ.某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。据图回答:
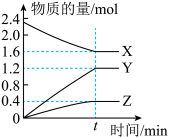
(1)该反应的化学方程式可表示为_______ 。
(2)反应起始至t min(设t=5),X的平均反应速率是_______ ,t min时Y的浓度是_______ 。
(3)在t min时,该反应达到了_______ 状态,下列可判断反应已达到该状态的是_______ (填字母,下同)。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2:3
C.各气体的体积不再改变 D.消耗2mol X的同时生成1mol Z
(4)一定能使该反应的反应速率增大的措施有_______。
Ⅱ.表中是部分共价键的键能。
(5)根据表中的数据写出工业合成氨的热化学方程式:_______ 。

(1)该反应的化学方程式可表示为
(2)反应起始至t min(设t=5),X的平均反应速率是
(3)在t min时,该反应达到了
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2:3
C.各气体的体积不再改变 D.消耗2mol X的同时生成1mol Z
(4)一定能使该反应的反应速率增大的措施有_______。
| A.其他条件不变,及时分离出产物 | B.适当降低温度 |
| C.其他条件不变,增大X的浓度 | D.保持温度不变,将容器体积压缩为1L |
Ⅱ.表中是部分共价键的键能。
| 共价键 |  | N≡N |  |
键能( ) ) | 436 | 946 | 391 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】Ⅰ.已知Na2S2O3与硫酸的反应为Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某研究小组为研究外界条件对化学反应速率的影响,设计实验如表,回答下列问题:
(1)实验①②研究的是______ 对化学反应速率的影响,V1=______ 。
(2)实验①③研究的是______ 对化学反应速率的影响,V2=______ 。
(3)t1、t2、t3由大到小的顺序是______ 。
Ⅱ.炼铁高炉中存在可逆反应Fe(s)+CO2(g) FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。

(4)t1时,反应是否达到化学平衡?______ (填“是”或“否”);4min时,正反应速率______ (填“>”“<”或“=”)逆反应速率。
(5)CO2的平衡转化率为______ (保留三位有效数字)。
(6)下列叙述能说明上述反应已达平衡的是______ (填序号)。
| 实验序号 | 反应温度 | 加入0.1mol/LNa2S2O3溶液的体积 | 加入0.1mol/LH2SO4溶液的体积 | 加入水的体积 | 出现浑浊的时间 |
| ℃ | mL | mL | mL | s | |
| ① | 20 | 2 | 2 | 0 | t1 |
| ② | 40 | 2 | V1 | 0 | t2 |
| ③ | 20 | 1 | 2 | V2 | t3 |
(2)实验①③研究的是
(3)t1、t2、t3由大到小的顺序是
Ⅱ.炼铁高炉中存在可逆反应Fe(s)+CO2(g)
 FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
FeO(s)+CO(g),一定温度下,向某恒容密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示,请回答下列问题。
(4)t1时,反应是否达到化学平衡?
(5)CO2的平衡转化率为
(6)下列叙述能说明上述反应已达平衡的是
| A.反应速率:v(CO2)=v(CO) |
| B.单位时间内生成nmolCO2的同时生成nmolCO |
| C.容器中混合气体的总压强不随时间变化而变化 |
| D.容器中混合气体的密度不随时间变化而变化 |
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】可逆反应一定温度下,在10L密闭容器中加入5mol Cl2 (g)和3mol H2O(g),发生反应:2Cl2 (g)+2H2O(g) 4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
(1)降低温度,υ正_________ ,υ逆_____________ ,Cl2的转化率_______ 。
(2)保持容器体积不变,加入He,则HCl的物质的量______________ 。
(3)保持容器的压强不变,加入He,则 O2的体积分数________ 。
(4)反应生成了________ mol HCl,H2O(g)的转化率是________ 。
(5)平衡时容器内气体的化学平衡常数为________ 。
 4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)
4HCl(g)+O2 (g) ΔH>0,10 min时,反应达到平衡状态,此时有1mol Cl2 (g)发生了反应。在一定条件下达到平衡后,分别采取下列措施,试回答:(1)-(3)(填“增大”、“减小”、或“不变”)(1)降低温度,υ正
(2)保持容器体积不变,加入He,则HCl的物质的量
(3)保持容器的压强不变,加入He,则 O2的体积分数
(4)反应生成了
(5)平衡时容器内气体的化学平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】 重整技术是实现碳中和的一种
重整技术是实现碳中和的一种 的利用技术。该过程中发生的反应为
的利用技术。该过程中发生的反应为
 。回答下列问题:
。回答下列问题:
(1)_______ (填“高温”、“低温”或“任意温度”)有利于该反应自发进行,该反应的反应物键能总和_______ (填“大于”或“小于”)生成物键能总和。
(2)若向一容积可变的密闭容器中充入一定量的 和
和 进行反应,保持压强不变,反应后
进行反应,保持压强不变,反应后 的平衡转化率随温度(T)的变化如图1所示。若达到化学平衡状态a时,仅改变压强,反应又重新达到平衡状态b,则压强
的平衡转化率随温度(T)的变化如图1所示。若达到化学平衡状态a时,仅改变压强,反应又重新达到平衡状态b,则压强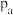
_______ (填“>”、“<”或“=”)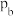 ,判断的理由是
,判断的理由是_______ 。

(3) ℃下,向体积为4L的恒容密闭容器中,充入0.2mol
℃下,向体积为4L的恒容密闭容器中,充入0.2mol 和0.5mol
和0.5mol 进行反应,反应达到平衡后,测得反应后混合气体的总压强为反应前的
进行反应,反应达到平衡后,测得反应后混合气体的总压强为反应前的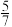 ,此时,
,此时, 的体积分数为
的体积分数为_______ , 的平衡转化率为
的平衡转化率为_______ ,平衡常数K=_______ 。
(4)我国科学家设计了一种电解装置如图2所示(电极均为惰性电极),能将二氧化碳、 转化成合成气CO和
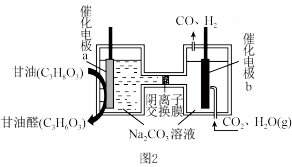
转化成合成气CO和 ,同时获得甘油醛。则催化电极b为
,同时获得甘油醛。则催化电极b为_______ 极,催化电极a产生甘油醛的电极反应式为_______ 。
 重整技术是实现碳中和的一种
重整技术是实现碳中和的一种 的利用技术。该过程中发生的反应为
的利用技术。该过程中发生的反应为
 。回答下列问题:
。回答下列问题:(1)
(2)若向一容积可变的密闭容器中充入一定量的
 和
和 进行反应,保持压强不变,反应后
进行反应,保持压强不变,反应后 的平衡转化率随温度(T)的变化如图1所示。若达到化学平衡状态a时,仅改变压强,反应又重新达到平衡状态b,则压强
的平衡转化率随温度(T)的变化如图1所示。若达到化学平衡状态a时,仅改变压强,反应又重新达到平衡状态b,则压强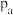
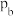 ,判断的理由是
,判断的理由是
(3)
 ℃下,向体积为4L的恒容密闭容器中,充入0.2mol
℃下,向体积为4L的恒容密闭容器中,充入0.2mol 和0.5mol
和0.5mol 进行反应,反应达到平衡后,测得反应后混合气体的总压强为反应前的
进行反应,反应达到平衡后,测得反应后混合气体的总压强为反应前的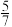 ,此时,
,此时, 的体积分数为
的体积分数为 的平衡转化率为
的平衡转化率为(4)我国科学家设计了一种电解装置如图2所示(电极均为惰性电极),能将二氧化碳、
 转化成合成气CO和
转化成合成气CO和 ,同时获得甘油醛。则催化电极b为
,同时获得甘油醛。则催化电极b为
您最近一年使用:0次



