氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。
(1)已知: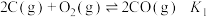 ,
,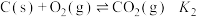 ,
,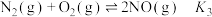 ,则反应
,则反应 的
的
___________ 。(用 、
、 、
、 表示)
表示)
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应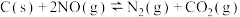 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。
①0~5min内,以 表示的该反应速率
表示的该反应速率
___________ ,最终达平衡时NO的转化率
___________ ,该温度T℃下的平衡常数
___________ 。
②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为: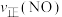
___________ 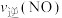 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)已知下列反应在298K时的反应焓变:
①
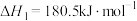
②
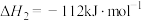
③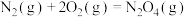
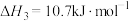
写出 转化为
转化为 的热化学方程式:
的热化学方程式:___________ 。
(1)已知:
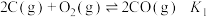 ,
,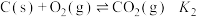 ,
,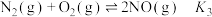 ,则反应
,则反应 的
的
 、
、 、
、 表示)
表示)(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应
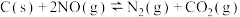 ,NO和
,NO和 的物质的量变化如下表所示。
的物质的量变化如下表所示。| 条件 | 保持温度为T/℃ | ||||||
| 时间 | 0min | 5min | 10min | 15min | 20min | 25min | 30min |
| NO物质的量/mol |  |  | 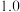 | 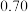 | 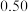 |  |  |
 物质的量/mol 物质的量/mol | 0 |  | 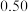 |  |  | 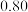 | 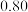 |
 表示的该反应速率
表示的该反应速率


②保持温度T℃不变,向该2L密闭容器中加入该四种反应混合物各2mol,该时刻,正、逆反应速率的大小关系为:
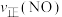
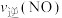 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)已知下列反应在298K时的反应焓变:
①

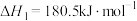
②

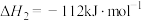
③
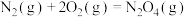
写出
 转化为
转化为 的热化学方程式:
的热化学方程式:
更新时间:2023-11-18 10:55:33
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量热。已知0.4 mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65 kJ的热量。
(1)写出肼和过氧化氢的结构式:肼___________ ,过氧化氢___________ 。
(2)写出热化学方程式:___________ 。
(3)已知H2O(l)=H2O(g);ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是___________ kJ。
(4)上述反应用于火箭推进剂,除释放出大量热和快速产生大量气体外,还有一个很突出的优点是___________ 。
(5)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534 kJ·mol-1,据盖斯定律写出肼与NO2完全反应的热化学方程式___________ 。
(1)写出肼和过氧化氢的结构式:肼
(2)写出热化学方程式:
(3)已知H2O(l)=H2O(g);ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
(4)上述反应用于火箭推进剂,除释放出大量热和快速产生大量气体外,还有一个很突出的优点是
(5)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7 kJ·mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534 kJ·mol-1,据盖斯定律写出肼与NO2完全反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】醇类的制取是近年来研究的热点。通过CH3COOCH3为原料在催化剂作用下加氢可同时制取乙醇和甲醇,包括以下主要反应:
反应I:CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g) △H1=-71kJ·mol-1
反应II:CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g) △H2
(1)查阅资料知:标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成lmol纯化合物时的焓变,符号为 。已知以下物质的标准摩尔生成焓如下表所示:
。已知以下物质的标准摩尔生成焓如下表所示:
则C2H5OH(g)的标准摩尔生成焓 =
=_______ kJ∙mol-1。
(2)将一定量的CH3OH与CH3CHO混合气体置于绝热恒容密闭容器中,只发生反应II,逆反应速率随时间变化的趋势如图所示(不考虑催化剂的影响),则反应II的△H2_______ 0(填“>”“<”或“=”);下列选项中一定能说明反应II达到平衡状态的是_______ (填序号)。
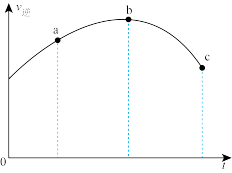
A.密闭体系的压强保持不变 B.甲醇与乙醛的分压之比不变
C.乙酸甲酯的体积分数保持不变 D.气体的平均摩尔质量保持不变
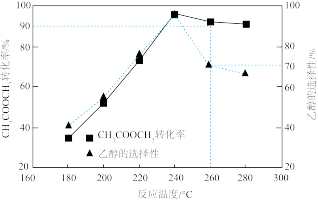
(3)一定条件下在1L密闭容器内通入一定量的CH3COOCH3和H2发生反应I和II,测得不同温度下达平衡时CH3COOCH3转化率和乙醇的选择性如图所示。温度高于240℃时,随温度升高乙醇的选择性降低的原因是_______ 。
(4)将物质的量均为amol的CH3COOCH3(g)和H2(g)分别加入恒温恒压的两个密闭容器甲(25℃、p1)、乙(25℃、p2)中,若只发生反应II,其正反应速率v正=k正·p(CH3COOCH3)·p(H2),p为物质分压,若容器甲与乙中平衡时正反应速率之比v甲:v乙=16:25,则甲、乙容器的体积之比为_______ 。
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示:
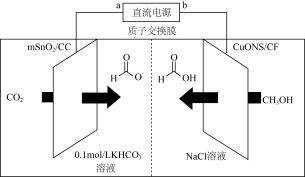
①若以Fe-Cu-浓硝酸构成的原电池为直流电源,则电极a应为_______ (填“Fe”或“Cu”)。电解过程中阳极上发生反应的电极反应式为_______ 。
②若有lmolH+通过质子交换膜时,则该装置生成HCOO-和HCOOH共计_______ mol。
反应I:CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g) △H1=-71kJ·mol-1
反应II:CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g) △H2
(1)查阅资料知:标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成lmol纯化合物时的焓变,符号为
 。已知以下物质的标准摩尔生成焓如下表所示:
。已知以下物质的标准摩尔生成焓如下表所示:| 物质 | CH3COOCH3(g) | CH3CHO(g) |
 /kJ·mol-1 /kJ·mol-1 | -413 | -201 |
 =
=(2)将一定量的CH3OH与CH3CHO混合气体置于绝热恒容密闭容器中,只发生反应II,逆反应速率随时间变化的趋势如图所示(不考虑催化剂的影响),则反应II的△H2

A.密闭体系的压强保持不变 B.甲醇与乙醛的分压之比不变
C.乙酸甲酯的体积分数保持不变 D.气体的平均摩尔质量保持不变
(3)一定条件下在1L密闭容器内通入一定量的CH3COOCH3和H2发生反应I和II,测得不同温度下达平衡时CH3COOCH3转化率和乙醇的选择性如图所示。温度高于240℃时,随温度升高乙醇的选择性降低的原因是

(4)将物质的量均为amol的CH3COOCH3(g)和H2(g)分别加入恒温恒压的两个密闭容器甲(25℃、p1)、乙(25℃、p2)中,若只发生反应II,其正反应速率v正=k正·p(CH3COOCH3)·p(H2),p为物质分压,若容器甲与乙中平衡时正反应速率之比v甲:v乙=16:25,则甲、乙容器的体积之比为
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示:

①若以Fe-Cu-浓硝酸构成的原电池为直流电源,则电极a应为
②若有lmolH+通过质子交换膜时,则该装置生成HCOO-和HCOOH共计
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】CO2大量排放会加剧温室效应。自然界的光合作用将二氧化碳转化为有机物,同时人们也在研究将CO2转化为高附加值的燃料,进而缓解能源和环境的双重危机。
Ⅰ.已知25℃,101kPa时:
①CO2(g)与H2O(l)经过光合作用生成1mol葡萄糖[C6H12O6(s)]和O2(g),吸收2804kJ能量。
②H2(g)的燃烧热为285.5kJ/mol
③H2O(l)=H2O(g) ∆H=+44kJ/mol。
(1)葡萄糖[C6H12O6(s)]的燃烧热的热化学方程式为___________ 。
(2)2H2(g)+O2(g)═2H2O(g) ∆H=___________ 。
Ⅱ.用H2还原CO2可以在一定条件下合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0
(3)某温度下,在恒容密闭容器中发生可逆反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。下列情况能说明该反应一定达到化学平衡的是___________ (填字母)。
a.H2的含量保持不变 b.υ(CO2)∶υ(H2)=1∶3
c.体系的压强不再发生变化 d.混合气体的密度不变
(4)提高甲醇的平衡产率采取的措施为___________ (填字母)
a.升高温度 b.降低温度 c.增大压强 d.降低压强
(5)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为1mol/L和2mol/L,反应平衡时,CO2的转化率为50%,该温度下反应的平衡常数为___________ 。
Ⅲ.我国科学家研究出一种电化学的方法,可以实现将CO2转化为C2H4,装置如图所示。
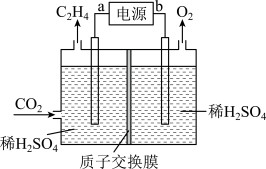
(6)b为电源的___________ (填“正极”或“负极”),阴极的电极反应式为___________ ,生成的C2H4和O2的质量之比为___________ (最简整数比)。
Ⅰ.已知25℃,101kPa时:
①CO2(g)与H2O(l)经过光合作用生成1mol葡萄糖[C6H12O6(s)]和O2(g),吸收2804kJ能量。
②H2(g)的燃烧热为285.5kJ/mol
③H2O(l)=H2O(g) ∆H=+44kJ/mol。
(1)葡萄糖[C6H12O6(s)]的燃烧热的热化学方程式为
(2)2H2(g)+O2(g)═2H2O(g) ∆H=
Ⅱ.用H2还原CO2可以在一定条件下合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H<0
(3)某温度下,在恒容密闭容器中发生可逆反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。下列情况能说明该反应一定达到化学平衡的是
a.H2的含量保持不变 b.υ(CO2)∶υ(H2)=1∶3
c.体系的压强不再发生变化 d.混合气体的密度不变
(4)提高甲醇的平衡产率采取的措施为
a.升高温度 b.降低温度 c.增大压强 d.降低压强
(5)某温度下,恒容密闭容器中,CO2和H2的起始浓度分别为1mol/L和2mol/L,反应平衡时,CO2的转化率为50%,该温度下反应的平衡常数为
Ⅲ.我国科学家研究出一种电化学的方法,可以实现将CO2转化为C2H4,装置如图所示。

(6)b为电源的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
I.将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法正确的是_______。
(2)在相同时间内,两烧杯中产生气泡的速度:甲_______ 乙(填“>”“<”或“=”)。
(3)请写出图中构成原电池的负极电极反应式:_______ 。
(4)当甲中溶液质量增重31.5 g时,电极上转移电子物质的量为_______ 。
II.新能源汽车的推广使用有利于环境保护,降低碳排放。实施低碳经济是今后经济生活的主流。回答下列问题:
(5)下列措施不利于有效减少二氧化碳的是_______(填字母)。
(6)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式: CO2+4H2
_______ +2H2O
(7) 用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①能判断该反应已达化学平衡的标志是_______ (填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3∶1
d.CO2的生成速率与CH3OH的生成速率相等
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示:

从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
I.将纯锌片和纯铜片按如图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法正确的是_______。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.甲、乙两烧杯中溶液的 pH 均增大 |
(3)请写出图中构成原电池的负极电极反应式:
(4)当甲中溶液质量增重31.5 g时,电极上转移电子物质的量为
II.新能源汽车的推广使用有利于环境保护,降低碳排放。实施低碳经济是今后经济生活的主流。回答下列问题:
(5)下列措施不利于有效减少二氧化碳的是_______(填字母)。
| A.植树造林,保护森林,保护植被 |
| B.加大对煤和石油的开采,并鼓励使用液化石油气 |
| C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发 |
| D.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高 |

(7) 用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2,发生反应: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①能判断该反应已达化学平衡的标志是
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3∶1
d.CO2的生成速率与CH3OH的生成速率相等
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示:

从反应开始到平衡,氢气的平均反应速率v(H2)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】Ⅰ.高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
(1)该反应的平衡常数表达式K=______ 。
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。CO的平衡转化率=_______ 。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是____ (填字母序号)。
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量
D.减小容器的容积 E.提高反应温度 F.加入合适的催化剂
Ⅱ.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g) 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。

(4)该温度下,该反应的平衡常数为________ ,若温度升高,K值将______ (填“增大”、“减小”或“不变”)。
(5)a、b、c、d四个点中,表示化学反应处于平衡状态的是_______ 点。从起点开始首次达到平衡时,以NO2表示的反应速率υ(NO2)=_______ mol·L−1·min−1。
(6)25 min时,加入了______ (填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(7)25℃时,1.00 g N2H4(l) (联氨)与足量N2O4 (l)完全反应生成N2(g)和H2O (l)放出19.14 kJ的热量。则该反应的热化学方程式为:__________ 。
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下,请回答下列问题:| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)在一个容积为10 L的密闭容器中,1000 ℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10 min后达到平衡。CO的平衡转化率=
(3)欲提高(2)中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.移出部分CO2 C.增加Fe2O3的量
D.减小容器的容积 E.提高反应温度 F.加入合适的催化剂
Ⅱ.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
(4)该温度下,该反应的平衡常数为
(5)a、b、c、d四个点中,表示化学反应处于平衡状态的是
(6)25 min时,加入了
(7)25℃时,1.00 g N2H4(l) (联氨)与足量N2O4 (l)完全反应生成N2(g)和H2O (l)放出19.14 kJ的热量。则该反应的热化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】草酸(H2C2O4)是一种重要的化学试剂。下面是利用草酸探究外界条件对反应速率影响的实验。
(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是____ (填序号)。
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):
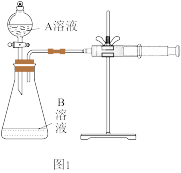
①该反应的离子方程式____ 。
②该实验探究的是____ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是____ (用实验序号填空)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末c(MnO )=
)=____ mol/L(假设混合液体积为50mL)。
(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①____ ;②____ 。

(1)该反应是溶液之间发生的不可逆反应,改变压强对其反应速率的影响是
A.可能明显加快
B.可能明显减慢
C.几乎无影响,可以忽略
(2)用酸性KMnO4和H2C2O4反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已酸化):

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20mL0.2mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
②该实验探究的是
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末c(MnO
 )=
)=(4)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①

您最近一年使用:0次
【推荐1】研究减少CO2排放是实现碳达峰、碳中和的重要课题。已知CO2经催化加氢可以生成多种低碳有机物。
[如反应类型①]:
I.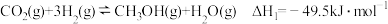
II.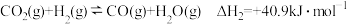
III.
回答下列问题:
(1)反应III的 为
为_______ 。
(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,υ(H2)=_______ ;10min时,改变的外界条件可能是_______ (任写两点)
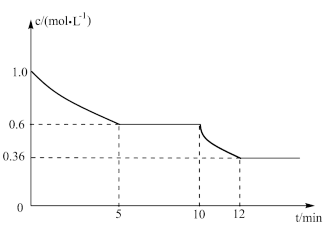
(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是_______ (填序号)。
A.CO的浓度保持不变
B.CO2和H2的转化率相等
C.混合气体中CO2的百分含量不再发生变化
D.单位时间内体系中减少1molH2的同时有1molH2O增加
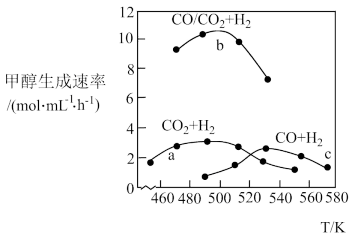
(4)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是_______ (填“A”或“B”)。
A.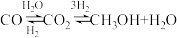
B.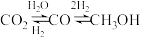
(5)已知一定温度下按照起始比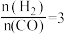 ,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为
,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列出计算式)为Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列出计算式)为Kp=_______ (各气体分压=平衡体系中各气体的体积分数×总压)。
[如反应类型②]:电化学转化法
(6)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为_______ mol。
②生成乙烯的电极反应式是_______ 。
[如反应类型①]:
I.
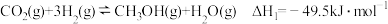
II.
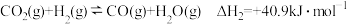
III.

回答下列问题:
(1)反应III的
 为
为(2)一定温度下,在一体积固定的密闭容器中进行反应I,测得CO2的物质的量浓度随反应时间的变化如图所示:则反应进行的前5分钟内,υ(H2)=

(3)将CO2和H2按物质的量之比1:1投料发生反应II,下列不能说明反应已达平衡的是
A.CO的浓度保持不变
B.CO2和H2的转化率相等
C.混合气体中CO2的百分含量不再发生变化
D.单位时间内体系中减少1molH2的同时有1molH2O增加
(4)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是

A.
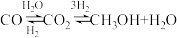
B.
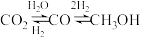
(5)已知一定温度下按照起始比
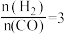 ,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为
,在一密闭容器中进行反应III,保持总压为2.1MPa不变,达平衡时CO的平衡转化率为 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列出计算式)为Kp=
,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列出计算式)为Kp=[如反应类型②]:电化学转化法
(6)在酸性电解质溶液中,以太阳能电池作电源,惰性材料作电极,可将CO2转化为乙烯。实验装置如图所示。

①若电解过程中生成3.36L(标准状况下)O2,则电路中转移的电子至少为
②生成乙烯的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 作为主要的温室气体,对人类的生产生活有着重要影响,
作为主要的温室气体,对人类的生产生活有着重要影响, 还原
还原 是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
反应I:
反应Ⅱ: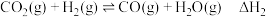
反应Ⅲ: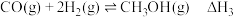
反应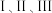 的平衡常数与温度变化关系如图所示。
的平衡常数与温度变化关系如图所示。 合成
合成 选择性的条件是_______(填字母)。
选择性的条件是_______(填字母)。
(2)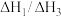 的取值范围是_______(填字母)。
的取值范围是_______(填字母)。
(3)一定条件下,向体积为 的恒温密闭容器中加入
的恒温密闭容器中加入 和
和 发生上述反应,平衡时,容器中
发生上述反应,平衡时,容器中 的浓度为
的浓度为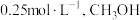 的浓度
的浓度 ,此时
,此时 的浓度为
的浓度为_______  ,反应I的平衡常数为
,反应I的平衡常数为_______ (保留一位小数)。
(4) 还原能力
还原能力 可衡量
可衡量 转化率,已知
转化率,已知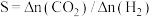 ,即相同时间段内
,即相同时间段内 与
与 物质的量变化量之比。常压下
物质的量变化量之比。常压下 和
和 按物质的量之比
按物质的量之比 投料,反应相同时间,
投料,反应相同时间, 和
和 转化率如图所示。
转化率如图所示。 范围内,S值的变化趋势是
范围内,S值的变化趋势是_______ (填字母)。
A.一直增大 B.一直减小 C.先增大后减小 D.先减小后增大
②由图像可知, 转化率在
转化率在 时大于
时大于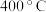 ,其原因是
,其原因是_______ 。
③温度较低时,两条曲线重合的原因是_______ 。
 作为主要的温室气体,对人类的生产生活有着重要影响,
作为主要的温室气体,对人类的生产生活有着重要影响, 还原
还原 是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:反应I:

反应Ⅱ:
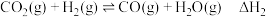
反应Ⅲ:
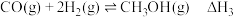
反应
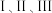 的平衡常数与温度变化关系如图所示。
的平衡常数与温度变化关系如图所示。
 合成
合成 选择性的条件是_______(填字母)。
选择性的条件是_______(填字母)。| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
(2)
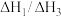 的取值范围是_______(填字母)。
的取值范围是_______(填字母)。A. | B.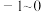 | C.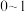 | D.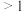 |
(3)一定条件下,向体积为
 的恒温密闭容器中加入
的恒温密闭容器中加入 和
和 发生上述反应,平衡时,容器中
发生上述反应,平衡时,容器中 的浓度为
的浓度为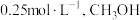 的浓度
的浓度 ,此时
,此时 的浓度为
的浓度为 ,反应I的平衡常数为
,反应I的平衡常数为(4)
 还原能力
还原能力 可衡量
可衡量 转化率,已知
转化率,已知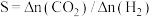 ,即相同时间段内
,即相同时间段内 与
与 物质的量变化量之比。常压下
物质的量变化量之比。常压下 和
和 按物质的量之比
按物质的量之比 投料,反应相同时间,
投料,反应相同时间, 和
和 转化率如图所示。
转化率如图所示。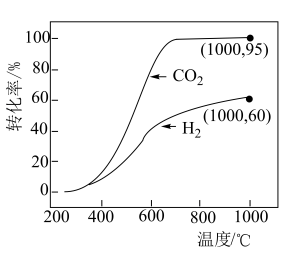
 范围内,S值的变化趋势是
范围内,S值的变化趋势是A.一直增大 B.一直减小 C.先增大后减小 D.先减小后增大
②由图像可知,
 转化率在
转化率在 时大于
时大于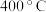 ,其原因是
,其原因是③温度较低时,两条曲线重合的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取钴的氧化物的流程如下:

(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是____________ 。
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为_____________________ 。
(3)步骤Ⅲ中的反应为2Na++6Fe3++4 +12H2O=Na2Fe6(SO4)4(OH)12+12H+。过滤后母液的pH=2.0,c(Na+)="a"mol∙L-1,c(Fe3+)="b"mol∙L-1,c(
+12H2O=Na2Fe6(SO4)4(OH)12+12H+。过滤后母液的pH=2.0,c(Na+)="a"mol∙L-1,c(Fe3+)="b"mol∙L-1,c( )="d"mol∙L-1,该反应的平衡常数K=
)="d"mol∙L-1,该反应的平衡常数K=___ (用含a、b、d 的代数式表示)。
(4)完成步骤Ⅳ中反应的离子方程式:
_______ +___  +
+___ H2O=Co5(OH)6(CO3)2↓+_____
(5)已知CoCl2的溶解度曲线如图所示。步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤。

①边加热边搅拌的原因是______________ ;
②趁热过滤的原因是______________ 。

(1)步骤Ⅰ中废催化剂用硫酸浸出后,将滤渣1进行再次浸出,其目的是
(2)步骤Ⅱ需要加热搅拌,相应的离子方程式为
(3)步骤Ⅲ中的反应为2Na++6Fe3++4
 +12H2O=Na2Fe6(SO4)4(OH)12+12H+。过滤后母液的pH=2.0,c(Na+)="a"mol∙L-1,c(Fe3+)="b"mol∙L-1,c(
+12H2O=Na2Fe6(SO4)4(OH)12+12H+。过滤后母液的pH=2.0,c(Na+)="a"mol∙L-1,c(Fe3+)="b"mol∙L-1,c( )="d"mol∙L-1,该反应的平衡常数K=
)="d"mol∙L-1,该反应的平衡常数K=(4)完成步骤Ⅳ中反应的离子方程式:
 +
+(5)已知CoCl2的溶解度曲线如图所示。步骤Ⅴ向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌,待固体溶解后需趁热过滤。

①边加热边搅拌的原因是
②趁热过滤的原因是
您最近一年使用:0次



