室温下,下列溶液中粒子浓度关系正确的是
A.K2S溶液: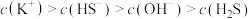 |
B.NaHC2O4溶液: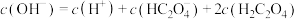 |
C.pH=5的NaHSO3溶液: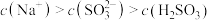 |
D.CH3COONa和CaCl2混合溶液: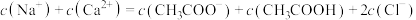 |
更新时间:2023/10/06 07:52:05
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】在25 ℃条件下,下列说法正确的是
| A.100mL 0.1mol/LCH3COONa溶液中,c(Na+)+c(H+)=c(CH3COO- ) |
| B.向水中加入少量固体硫酸氢钠(不考虑温度变化),溶液中c(H+)增大,Kw不变 |
C.向0.1mol/L  溶液中加入少量的水,溶液中 溶液中加入少量的水,溶液中 减小 减小 |
D. 的HA溶液与 的HA溶液与 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 的NaOH溶液等体积混合,所得溶液pH一定等于7.0 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】亚氯酸钠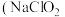 )在溶液中会生成
)在溶液中会生成 、
、 、
、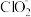 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
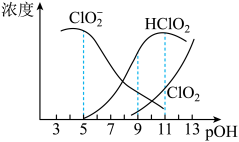
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
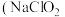 )在溶液中会生成
)在溶液中会生成 、
、 、
、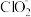 、
、 等,其中
等,其中 和
和 都是具有漂白作用。已知
都是具有漂白作用。已知 ,经测定
,经测定 时各组分含量随
时各组分含量随 变化情况如图所示(
变化情况如图所示( 浓度没有画出),此温度下,下列分析正确的是
浓度没有画出),此温度下,下列分析正确的是
A. 的电离平衡常数的数值 的电离平衡常数的数值 |
B. 时, 时,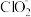 部分转化成 部分转化成 和 和 离子的方程式为: 离子的方程式为: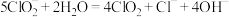 |
C. 时,溶液中含氯微粒的浓度大小为: 时,溶液中含氯微粒的浓度大小为: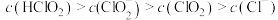 |
D.同浓度 溶液和 溶液和 溶液等体积混合,则混合溶液中有: 溶液等体积混合,则混合溶液中有: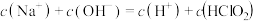 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】25℃时,用0.10 的氨水滴定10.00 mL0.05
的氨水滴定10.00 mL0.05
 溶液,加入氨水的体积 (V)与溶液中
溶液,加入氨水的体积 (V)与溶液中 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
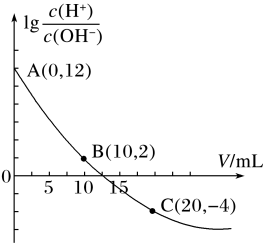
 的氨水滴定10.00 mL0.05
的氨水滴定10.00 mL0.05
 溶液,加入氨水的体积 (V)与溶液中
溶液,加入氨水的体积 (V)与溶液中 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
| A.A点溶液的pH等于1 |
B.由图中数据可知, 为弱酸 为弱酸 |
C.B点水电离出的OH-与 浓度为相等 浓度为相等 |
D.C点溶液为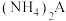 与 与 的混合溶液 的混合溶液 |
您最近一年使用:0次
单选题
|
适中
(0.65)
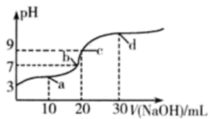
【推荐2】室温下,将1L0.3mol⋅ L−1HA溶液与0.1molNaOH固体混合,使之充分反应得到溶液(a)。然后向该溶液中通入HCl或加入NaOH固体(忽略体积和温度变化),溶液pH随通(加)入物质的量的变化如图。下列叙述错误的是
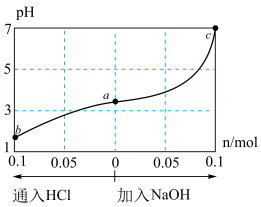

| A.HA是一种弱酸 |
| B.向a点对应溶液中通入HCl,充分反应后,c(H+)/c(HA)增大 |
| C.b点对应溶液中:c(Na+)=c(Cl-)>c(HA)>c(H+)>c(OH-) |
| D.c点对应溶液中:c(Na+)=c(A-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温下,在BaSO4悬浊液中加入足量的饱和Na2CO3溶液,过滤,向滤渣中加盐酸,部分溶解,且产生气泡。已知Ksp(BaCO3)=5.0×10-9,Ksp(BaSO4)=1.0×10-10。下列说法正确的是
A.饱和Na2CO3溶液中存在:c(Na+)>c(CO )>c(HCO )>c(HCO )>c(OH-) )>c(OH-) |
B.BaSO4悬浊液与Na2CO3溶液反应的离子方程式:Ba2++CO =BaCO3↓ =BaCO3↓ |
C.要有BaCO3生成,需满足c(SO )/c(CO )/c(CO )<0.02 )<0.02 |
D.过滤后所得清液中一定存在:c(SO )·c(Ba2+)<Ksp(BaSO4) )·c(Ba2+)<Ksp(BaSO4) |
您最近一年使用:0次

 先增大后减小
先增大后减小

