25℃时,如果取0.1 mol⋅L HA溶液与0.1 mol⋅L
HA溶液与0.1 mol⋅L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的
NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的 ,试回答以下问题:
,试回答以下问题:
(1)混合溶液的 的原因
的原因______ (用离子方程式表示);
(2)将混合溶液从25℃升温至30℃,溶液中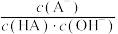 将
将______ (填增大或减小或不变)
(3)求出混合液中下列算式的计算结果: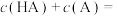
______ mol⋅L ;(填具体数字)
;(填具体数字)
(4)已知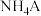 溶液为中性,又知将HA溶液加到
溶液为中性,又知将HA溶液加到 溶液中有气体放出,将相同温度下相同浓度的四种盐溶液:A.
溶液中有气体放出,将相同温度下相同浓度的四种盐溶液:A. ;B.
;B.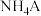 ;C.
;C. ;D.
;D. ,按pH由大到小的顺序排列
,按pH由大到小的顺序排列______ (填序号)
(5)常温时, 的醋酸和
的醋酸和 的KOH溶液等体积混合后,该溶液中电荷守恒表达式为
的KOH溶液等体积混合后,该溶液中电荷守恒表达式为______ 。
(6)下列关于 水解的说法错误的是______。
水解的说法错误的是______。
 HA溶液与0.1 mol⋅L
HA溶液与0.1 mol⋅L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的
NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的 ,试回答以下问题:
,试回答以下问题:(1)混合溶液的
 的原因
的原因(2)将混合溶液从25℃升温至30℃,溶液中
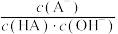 将
将(3)求出混合液中下列算式的计算结果:
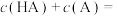
 ;(填具体数字)
;(填具体数字)(4)已知
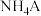 溶液为中性,又知将HA溶液加到
溶液为中性,又知将HA溶液加到 溶液中有气体放出,将相同温度下相同浓度的四种盐溶液:A.
溶液中有气体放出,将相同温度下相同浓度的四种盐溶液:A. ;B.
;B.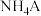 ;C.
;C. ;D.
;D. ,按pH由大到小的顺序排列
,按pH由大到小的顺序排列(5)常温时,
 的醋酸和
的醋酸和 的KOH溶液等体积混合后,该溶液中电荷守恒表达式为
的KOH溶液等体积混合后,该溶液中电荷守恒表达式为(6)下列关于
 水解的说法错误的是______。
水解的说法错误的是______。| A.水解达到平衡时(不饱和),加氯化铁使溶液达饱和,溶液的酸性会增强 |
| B.将氯化铁饱和溶液在蒸发皿中加热蒸干并灼烧可以得到氢氧化铁沉淀 |
C.1 L 0.3 mol/L的 溶液水解可得到 溶液水解可得到 胶粒的数目为 胶粒的数目为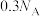 |
D.为抑制 的水解,较好的保存 的水解,较好的保存 溶液,应加少量盐酸 溶液,应加少量盐酸 |
更新时间:2023-10-27 20:48:52
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】今有常温下两种溶液:①0.1mol/LNH3·H2O溶液②0.1mol/LNH4Cl溶液
(1)溶液①的PH______ 7(填“>”、“<”或“=”),写出NH3·H2O的电离方程式______________ 。
(2)溶液②呈________ 性(填“酸”、“碱”或“中”)。
(3)关于两种溶液中c(NH4+)的大小叙述正确的是________ (填序号)。
A.两种溶液中c (NH4+)都等于0.lmol/L
B.两种溶液中c (NH4+)都小于0.lmol/L
C.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
(4)将溶液中①逐滴加入溶液②中,当溶液pH=7时,c(NH4+)______ c(Cl一)(填“>”、“<”或“=”)。
(1)溶液①的PH
(2)溶液②呈
(3)关于两种溶液中c(NH4+)的大小叙述正确的是
A.两种溶液中c (NH4+)都等于0.lmol/L
B.两种溶液中c (NH4+)都小于0.lmol/L
C.NH4Cl溶液中c(NH4+)小于NH3·H2O溶液中c(NH4+)
(4)将溶液中①逐滴加入溶液②中,当溶液pH=7时,c(NH4+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25℃时,向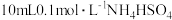 溶液中逐滴滴入
溶液中逐滴滴入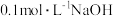 溶液,溶液的pH与
溶液,溶液的pH与 溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)

(1)用化学用语表示M点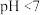 的原因
的原因__________ 。
(2) 四点中,水电离产生的
四点中,水电离产生的 浓度最大的是
浓度最大的是______________ 点。
(3)下列关系中,正确的是________ 。
a P点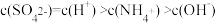
b N点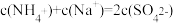
c Q点
d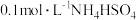 溶液中
溶液中 小于
小于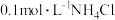 溶液中
溶液中
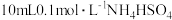 溶液中逐滴滴入
溶液中逐滴滴入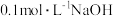 溶液,溶液的pH与
溶液,溶液的pH与 溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
(1)用化学用语表示M点
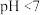 的原因
的原因(2)
 四点中,水电离产生的
四点中,水电离产生的 浓度最大的是
浓度最大的是(3)下列关系中,正确的是
a P点
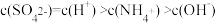
b N点
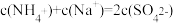
c Q点

d
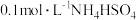 溶液中
溶液中 小于
小于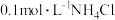 溶液中
溶液中
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题。常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为___ 酸(填“强”或“弱”),往H2A溶液中加水会使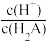 的值
的值___ (填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或__ 。Na2A的水溶液pH__ (填“<”、“>”或“=”)7,原因是:__ (用离子方程式表示)
(3)若溶液M由10mL1.00mol·L-1H2A溶液与10mL1.00mol·L-1NaOH溶液混合而成,下列关于溶液M的说法正确的是__ (选填字母序号)。
a.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
c.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
d.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中: =
=___ 。
(1)H2A为
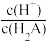 的值
的值(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或
(3)若溶液M由10mL1.00mol·L-1H2A溶液与10mL1.00mol·L-1NaOH溶液混合而成,下列关于溶液M的说法正确的是
a.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
c.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
d.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1mol·L-1的Na2A、NaHA混合溶液中:
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
(1)写出碳酸的第一步电离方程式_______ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,H2SO3⇌HSO +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=_______ 。
(4)下列方法中,可以使0.10mol/LCH3COOH溶液中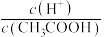 值增大的措施是
值增大的措施是_______ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
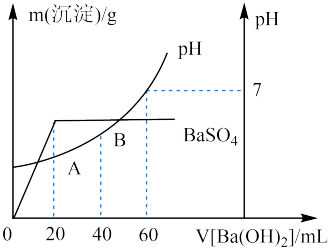
①原混合溶液中c(H+)=_______ ;c(Cl-)=_______ 。
②A点的pH=_______ 。
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=_______ (溶液体积变化忽略不计)。
| 醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 Ka2=5.6×10  | Ka=6.2×10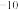 |
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=(4)下列方法中,可以使0.10mol/LCH3COOH溶液中
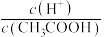 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:

①原混合溶液中c(H+)=
②A点的pH=
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】碳酸氢钠俗称“小苏打”,在生活、生产中用途广泛。
(1)泡沫灭火器中主要成分是NaHCO3溶液和Al2(SO4)3溶液,两者混合后发生双水解反应生成Al(OH)3和CO2进行灭火,写出该反应的化学方程式___ 。
(2)向NaHCO3溶液中加入少许Ba(OH)2固体,忽略溶液体积变化,溶液中的c(CO32−)的变化___ (选填“增大”、“减小”或“不变”)。
(3)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤②不通入氨,冷却、加食盐,过滤
对两种方法的评价正确的是__ (选填编号)。
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(4)已知HCO3−在水中既能水解也能电离。NaHCO3溶液呈碱性,溶液中c(H2CO3)___ c(CO32−)(选填“>”、“<”、“=”)。
(1)泡沫灭火器中主要成分是NaHCO3溶液和Al2(SO4)3溶液,两者混合后发生双水解反应生成Al(OH)3和CO2进行灭火,写出该反应的化学方程式
(2)向NaHCO3溶液中加入少许Ba(OH)2固体,忽略溶液体积变化,溶液中的c(CO32−)的变化
(3)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤②不通入氨,冷却、加食盐,过滤
对两种方法的评价正确的是
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(4)已知HCO3−在水中既能水解也能电离。NaHCO3溶液呈碱性,溶液中c(H2CO3)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请按要求作答。
(1)写出下列物质在水溶液中的电离方程式。
①NH3·H2O:_______ 。
②NaHSO4:_______ 。
(2)下列盐溶液中能发生水解的用离子方程式 表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
①CuCl2_______ ,溶液呈_______ 性;
②K2SO4_______ ,溶液呈_______ 性;
(3)明矾可用于净水,原因是(用离子方程式表示):_______
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)_______
(5)已知下列热化学方程式:
 ①
①
 ②
②
 ③
③
写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式:_______ 。
(1)写出下列物质在水溶液中的电离方程式。
①NH3·H2O:
②NaHSO4:
(2)下列盐溶液中能发生水解的
①CuCl2
②K2SO4
(3)明矾可用于净水,原因是(用离子方程式表示):
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)
(5)已知下列热化学方程式:
 ①
① ②
② ③
③写出FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】平衡思想是化学研究的一个重要观念,在水溶液中存在多种平衡体系。
(1)①室温下,0.1 mol/L的醋酸在水中有1%发生电离,则该温度下CH3COOH的电离平衡常数Ka ≈___________ 。
②在25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c(NH )=c(Cl-),则溶液显
)=c(Cl-),则溶液显___________ (填“酸“碱”或“中”)性。
(2)已知,常温下几种物质的电离常数如下:
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是___________ 。
②下列说法正确的是___________ 。
A.Ca(ClO)2溶液中通入少量SO2:SO2 + H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH−)降至1.0×10-7mol/L时,溶液中的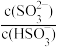 =0.6
=0.6
C.等物质的量浓度的NaHSO3与Na2SO3混合液中,3c(Na+)=2c( )+2c(
)+2c(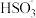 )+2c(H2SO3)
)+2c(H2SO3)
D.Na2CO3溶液中加入少量水,则溶液中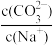 将减小
将减小
③根据表中数据,计算0.03 mol/L NaClO溶液的pH≈___________ 。
(1)①室温下,0.1 mol/L的醋酸在水中有1%发生电离,则该温度下CH3COOH的电离平衡常数Ka ≈
②在25℃时,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合(忽略混合时的溶液体积变化),反应平衡时溶液中c(NH
 )=c(Cl-),则溶液显
)=c(Cl-),则溶液显(2)已知,常温下几种物质的电离常数如下:
| 化学式 | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka=3.0×10-8 | Ka1=1.4×10-2 Ka2=6.0×10-8 |
①三种相同物质的量浓度的Na2CO3、NaClO、NaHSO3的pH从小到大的排序是
②下列说法正确的是
A.Ca(ClO)2溶液中通入少量SO2:SO2 + H2O+Ca2++2ClO- = CaSO3↓+2HClO
B.常温下,将SO2通入氨水中,当c(OH−)降至1.0×10-7mol/L时,溶液中的
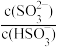 =0.6
=0.6C.等物质的量浓度的NaHSO3与Na2SO3混合液中,3c(Na+)=2c(
 )+2c(
)+2c(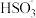 )+2c(H2SO3)
)+2c(H2SO3)D.Na2CO3溶液中加入少量水,则溶液中
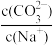 将减小
将减小③根据表中数据,计算0.03 mol/L NaClO溶液的pH≈
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知25℃时,几种常见弱酸的Ka如表所示:
(1)25℃时,0.1mol•L-1的①NaCN②CH3COONa③Na2CO3溶液的pH由大到小的顺序是____ (填序号)。
(2)25℃时,用0.10mol•L-1KOH溶液滴定10.00mL0.10mol•L-1H2C2O4溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

①当V<10mL时,反应的离子方程式为____ 。
②当V=10mL时,所得溶液中各离子浓度的由大到小依次为____ 。
③当V=20mL时,所得溶液中c(K+)=____ 。(填物料守恒式)
④如图5点所示溶液中,水的电离程度最大的是____ (填序号)。
(3)NaHCO3溶液显____ (填“酸性”、“中性”或“碱性”),结合数据 分析其原因是____ 。
(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是____ 。
| 电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 | HClO |
| 电离常数 | Ka1=5.9×10-2 Ka2=6.4×10-5 | K=1.7×10-5 | K=6.2×10-10 | Ka1=4.5×10-7 Ka2=4.8×10-11 | K=2.9×10-8 |
(1)25℃时,0.1mol•L-1的①NaCN②CH3COONa③Na2CO3溶液的pH由大到小的顺序是
(2)25℃时,用0.10mol•L-1KOH溶液滴定10.00mL0.10mol•L-1H2C2O4溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:

①当V<10mL时,反应的离子方程式为
②当V=10mL时,所得溶液中各离子浓度的由大到小依次为
③当V=20mL时,所得溶液中c(K+)=
④如图5点所示溶液中,水的电离程度最大的是
(3)NaHCO3溶液显
(4)氯气通入NaHCO3溶液中产生无色气体,该反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中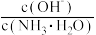
_______ (填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式_____________ ;若所得溶液的pH=5,则溶液中由水所电离出的氢离子浓度为___________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c( )=a mol/L,则c(
)=a mol/L,则c( )=
)=______ 。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是_____________________________________________ 。
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
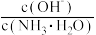
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(
 )=a mol/L,则c(
)=a mol/L,则c( )=
)=(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知25℃时电离常数:
(1)H2CO3、CH3COOH、HCN三种酸中酸性最弱的是_______ 。常温下,pH均为10的Na2CO3、CH3COONa、NaCN、NaHCO3四种溶液中,物质的量浓度最大的是_______ 。
(2)常温下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
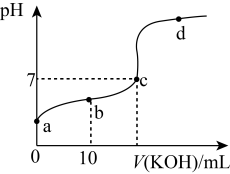
①若想观察滴定终点,滴定过程中宜选用_______ 作指示剂(填“酚酞”、“石蕊”或“甲基橙”)。
②b点时,溶液中离子浓度由大到小的顺序是_______ 。
(3)常温下,向NaCN溶液中通入少量 CO2发生反应的化学方程式为:_______ 。
(4)在一定条件下,Na2CO3溶液中存在CO +H2O
+H2O HCO
HCO +OH-平衡,下列说法不正确的是_______。
+OH-平衡,下列说法不正确的是_______。
| 酸 | H2CO3 | CH3COOH | HCN |
| Ka | Ka1=4.5×10-7Ka2=5.6×10-11 | 1.75×10-5 | 6.2×10-10 |
(2)常温下,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

①若想观察滴定终点,滴定过程中宜选用
②b点时,溶液中离子浓度由大到小的顺序是
(3)常温下,向NaCN溶液中通入
(4)在一定条件下,Na2CO3溶液中存在CO
 +H2O
+H2O HCO
HCO +OH-平衡,下列说法不正确的是_______。
+OH-平衡,下列说法不正确的是_______。A.稀释溶液,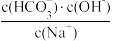 增大 增大 | B.通入CO2,溶液pH减小 |
| C.升高温度,水解平衡常数增大 | D.加入Na2O固体,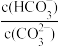 减小 减小 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】常温下,H2S的电离常数为Ka1、Ka2,推导Na2S溶液中S2-水解常数Kh1、Kh2与Ka1、Ka2的关系_____ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的镁条,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(1)D溶液为_______________ ;同浓度的四种溶液中,pH值最大的是______________ (填化学式)溶液。
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率
v(A)______________ v(C) (填“>”“<”或“=”)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈______________ (填“酸性”、“碱性”或“中性”),用离子方程式解释其原因__________________________________ 。
(4)常温下,2mol/L的NaOH溶液与amol/L的醋酸溶液等体积混合后,发现溶液呈中性,
试计算:该温度下醋酸钠的水解平衡常数Kb=________________ (用含a的代数式表示。)
已知同浓度的四种溶液:①加入大小完全相同的镁条,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(1)D溶液为
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率
v(A)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈
(4)常温下,2mol/L的NaOH溶液与amol/L的醋酸溶液等体积混合后,发现溶液呈中性,
试计算:该温度下醋酸钠的水解平衡常数Kb=
您最近一年使用:0次



