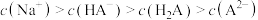已知25℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15,下列说法正确的是
| A.在等浓度的Na2A、NaHA 溶液中,水的电离程度前者小 |
| B.向0.1mol/L的H2A溶液中通入HCl气体至pH=3,H2A的电离度减小 |
| C.25℃时,向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-) |
| D.取pH=a的H2A溶液10mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1 |
更新时间:2023-12-13 12:05:18
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】水的电离平衡曲线如图所示,下列说法不正确的是


| A.温度不变,向水中加入适量KHSO4固体可使A点变到C点 |
B.图中五个点的Kw间的关系: |
| C.若从A点变到D点,可采用在水中加入少量酸的方法 |
D.处在B点时,将 的稀硫酸与 的稀硫酸与 的KOH溶液等体积混合后,溶液显中性 的KOH溶液等体积混合后,溶液显中性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温时,向20.0mL0.10mol⋅L-1的两种酸HA、HB中分别滴加0.10mol⋅L-1NaOH溶液,其pH变化分别对应图中的Ⅰ、Ⅱ。下列说法错误的是
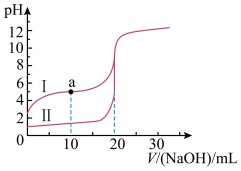

| A.向NaA溶液中滴加HB可产生HA |
| B.a点时,溶液中存在:c(A-)>c(Na+)>c(HA) |
| C.滴加NaOH溶液至pH=7时,两种溶液中c(A-)=c(B-) |
| D.滴加20.0mLNaOH溶液时,水的电离程度:Ⅰ>Ⅱ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】化学平衡常数(K) 、电离常数(Ka、Kb) 、溶度积常数(Ksp) 等是表示、判断物质性质的重要常数。下列关于这些常数的说法中,正确的是
| A.Ka (H2CO3) a (CH3COOH) 说明相同物质的量浓度时,碳酸的酸性比醋酸的强 |
| B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp (AgCl) 增大 |
| C.一般情况下,当温度 升高 时,弱酸、弱碱的电离 常数(Ka、Kb ) 均变 大 |
| D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的强 |
| B.氨气是弱电解质,铜是强电解质 |
| C.硫酸钡是强电解质,醋酸是弱电解质 |
| D.相同温度下,浓度均为0.1 mol•L-1的NH4Cl溶液和氨水,NH4+的浓度一样大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列电离方程式的书写正确的是
A.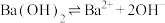 |
B.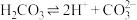 |
C.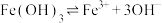 |
D.水溶液中 的电离: 的电离: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下某二元酸H2X电离平衡常数:Ka1=5.60×10-2,Ka2=5.42×10-5。下列叙述错误的是
| A.常温下,NaHX溶液呈碱性 |
| B.H2X溶液的电离程度随温度升高而增大 |
| C.0.01 mol·L-1 Na2X溶液中:c(Na+)=2×[c(X2-)+c(HX-)+c(H2X)] |
| D.常温下,pH=3的H2X溶液与pH=11的NaOH溶液等体积混合溶液呈酸性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知 和
和 电离平衡常数:
电离平衡常数:
根据提供的数据判断,下列离子方程式或化学方程式不正确的是
 和
和 电离平衡常数:
电离平衡常数: |  | |
 |  |  |
A.向 溶液中滴加过量氯水: 溶液中滴加过量氯水: |
B.向 溶液中滴加过量氯水: 溶液中滴加过量氯水: |
C.向 溶液中通入少量 溶液中通入少量 : : |
D.向 溶液中通入过量 溶液中通入过量 : :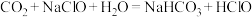 |
您最近一年使用:0次


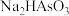 溶液的pH,实验测得含砷各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与溶液pH的关系如图所示,(类比pH的定义,对于稀溶液可以定义
溶液的pH,实验测得含砷各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与溶液pH的关系如图所示,(类比pH的定义,对于稀溶液可以定义 ,
, 。)下列说法正确的是
。)下列说法正确的是
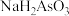 溶液呈酸性
溶液呈酸性

 均为5的
均为5的 溶液和
溶液和 溶液中水的电离程度相同
溶液中水的电离程度相同 的
的 溶液中缓慢通入
溶液中缓慢通入 气体:
气体:
 的某酸式盐
的某酸式盐 的水溶液中:
的水溶液中: