通过对阳极泥的综合处理可以回收贵重金属,一种从铜阳极泥(主要成分为Se、Ag、Ag2Se、Cu、CuSO4和Cu2S等)中分离Ag、Se和Cu的新工艺流程如图所示:
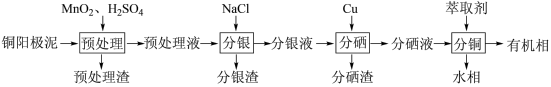
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为_______ 。
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是_______ 。
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:_______ 。
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++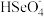 ,
,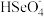
 H++
H++ ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(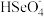 )=
)=_______ (写出含x的计算式)。
(5)分铜得到产品CuSO4·5H2O的具体操作如图:
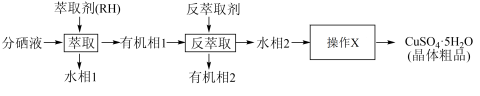
①萃取的原理为:2RH+Cu2+ R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用_______ (填化学式)溶液。
②操作X为_______ ,过滤;
③为了减少CuSO4·5H2O的损失,最好选用_______ 进行洗涤。
A.冷水 B.热水 C.无水乙醇
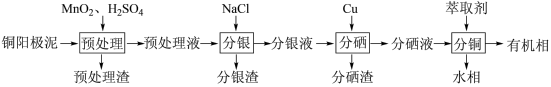
(1)已知预处理温度为80℃,此过程中S元素全部转化为最高价,则预处理时Cu2S发生反应的离子方程式为
(2)比起传统工艺中采用浓硫酸作氧化剂,本工艺中采用稀H2SO4溶液添加MnO2作预处理剂的主要优点是
(3)分银渣可用浓氨水溶液浸出并还原得到单质银,回收分银渣中的银,浸出过程温度不宜过高的原因是:
(4)分硒渣(Cu2Se)经过氧化可得到H2SeO4.已知:H2SeO4=H++
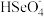 ,
,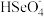
 H++
H++ ,若0.01 mol/LH2SeO4溶液的pH为x,则K(
,若0.01 mol/LH2SeO4溶液的pH为x,则K(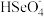 )=
)=(5)分铜得到产品CuSO4·5H2O的具体操作如图:

①萃取的原理为:2RH+Cu2+
 R2Cu+2H+,则反萃取剂最好选用
R2Cu+2H+,则反萃取剂最好选用②操作X为
③为了减少CuSO4·5H2O的损失,最好选用
A.冷水 B.热水 C.无水乙醇
更新时间:2023-11-11 12:16:04
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下, 回答下列问题:_______ 。
(2)Na2B4O7易溶于水,也易发生水解: (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:_______ 。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式_______ 。加入MgO的目的是_______ 。
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
“操作A”是除去MgSO4和CaSO4混合溶液中的CaSO4,根据上表数据,简要说明“操作A”步骤为_______ 。
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:_______ 。
②若选定A为坐标原点,则B的分数坐标为_______ 。
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为_______ g•cm-3(用含a、NA的式子表示)。

(2)Na2B4O7易溶于水,也易发生水解:
 (硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:
(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式
(4)已知MgSO4、CaSO4的溶解度(g/100g)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)NaBH4被称为有机化学中的“万能还原剂”,工业上可由硼砂制取,其晶胞结构及晶胞参数如图所示:

②若选定A为坐标原点,则B的分数坐标为
③NA代表阿伏加德罗常数的值,则NaBH4晶体的密度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
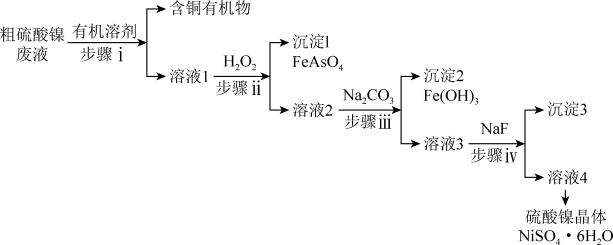
【推荐2】铜冶炼过程中,产生的粗硫酸镍废液中含有Cu2+、Fe2+、Ca2+、Mg2+、H3AsO3等杂质微粒,工业生产以此为原料,精制硫酸镍,主要流程如下:
已知:常温下

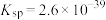

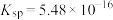

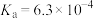
(1)步骤i的操作名称是_______ 。
(2)①H3AsO3中As的化合价为_______ 。
②步骤ⅱ的离子方程式是_______ 。
(3)步骤ⅲ,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-9mol/L。若溶液2中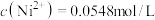 ,则需控制pH的大致范围为
,则需控制pH的大致范围为_______ 。
(4)①步骤ⅳ,沉淀3的主要成分是_______ 。
②加入NaF的同时需调pH约为5,pH过低导致沉淀率下降,原因是_______ 。
(5)结合下图说明由溶液4得到NiSO4·6H2O的操作是_______ 。


已知:常温下

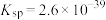

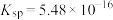

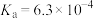
(1)步骤i的操作名称是
(2)①H3AsO3中As的化合价为
②步骤ⅱ的离子方程式是
(3)步骤ⅲ,加入Na2CO3的目的是通过调pH进一步去除Fe3+,使c(Fe3+)≤2.5×10-9mol/L。若溶液2中
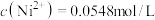 ,则需控制pH的大致范围为
,则需控制pH的大致范围为(4)①步骤ⅳ,沉淀3的主要成分是
②加入NaF的同时需调pH约为5,pH过低导致沉淀率下降,原因是
(5)结合下图说明由溶液4得到NiSO4·6H2O的操作是

您最近一年使用:0次
【推荐3】高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________ 。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____ S(Na2FeO4)(填“>”“<”或“=”)。
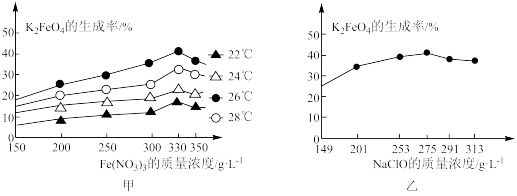
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________ ℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________ 。
③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________ 。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________ 。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________ 溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________ 。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________ 。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:

①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上以软锰矿(主要成分为 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。

已知: ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。
回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有___________ (写一条即可);“高温焙烧”时 、
、 转化为
转化为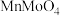 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为___________  ,理由是
,理由是___________ 。
(3)黄钠铁矾的化学式为 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为___________ ;“除铁”后的溶液中 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度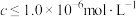 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是___________ [已知 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为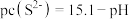 ;忽略溶液体积变化]。
;忽略溶液体积变化]。
(4)“萃取”的原理为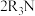 (叔胺)
(叔胺)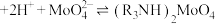 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用___________ (填标号)。
a.稀硫酸 b. 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水
从“母液”中回收的副产品主要是___________ (填名称)。
 ,还含有少量
,还含有少量 )和辉钼矿(主要成分为为
)和辉钼矿(主要成分为为 ,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体
,还含有少量Si、Ni的氧化物)为原料,制备四钼酸铵晶体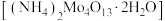 和硫酸锰晶体的工艺流程如下。
和硫酸锰晶体的工艺流程如下。
已知:
 ,常温下,NiS和MnS的
,常温下,NiS和MnS的 分别为19.4和12.6;
分别为19.4和12.6; 。
。回答下列问题:
(1)为了提高焙烧效率,可以采取的措施有
 、
、 转化为
转化为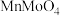 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)“酸浸”时,硫酸浓度对Mo、Mn浸出率的影响如图所示。

“酸浸”时硫酸的最佳浓度为
 ,理由是
,理由是(3)黄钠铁矾的化学式为
 ,生成黄钠铁矾的离子方程式为
,生成黄钠铁矾的离子方程式为 ,当溶液中可溶组分浓度
,当溶液中可溶组分浓度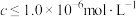 时,可认为已除尽,则“除镍”应控制溶液pH的范围是
时,可认为已除尽,则“除镍”应控制溶液pH的范围是 ,该溶液中
,该溶液中 和pH的关系为
和pH的关系为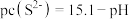 ;忽略溶液体积变化]。
;忽略溶液体积变化]。(4)“萃取”的原理为
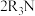 (叔胺)
(叔胺)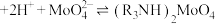 ,则“反萃取”中的试剂X最适宜选用
,则“反萃取”中的试剂X最适宜选用a.稀硫酸 b.
 溶液 c.NaOH溶液 d.氨水
溶液 c.NaOH溶液 d.氨水从“母液”中回收的副产品主要是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
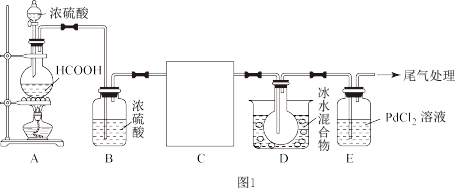
【推荐2】镍的全球消费量仅次于铜、铝、铅、锌,属有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理: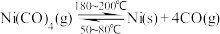 ,实验室用如图所示装置制取
,实验室用如图所示装置制取 。
。
已知: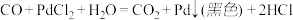 ;
; 熔点为-25℃,沸点为43 ℃,60 ℃以上与空气混合易爆炸;
熔点为-25℃,沸点为43 ℃,60 ℃以上与空气混合易爆炸; 熔点为-20 ℃,沸点为103 ℃。回答下列问题:
熔点为-20 ℃,沸点为103 ℃。回答下列问题:
(1)装置A是用来制取CO,写出发生反应的化学方程式为_________ 。
(2)装置C用于合成 (夹持装置略),最适宜选用的装置为
(夹持装置略),最适宜选用的装置为______ (填标号)。
(3)实验过程中为了防止CO及 与装置中空气混合在加热条件下会发生爆炸,所以要先观察到
与装置中空气混合在加热条件下会发生爆炸,所以要先观察到________ (填实验现象)再加热C装置。
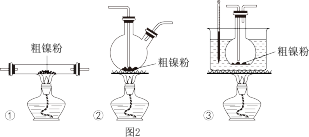
(4)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中装有粗镍粉。再充入CO气体,通过一系列实验操作后,则高纯镍粉在封管的_______ 温度区域端生成(填“323 K”或“473 K”)。(提示323 K是49.85 ℃,473 K是199.85 ℃)

(5)假设实验中有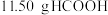 参加反应,C装置参加反应镍的质量为2.95 g,E装置中盛有
参加反应,C装置参加反应镍的质量为2.95 g,E装置中盛有 溶液100 mL,则
溶液100 mL,则 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为______  。
。
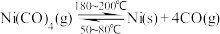 ,实验室用如图所示装置制取
,实验室用如图所示装置制取 。
。
已知:
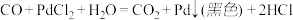 ;
; 熔点为-25℃,沸点为43 ℃,60 ℃以上与空气混合易爆炸;
熔点为-25℃,沸点为43 ℃,60 ℃以上与空气混合易爆炸; 熔点为-20 ℃,沸点为103 ℃。回答下列问题:
熔点为-20 ℃,沸点为103 ℃。回答下列问题:(1)装置A是用来制取CO,写出发生反应的化学方程式为
(2)装置C用于合成
 (夹持装置略),最适宜选用的装置为
(夹持装置略),最适宜选用的装置为
(3)实验过程中为了防止CO及
 与装置中空气混合在加热条件下会发生爆炸,所以要先观察到
与装置中空气混合在加热条件下会发生爆炸,所以要先观察到(4)利用“封管实验”原理可获得高纯镍。如图所示的石英玻璃封管中装有粗镍粉。再充入CO气体,通过一系列实验操作后,则高纯镍粉在封管的

(5)假设实验中有
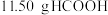 参加反应,C装置参加反应镍的质量为2.95 g,E装置中盛有
参加反应,C装置参加反应镍的质量为2.95 g,E装置中盛有 溶液100 mL,则
溶液100 mL,则 溶液的物质的量浓度至少为
溶液的物质的量浓度至少为 。
。
您最近一年使用:0次
【推荐3】烟气脱硫脱硝是环境治理的热点问题。
(1)氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)ΔH=-1627.2kJ/mol。检验脱硝效果的重要指标是脱硝效率(脱硝过程中单位时间内NOx浓度变化占烟气初始浓度的百分比)。影响SCR系统脱硝效率的因素有很多,根据如图判断提高脱硝效率的最佳条件是__ ;氨氮比一定时,随温度的升高脱硝效率增大,其可能的原因是___ 。

(2)H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。原理:FeY2-(aq)+NO(g) FeY2-(NO)(aq)ΔH<0
FeY2-(NO)(aq)ΔH<0
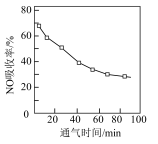
①将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如图。时间越长,NO吸收率越低的原因是___ 。
②生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理为FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14 g铁粉,则所吸收的烟气中含有NO的物质的量为__ mol。
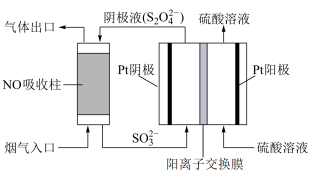
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理NO,装置如图所示:阴极的电极反应式为___ 。
(4)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为____ 。
②加入CaCO3的作用是___ 。
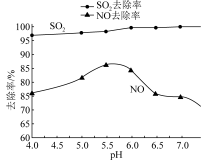
(5)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,溶液pH对脱硫脱硝的影响如图所示:图中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释二者去除率不同的可能原因是__ 。
(1)氧化还原法脱硝:4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g)ΔH=-1627.2kJ/mol。检验脱硝效果的重要指标是脱硝效率(脱硝过程中单位时间内NOx浓度变化占烟气初始浓度的百分比)。影响SCR系统脱硝效率的因素有很多,根据如图判断提高脱硝效率的最佳条件是

(2)H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。原理:FeY2-(aq)+NO(g)
 FeY2-(NO)(aq)ΔH<0
FeY2-(NO)(aq)ΔH<0①将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如图。时间越长,NO吸收率越低的原因是

②生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理为FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14 g铁粉,则所吸收的烟气中含有NO的物质的量为
(3)以连二硫酸盐(S2O42-)为媒介,使用间接电化学法也可处理NO,装置如图所示:阴极的电极反应式为

(4)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为
②加入CaCO3的作用是
(5)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,溶液pH对脱硫脱硝的影响如图所示:图中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释二者去除率不同的可能原因是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】磷酸铁锂是一种锂离子电池材料,该电池正极片主要含有石墨、Al、LiFePO4等物质,还有少量不溶性杂质。采用下列工艺流程回收制备有关物质。

已知:不同温度下,碳酸锂在水中的溶解度如下表所示:
请回答下列问题:
(1)为提高电极片的碱浸率,可以采用的方法有_______ (任写一条即可,题干中的除外)。
(2)得到滤渣2的离子方程式是_______ 。
(3)“沉淀池”中先加试剂X,试剂X不可选用_______ (填下列选项字母),Na2CO3溶液的作用是_______ 。
a.碘水 b.双氧水 c.氨水
(4)写出“滤渣”中加入NaOH溶液时发生反应的离子方程式_______ 。
(5)20℃时,“沉锂”后的溶液中Li2CO3的浓度为_______ mol·L-1(假设溶液密度为1.0148g·mL-1)。
(6)“沉锂”后所得固体需要进行洗涤,洗涤时最好选用_______ (填“冷水”或“热水”)。

已知:不同温度下,碳酸锂在水中的溶解度如下表所示:
| T/℃ | 0 | 10 | 20 | 30 | 50 | 60 | 80 | 100 |
| 溶解度/g | 1.64 | 1.53 | 1.48 | 1.17 | 1.05 | 1.01 | 0.85 | 0.72 |
(1)为提高电极片的碱浸率,可以采用的方法有
(2)得到滤渣2的离子方程式是
(3)“沉淀池”中先加试剂X,试剂X不可选用
a.碘水 b.双氧水 c.氨水
(4)写出“滤渣”中加入NaOH溶液时发生反应的离子方程式
(5)20℃时,“沉锂”后的溶液中Li2CO3的浓度为
(6)“沉锂”后所得固体需要进行洗涤,洗涤时最好选用
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
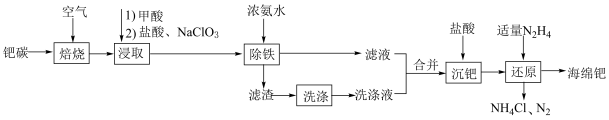
【推荐2】钯(Pd)是一种不活泼的金属,在新型合金、有机催化剂方面应用广泛。以废钯催化剂(简称钯碳,含有5%~6%钯、93%~94%积碳、1%~2%铁等)为原料回收钯的工艺流程如图所示。
(1)“焙烧”的主要目的是_______ ;在实验室进行“焙烧”时,下列仪器中需要用到的是_______ (填仪器名称)。 ,有
,有 (二元强酸)生成,写出生成
(二元强酸)生成,写出生成 反应的离子方程式:
反应的离子方程式:_______ 。
(3)常温下“除铁”时,铁元素恰好沉淀完全时的pH为_______ {结果保留两位小数,已知:常温下,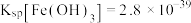 ,该条件下认为溶液中
,该条件下认为溶液中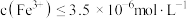 时沉淀完全,lg2=0.3}。
时沉淀完全,lg2=0.3}。
(4)滤渣需要洗涤,并将洗涤液和滤液合并,其目的是_______ 。
(5)“沉钯”时 转化为难溶于冷水的
转化为难溶于冷水的 ,其化学方程式为
,其化学方程式为_______ 。
(6)“还原”过程中还有其他副产物生成,该副产物可循环至_______ 工序利用。
(1)“焙烧”的主要目的是
 ,有
,有 (二元强酸)生成,写出生成
(二元强酸)生成,写出生成 反应的离子方程式:
反应的离子方程式:(3)常温下“除铁”时,铁元素恰好沉淀完全时的pH为
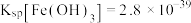 ,该条件下认为溶液中
,该条件下认为溶液中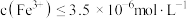 时沉淀完全,lg2=0.3}。
时沉淀完全,lg2=0.3}。(4)滤渣需要洗涤,并将洗涤液和滤液合并,其目的是
(5)“沉钯”时
 转化为难溶于冷水的
转化为难溶于冷水的 ,其化学方程式为
,其化学方程式为(6)“还原”过程中还有其他副产物生成,该副产物可循环至
您最近一年使用:0次
【推荐3】ZnS常用于制造白色颜料,发光粉和发光油漆等。以火法炼铜的废料(主要成分是ZnO、CuO,含少量PbO、As2O3、SiO2等)为原料制备粗锌和硫化锌的流程如下:
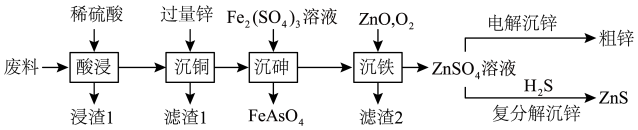
请回答下列问题:
(1)“浸渣1”的主要成分是SiO2和___________ (填化学式)。
(2)从“滤渣1”中提取粗铜的操作是将滤渣1___________ 、过滤、洗涤、干燥,得到粗铜。
(3)“沉铁”中O2的作用是___________ (用离子方程式表示),可用绿色氧化剂___________ (填化学式)替换O2。
(4)“沉铁”过程加入ZnO调节溶液pH,滤液中Fe元素质量浓度、滤渣2中锌元素质量分数与pH关系如图所示。最适宜的pH为___________ 。

(5)以惰性材料为电极,“电解沉锌”的阳极反应式为___________ ,工业上常用电解法精炼锌,阴极材料是___________ ,电解质溶液选择___________ (填化学式)溶液。
(6)“复分解沉锌”中,Zn2++H2S ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=___________ 。[已知;常温下,Ksp(ZnS)= 3.0×10-25,H2S的电离常数Ka1=9.0×10-8,Ka2=1.0×10-12]

请回答下列问题:
(1)“浸渣1”的主要成分是SiO2和
(2)从“滤渣1”中提取粗铜的操作是将滤渣1
(3)“沉铁”中O2的作用是
(4)“沉铁”过程加入ZnO调节溶液pH,滤液中Fe元素质量浓度、滤渣2中锌元素质量分数与pH关系如图所示。最适宜的pH为

(5)以惰性材料为电极,“电解沉锌”的阳极反应式为
(6)“复分解沉锌”中,Zn2++H2S
 ZnS↓+2H+的平衡常数K=
ZnS↓+2H+的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】纳米零价铁可用于去除水体中的六价铬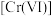 与硝酸盐等污染物。
与硝酸盐等污染物。
(1)用 溶液与
溶液与 (H元素为
(H元素为 价)溶液反应制备纳米零价铁的化学方程式:
价)溶液反应制备纳米零价铁的化学方程式: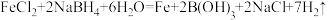 ,当生成
,当生成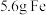 时,转移电子的物质的量为
时,转移电子的物质的量为_______ 。
(2)纳米零价铁可将水体中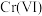 还原为Cr3+,再将Cr3+转化为
还原为Cr3+,再将Cr3+转化为 (两性氢氧化物)从水体中除去。
(两性氢氧化物)从水体中除去。
①室温下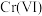 总浓度为
总浓度为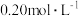 溶液中,含铬物种浓度随pH的分布如图所示。
溶液中,含铬物种浓度随pH的分布如图所示。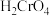 的
的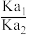 为
为_______ 。

②调节溶液pH,可使Cr3+转化为 沉淀而被除去。但
沉淀而被除去。但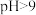 时,铬的去除率却降低,其原因是
时,铬的去除率却降低,其原因是_______ 。
(3)有人研究了用纳米零价铁去除水体中 。
。
①控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如图所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(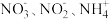 )浓度减少,其可能原因是
)浓度减少,其可能原因是_______ 。

②将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是_______ ; 转化为
转化为 的机理可描述为
的机理可描述为_______ 。

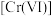 与硝酸盐等污染物。
与硝酸盐等污染物。(1)用
 溶液与
溶液与 (H元素为
(H元素为 价)溶液反应制备纳米零价铁的化学方程式:
价)溶液反应制备纳米零价铁的化学方程式: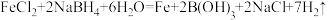 ,当生成
,当生成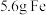 时,转移电子的物质的量为
时,转移电子的物质的量为(2)纳米零价铁可将水体中
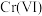 还原为Cr3+,再将Cr3+转化为
还原为Cr3+,再将Cr3+转化为 (两性氢氧化物)从水体中除去。
(两性氢氧化物)从水体中除去。①室温下
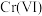 总浓度为
总浓度为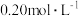 溶液中,含铬物种浓度随pH的分布如图所示。
溶液中,含铬物种浓度随pH的分布如图所示。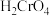 的
的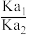 为
为
②调节溶液pH,可使Cr3+转化为
 沉淀而被除去。但
沉淀而被除去。但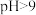 时,铬的去除率却降低,其原因是
时,铬的去除率却降低,其原因是(3)有人研究了用纳米零价铁去除水体中
 。
。①控制其他条件不变,用纳米零价铁还原水体中的
 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如图所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如图所示。与初始溶液中氮浓度相比,反应过程中溶液中的总氮(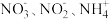 )浓度减少,其可能原因是
)浓度减少,其可能原因是
②将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是 转化为
转化为 的机理可描述为
的机理可描述为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】I.连二次硝酸(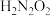 )是一种二元酸。可用于制NO气体。
)是一种二元酸。可用于制NO气体。
(1)连二次硝酸中氮元素的化合价为_______ 。
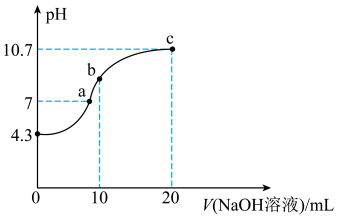
(2)常温下,用0.01 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的
的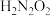 溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
①写出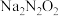 在水溶液中的第一步水解方程式:
在水溶液中的第一步水解方程式:_______ 。
②常温下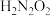 的
的 ≈
≈_______ 。
③a、b、c三点,水的电离程度最小的是_______ 。
II.25℃时,有浓度均为0.10 的下列4种溶液:①NaCN溶液;②NaOH溶液;
的下列4种溶液:①NaCN溶液;②NaOH溶液;
③ 溶液;④
溶液;④ 溶液。相关电离常数如表所示。
溶液。相关电离常数如表所示。
(3)这4种溶液pH由小到大的顺序是_______ (填序号)。
(4)①中各离子浓度由小到大的顺序是_______ 。向NaCN溶液中通入少量 ,发生反应的化学方程式为
,发生反应的化学方程式为_______ 。
(5)测得HCN和NaCN的混合溶液的pH=11,则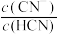 约为
约为_______ 。
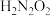 )是一种二元酸。可用于制NO气体。
)是一种二元酸。可用于制NO气体。(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01
 的NaOH溶液滴定10mL0.01
的NaOH溶液滴定10mL0.01 的
的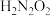 溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
溶液。测得溶液pH与NaOH溶液体积的关系如图所示。
①写出
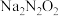 在水溶液中的第一步水解方程式:
在水溶液中的第一步水解方程式:②常温下
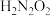 的
的 ≈
≈③a、b、c三点,水的电离程度最小的是
II.25℃时,有浓度均为0.10
 的下列4种溶液:①NaCN溶液;②NaOH溶液;
的下列4种溶液:①NaCN溶液;②NaOH溶液;③
 溶液;④
溶液;④ 溶液。相关电离常数如表所示。
溶液。相关电离常数如表所示。| HCN |  |  |
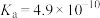 | 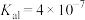  | 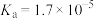 |
(3)这4种溶液pH由小到大的顺序是
(4)①中各离子浓度由小到大的顺序是
 ,发生反应的化学方程式为
,发生反应的化学方程式为(5)测得HCN和NaCN的混合溶液的pH=11,则
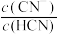 约为
约为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】碳及其化合物的价值型转化在工业生产方面具有重要的研究价值。回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
则CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH =____________ kJ·mol−1。
(2)CO2(g)+H2(g)⇌CO(g)+H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图。

①表示K正曲线的是____________ (填“Ⅰ”或“Ⅱ”)。
②T1时,向体积为10 L的固定容积的容器中充入2 mol CO2、2 mol H2,CO2的平衡转化率为____________ 。
③T2时,A点v正________ v逆(填“>”“=”或“<”)。
(3)CO2捕集是世界性“减碳”课题,我国科研人员提出用氨气、水蒸气实现CO2捕集,最终得到NH4HCO3,反应历程:Ⅰ.CO2(g)+2NH3(g)⇌H2NCOONH4(s),Ⅱ.H2NCOONH4(s)+H2O(g)⇌NH4HCO3(s)+NH3(g)。现将1.75 mol NH3、4.75 mol水蒸气、2.00 mol CO2置于体积为10 L的恒容密闭容器中,分别在不同温度测得CO2浓度随时间变化的数据如表。

①NH4HCO3的分解为____________ 反应(填“放热”或“吸热”)。
②反应Ⅰ的平衡常数为K1,Ⅱ的平衡常数为K2,则CO2(g)+NH3(g)+H2O(g)⇌NH4HCO3(s)的平衡常数K =______ (用K1、K2表示)。
③30℃时,K =____________ 。
(4)乙二酸(H2C2O4)是一种含碳有机二元酸,25℃时,其Ka1=5.6×10−2,Ka2=5.4×10−5,向0.1 mol·L−1乙二酸溶液中滴加NaOH至c(HC2O )=c(C2O
)=c(C2O ),此时溶液显
),此时溶液显________ 性(填“酸”或“碱”),写出推理过程_______________________ 。
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
| 化学键 | H—O | C≡O | C=O | H—H |
| E/(kJ·mol−1) | 463 | 1075 | 803 | 436 |
(2)CO2(g)+H2(g)⇌CO(g)+H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图。

①表示K正曲线的是
②T1时,向体积为10 L的固定容积的容器中充入2 mol CO2、2 mol H2,CO2的平衡转化率为
③T2时,A点v正
(3)CO2捕集是世界性“减碳”课题,我国科研人员提出用氨气、水蒸气实现CO2捕集,最终得到NH4HCO3,反应历程:Ⅰ.CO2(g)+2NH3(g)⇌H2NCOONH4(s),Ⅱ.H2NCOONH4(s)+H2O(g)⇌NH4HCO3(s)+NH3(g)。现将1.75 mol NH3、4.75 mol水蒸气、2.00 mol CO2置于体积为10 L的恒容密闭容器中,分别在不同温度测得CO2浓度随时间变化的数据如表。

①NH4HCO3的分解为
②反应Ⅰ的平衡常数为K1,Ⅱ的平衡常数为K2,则CO2(g)+NH3(g)+H2O(g)⇌NH4HCO3(s)的平衡常数K =
③30℃时,K =
(4)乙二酸(H2C2O4)是一种含碳有机二元酸,25℃时,其Ka1=5.6×10−2,Ka2=5.4×10−5,向0.1 mol·L−1乙二酸溶液中滴加NaOH至c(HC2O
 )=c(C2O
)=c(C2O ),此时溶液显
),此时溶液显
您最近一年使用:0次



