完成下列问题
(1)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
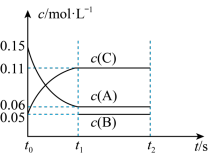
已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若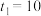 ,则
,则 内反应速率
内反应速率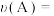
_______ 。
②写出该反应的化学方程式:________ 。
(2)已知部分化学键的键能如表:
①已知生成1mol 放出46kJ热量,则
放出46kJ热量,则
____ 。
②已知工业合成氨反应 ,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有
,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有____ (填序号)。
A.t时刻N2、H2、NH3的浓度不再改变
B.t时刻及其前后容器内气体的密度不再改变
C.t时刻及其前后容器内气体的平均相对分子质量相等
D.t时刻断裂的H−H键数目和生成的N−H键数目相等
③不同催化剂下合成氨反应的历程如下图所示,吸附在催化剂表面的物质用“*”表示。催化剂的催化效果更好的是____ (填“A”或“B”)。

(1)向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
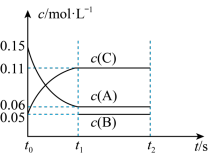
已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若
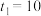 ,则
,则 内反应速率
内反应速率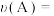
②写出该反应的化学方程式:
(2)已知部分化学键的键能如表:
| 化学键 | N≡N | H−H | N−H |
键能/( ) ) | 946 | 436 | a |
 放出46kJ热量,则
放出46kJ热量,则
②已知工业合成氨反应
 ,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有
,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有A.t时刻N2、H2、NH3的浓度不再改变
B.t时刻及其前后容器内气体的密度不再改变
C.t时刻及其前后容器内气体的平均相对分子质量相等
D.t时刻断裂的H−H键数目和生成的N−H键数目相等
③不同催化剂下合成氨反应的历程如下图所示,吸附在催化剂表面的物质用“*”表示。催化剂的催化效果更好的是

更新时间:2024-01-12 18:10:08
|
相似题推荐
【推荐1】Ⅰ.硅在元素周期表中,处于金属和非金属的交界处,是良好的半导体材料,单晶硅是生产芯片的重要材料。工业冶炼纯硅的原理是:① ;②
;② ;③
;③ 。化学反应与能量变化如图所示,回答下列问题:
。化学反应与能量变化如图所示,回答下列问题:
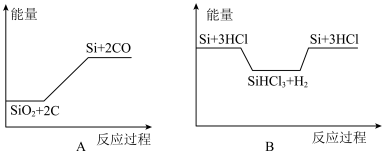
(1)反应①属于_______ 反应(填“吸热”或“放热”)。反应②破坏反应物中的化学键所吸收的能量_______ (填“>”或“<”)形成生成物中化学键所放出的能量。
Ⅱ.化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用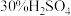 溶液作电解质溶液,其简易装置如图所示。
溶液作电解质溶液,其简易装置如图所示。
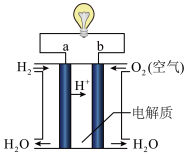
(2)在这个燃料电池中,正极的电极反应式为_______ 。若在标况下,消耗了33.6L的氢气,此时电路中转移的电子数目为_______ (用阿伏加德罗常数表示)。
Ⅲ.1868年狄肯和洪特发明用地康法制氯气,反应原理图示如图所示(反应温度为450℃):

(3)用地康法制备氯气时总反应的方程式为_______ ,其中氧化剂与还原剂的物质的量之比为_______ 。
(4)在该过程中,氧化铜的作用是_______ 。
 ;②
;② ;③
;③ 。化学反应与能量变化如图所示,回答下列问题:
。化学反应与能量变化如图所示,回答下列问题:
(1)反应①属于
Ⅱ.化学能与其他能量间的转换在生活中处处可见,比如某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用
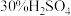 溶液作电解质溶液,其简易装置如图所示。
溶液作电解质溶液,其简易装置如图所示。
(2)在这个燃料电池中,正极的电极反应式为
Ⅲ.1868年狄肯和洪特发明用地康法制氯气,反应原理图示如图所示(反应温度为450℃):

(3)用地康法制备氯气时总反应的方程式为
(4)在该过程中,氧化铜的作用是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】我国力争实现2030年前碳达峰、2060年前碳中和的目标,研究碳的化合物对减少 在大气中累积及实现可再生能源的有效利用具有重要意义。
在大气中累积及实现可再生能源的有效利用具有重要意义。
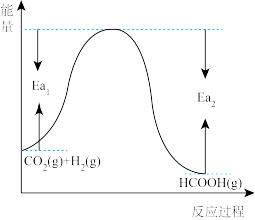
(1)已知 和
和 在一定条件下能发生反应
在一定条件下能发生反应 ,反应物与生成物的能量与活化能的关系如图所示,该反应的
,反应物与生成物的能量与活化能的关系如图所示,该反应的
______ kJ/mol(用含 和
和 的代数式表示)。
的代数式表示)。
(2)恒温恒容条件下,为了提高 反应中
反应中 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为______ (任写一项)。
(3)下列能说反应 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。
(4)一定温度下,在一刚性密闭容器中,充入等物质的量的 和
和 此时容器的压强为48kPa,发生反应
此时容器的压强为48kPa,发生反应 ,6min时达到平衡,此时容器压强为36kPa,则0~6min内用
,6min时达到平衡,此时容器压强为36kPa,则0~6min内用 分压表示的化学反应速率为
分压表示的化学反应速率为______ kPa/min。相同温度下,该反应的逆反应平衡常数
______ kPa( 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。
(5)除合成甲酸(HCOOH)外,有科学家以 、
、 为原料合成
为原料合成 达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol
Ⅱ.
 kJ⋅mol
kJ⋅mol
不同条件下,按照 投料,
投料, 的平衡转化率如图所示:
的平衡转化率如图所示:

压强 、
、 、
、 由小到大的顺序是
由小到大的顺序是______ 。压强为 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而升高的原因是
的平衡转化率随温度升高而升高的原因是________________________ 。
(6)近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示:
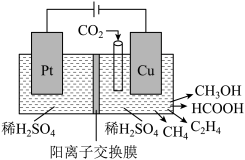
请写出Cu电极上产生 的电极反应式
的电极反应式______ 。
 在大气中累积及实现可再生能源的有效利用具有重要意义。
在大气中累积及实现可再生能源的有效利用具有重要意义。(1)已知
 和
和 在一定条件下能发生反应
在一定条件下能发生反应 ,反应物与生成物的能量与活化能的关系如图所示,该反应的
,反应物与生成物的能量与活化能的关系如图所示,该反应的
 和
和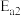 的代数式表示)。
的代数式表示)。
(2)恒温恒容条件下,为了提高
 反应中
反应中 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(3)下列能说反应
 达到平衡状态的是______(填字母)。
达到平衡状态的是______(填字母)。A.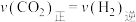 | B.HCOOH的体积分数不再变化 |
| C.混合气体的密度不再变化 | D. |
(4)一定温度下,在一刚性密闭容器中,充入等物质的量的
 和
和 此时容器的压强为48kPa,发生反应
此时容器的压强为48kPa,发生反应 ,6min时达到平衡,此时容器压强为36kPa,则0~6min内用
,6min时达到平衡,此时容器压强为36kPa,则0~6min内用 分压表示的化学反应速率为
分压表示的化学反应速率为
 是平衡分压代替平衡浓度计算的平衡常数)。
是平衡分压代替平衡浓度计算的平衡常数)。(5)除合成甲酸(HCOOH)外,有科学家以
 、
、 为原料合成
为原料合成 达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:
达到有效降低空气中二氧化碳含量的目的,其中涉及的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol
Ⅱ.

 kJ⋅mol
kJ⋅mol
不同条件下,按照
 投料,
投料, 的平衡转化率如图所示:
的平衡转化率如图所示:
压强
 、
、 、
、 由小到大的顺序是
由小到大的顺序是 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而升高的原因是
的平衡转化率随温度升高而升高的原因是(6)近年来,有研究人员用
 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示:
的回收利用,其工作原理如图所示:
请写出Cu电极上产生
 的电极反应式
的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、电能等不同形式的能量。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H2 2NH3中,每生成2molNH3
2NH3中,每生成2molNH3___________ (填“吸收”或“放出”)热量___________ kJ。
(2)Mg、Al设计成如图所示原电池装置:
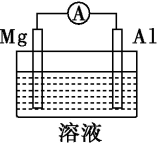
①若溶液为盐酸,Mg为___________ 极;
②若溶液为氢氧化钠溶液,负极的电极反应为___________ 。
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。
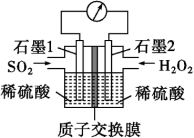
①石墨1为___________ (填“正极”或“负极”);
②正极的电极反应式为___________ 。
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为___________ 。
(1)H2可用于工业合成氨气,已知拆开1molH—H、1molN≡N分别需要吸收的能量为436kJ、946kJ,形成1molN—H会放出能量391kJ,则在反应N2+3H2
 2NH3中,每生成2molNH3
2NH3中,每生成2molNH3(2)Mg、Al设计成如图所示原电池装置:

①若溶液为盐酸,Mg为
②若溶液为氢氧化钠溶液,负极的电极反应为
(3)电化学法处理SO2是目前研究的热点。利用过氧化氢吸收SO2可消除SO2污染,设计装置如图所示。

①石墨1为
②正极的电极反应式为
②若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】Ⅰ、在某温度时,在0.5L的恒容容器中发生气体M、N两种物质的相互转化,M、N的物质的量随时间变化的曲线如图所示,请根据图中数据分析,完成下列问题:
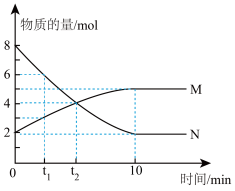
(1)该反应的化学方程式___________ 。
(2)反应开始的一瞬间进行的反应___________ (填“只有正反应发生”或者“只有逆反应发生”、“正、逆反应同时发生”),在t2时刻M的正反应速率___________ M的逆反应速率(填“大于”或者“小于”、“等于”),反应进行到10min时,N的平均反应速率为___________ 。
Ⅱ、被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
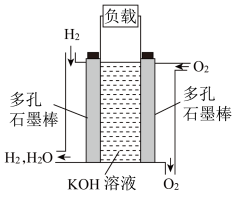
(3)O2进入的电极为___________ (填“正极”或“负极”)。
(4)电池工作时,溶液中的OH−向___________ (填“正极”或“负极”)迁移。
(5)若电池工作时转移0.04mol电子,理论上消耗标准状态下___________ mL O2。

(1)该反应的化学方程式
(2)反应开始的一瞬间进行的反应
Ⅱ、被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:

(3)O2进入的电极为
(4)电池工作时,溶液中的OH−向
(5)若电池工作时转移0.04mol电子,理论上消耗标准状态下
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐2】I:磷酸氯喹是治疗新型肺炎的潜力药。磷酸是合成该药的初级原料之一,沸点高,难挥发。化学兴趣小组设计了合成磷酸的流程如图。回答下列问题
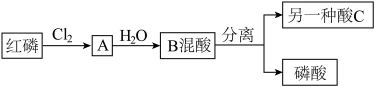
(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图
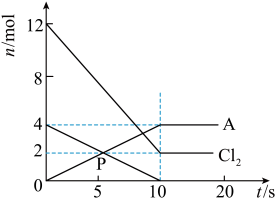
①该反应的化学方程式为___________ (A用化学式表示)
②前10s的平均反应速率v(Cl2)=_______
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是___________ (写名称)
②A与热水反应的化学方程式为____________ 。
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图______________ ,并作相应标注(标明正负极材料及电解质溶液的名称,电子移动方向、离子移动方向)。
(2)该装置中负极的电极方程式为________ 。
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子__________ mol。

(1)将一定量的红磷与氯气置于容积为2L的恒温恒容(温度,体积均不变)反应器中制取A,各物质的物质的量与时间关系如下图

①该反应的化学方程式为
②前10s的平均反应速率v(Cl2)=
(2)将A加入热水中,生成两种酸。一种为磷酸,反应过程各元素化合价不变。
①另一种是酸C是
②A与热水反应的化学方程式为
II(1)将反应Cu+2FeCl3=2FeCl2+CuCl2设计成原电池,完成该原电池的装置示意图
(2)该装置中负极的电极方程式为
(3)若在反应过程中电极减轻3.2g,则在导线中通过电子
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】 温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为
温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为 和
和 时,Y的体积分数与时间关系如图Ⅱ。
时,Y的体积分数与时间关系如图Ⅱ。

(1)写出容器中发生反应的方程式___________ ;正反应为___________ 反应(填“放热”或“吸热”)。
(2)当 时,该反应
时,该反应___________ 达到平衡状态(填“已”或“未”);由图Ⅰ,若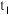 为10min,则
为10min,则 时间内,
时间内,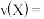
___________ ; 时平衡常数K=
时平衡常数K=___________ (保留小数点后一位)。
(3)其它条件不变,再充入一定量X,平衡___________ 移动(填“正向”、“逆向”、或“不”),X的转化率___________ (填“增大”、“减小”、或“不变”)。
 温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为
温度时,在容积为1L的密闭容器中,X、Y、Z三种气体的浓度随时间变化如图Ⅰ。其它条件不变,当温度分别为 和
和 时,Y的体积分数与时间关系如图Ⅱ。
时,Y的体积分数与时间关系如图Ⅱ。
(1)写出容器中发生反应的方程式
(2)当
 时,该反应
时,该反应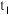 为10min,则
为10min,则 时间内,
时间内,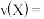
 时平衡常数K=
时平衡常数K=(3)其它条件不变,再充入一定量X,平衡
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】氮是自然界各种生物体生命活动不可缺少的重要元素。
(1)下列说法中,不正确的是___________ (填字母序号)。
a.氮原子的最外层有5个电子,氮气分子中存在氮氮三键,常温下化学性质稳定
b.氮元素位于元素周期表的第二周期,第VA族
c.氮元素的最低化合价为-3价,最高化合价为+5价
d.根据元素周期律推测,氮化硅的化学式为SiN
(2)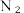 分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是
分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是 (铵根离子),将
(铵根离子),将 转化为
转化为  需与
需与___________ (填“酸”或“碱”)反应。写出该反应离子方程式:___________ 和 的电子式
的电子式___________ 。
(3)大自然通过闪电可将空气中的氮气转化为含氮化合物,从而实现自然固氮。该过程中生成的含氮化合物是___________ 。
(4)我国科研团队借助一种固体催化剂(LDH),在常温常压和可见光作用下实现了人工固氮。其过程如图所示。写出该过程中反应的化学方程式:___________ 。___________ 。
(6)上述流程中,需要使用催化剂的反应是___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”),使用催化剂的目的是___________ 。
(7)工业合成氨反应为: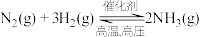 对其描述正确的是___________(填序号)。
对其描述正确的是___________(填序号)。
(8)采用上述工业制硝酸的流程,若 (已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为
(已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为___________ g。
(1)下列说法中,不正确的是
a.氮原子的最外层有5个电子,氮气分子中存在氮氮三键,常温下化学性质稳定
b.氮元素位于元素周期表的第二周期,第VA族
c.氮元素的最低化合价为-3价,最高化合价为+5价
d.根据元素周期律推测,氮化硅的化学式为SiN
(2)
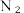 分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是
分子不能被大多数动植物直接吸收。植物吸收和利用效果最好的是 (铵根离子),将
(铵根离子),将 转化为
转化为  需与
需与 的电子式
的电子式(3)大自然通过闪电可将空气中的氮气转化为含氮化合物,从而实现自然固氮。该过程中生成的含氮化合物是
(4)我国科研团队借助一种固体催化剂(LDH),在常温常压和可见光作用下实现了人工固氮。其过程如图所示。写出该过程中反应的化学方程式:
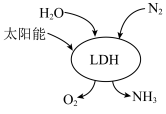
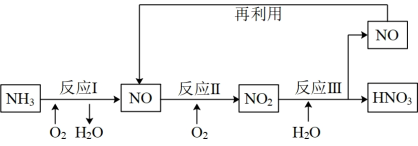
(6)上述流程中,需要使用催化剂的反应是
(7)工业合成氨反应为:
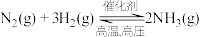 对其描述正确的是___________(填序号)。
对其描述正确的是___________(填序号)。A.在上述条件下,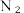 能全部转化为 能全部转化为 |
| B.若其他条件一定时,增大氮气的浓度,可增大反应速率 |
| C.达到平衡时,体系中各物质的浓度一定相等 |
| D.当正反应速率等于逆反应速率且不为零时,该反应达到平衡状态 |
(8)采用上述工业制硝酸的流程,若
 (已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为
(已折算成标准状况的气体体积)完全反应生成硝酸,理论上生成硝酸的质量为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】氢气在实验室和工业上有着广泛的用途。请回答:
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.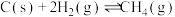

Ⅱ.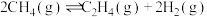

Ⅲ.
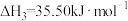
Ⅳ.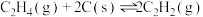

通过计算说明反应Ⅳ自发进行的条件_______ 。
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
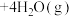 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:
①反应的平衡常数表达式为_______ 。
②达到平衡时, 的转化率为
的转化率为_______ 。
(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:
 ,分为两步:
,分为两步:
已知投料的组成为 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
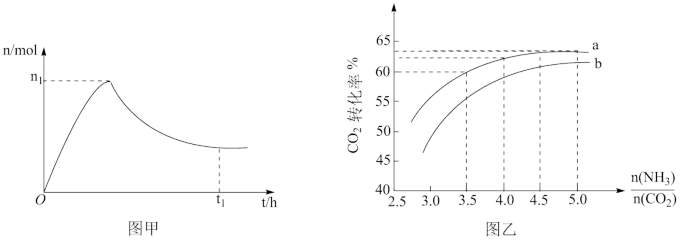
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(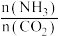 )与水碳比(
)与水碳比(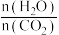 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、 ,请写出第一步的化学方程式
,请写出第一步的化学方程式_______ 。
②下列叙述正确的是_______ 。
A.反应Ⅰ的活化能大于反应Ⅱ,
B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线_______ 。
(1)氢气可以与煤在催化剂作用下制备乙炔,已知部分反应如下:
Ⅰ.
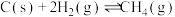

Ⅱ.
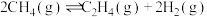

Ⅲ.

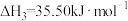
Ⅳ.
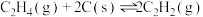

通过计算说明反应Ⅳ自发进行的条件
(2)利用氢气与二氧化碳催化反应合成乙烯,是实现低碳转型的一条途径。在0.1MPa、120℃条件下,以
 的投料比充入体积固定的密闭容器中,发生反应:
的投料比充入体积固定的密闭容器中,发生反应:
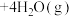 ,平衡时水蒸气的物质的量百分数为50.0%。请回答:
,平衡时水蒸气的物质的量百分数为50.0%。请回答:①反应的平衡常数表达式为
②达到平衡时,
 的转化率为
的转化率为(3)氢气可合成氨气,氨气与二氧化碳可以合成尿素,反应为:

 ,分为两步:
,分为两步:反应步骤 | 反应方程式 |
|
| Ⅰ | 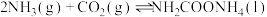  | 快速放热 |
| Ⅱ |  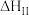 | 慢速吸热 |
已知投料的组成为
 、
、 和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵(
和水蒸气(有助于分离尿素),一定条件下,氨基甲酸铵( )物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(
)物质的量与时间的关系图(图甲,t1后物质的量不再改变),以及不同氨碳比(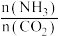 )与水碳比(
)与水碳比(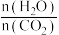 )投料时
)投料时 平衡转化率图象(图乙,a、b代表水碳比):
平衡转化率图象(图乙,a、b代表水碳比):
回答下列问题:
①已知反应I又可以分成两步:_______、
 ,请写出第一步的化学方程式
,请写出第一步的化学方程式②下列叙述正确的是
A.反应Ⅰ的活化能大于反应Ⅱ,

B.增大氨碳比有利于提高尿素产率,原因之一是过量氨气与反应Ⅱ生成的水反应,促进平衡正移
C.实际生产中若选择曲线a,则氨碳比应控制在4.0左右
D.曲线a的水碳比大于曲线b,减小水碳比有利于尿素生成
③如果某催化剂可以同等程度地加速反应Ⅰ和Ⅱ,请在图甲中画出保持其他条件不变,加入该催化剂后从0h到t1时的氨基甲酸铵物质的量变化曲线
您最近一年使用:0次
【推荐3】页岩气中含有CH4、CO2、H2S等气体,是蕴藏于页岩层可供于开采的天然气资源。页岩气的有效利用需要处理其中所含的CO2和H2S。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=_______ kJ/mol。
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。
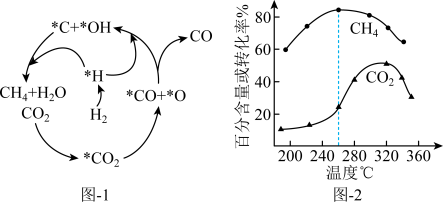
①260℃时,生成生要产物的所发生反应的化学方程式为_______ 。
②温度高于320℃,CO2的转化率下降的原因是_______ 。
③描述CO2转化为CO的反应机理_______ 。
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。
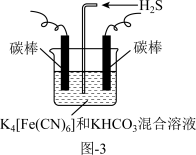
(3)电解时,阳极的电极反应式为_______ 。
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。
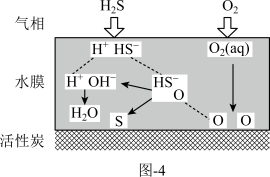
其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是_______ 。
Ⅰ.CO2的处理:
(1)CO2和CH4重整可制合成气(主要成分为CO、 H2)。
已知下列热化学反应方程式:
C(s)+2H2(g) = CH4(g) ΔH = -74.5 kJ / mol
CO(g)+H2O(g) = CO2(g)+ H2(g) ΔH = - 40.0 kJ / mol
C(s) + H2O(g) = CO(g)+H2(g) ΔH = +132.0 kJ / mol
反应CO2(g) + CH4(g) = 2CO(g)+ 2H2(g)的ΔH=
(2)Ni催化CO2加 H2形成CH4 ,其历程如图-1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中CH4百分含量及CO2的转化率随温度的变化如图-2所示。

①260℃时,生成生要产物的所发生反应的化学方程式为
②温度高于320℃,CO2的转化率下降的原因是
③描述CO2转化为CO的反应机理
Ⅱ. H2S的处理:
方法一:工业上常采用如图-3电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S转化为可利用的硫单质,自身转化为K4[Fe(CN)6]。

(3)电解时,阳极的电极反应式为
方法二:表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用如图-4表示。

其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。
(4)适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】I.氮及其化合物的转化过程如下图所示,其中下图为反应①过程中能量变化的曲线图。
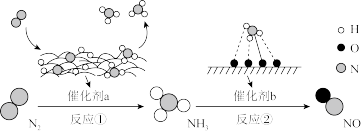
(1)下图中曲线_______ (填字母)是加入催化剂a时的能量变化曲线,该反应破坏生成物全部化学键所需要的总能量_______ (填“大于”或“小于”或“等于”)破坏反应物全部化学键所需要的总能量。
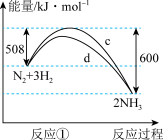
(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为_____ 。
(3)下列说法正确的是_______。
II.某同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(4)求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______ 。(设溶液体积不变)
(5)有同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给予分析:构成的原电池中负极反应式为_______ ;溶液中H+移向_______ 极(填“正“或“负")。
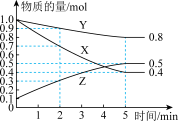
III.某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
(6)写出该反应的化学方程式_______ 。
(7)在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
(8)该反应达平衡时,X的转化率为_______ 。

(1)下图中曲线

(2)标准状况下进行反应②,若有1.25mol电子发生转移,则参加反应的NH3的体积为
(3)下列说法正确的是_______。
| A.合成氨在工业生产中常将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.工业合成氨中,为加快化学反应速率,压强和温度越高越好 |
| C.合成氨工业要用合适的催化剂,目的是降低该反应的活化能 |
| D.工业合成氨中反应物不能百分之百转化为生成物 |
II.某同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
(5)有同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给予分析:构成的原电池中负极反应式为
III.某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

(6)写出该反应的化学方程式
(7)在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是_______。
| A.X、Y、Z的浓度相等 | B.容器内气体压强保持不变 |
| C.X、Y的反应速率比为3∶1 | D.生成1molY的同时生成2molZ |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
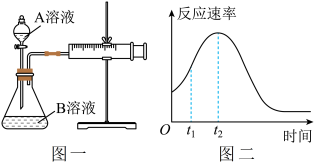
【推荐2】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)该实验探究的是____ 因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___ (填实验序号)。
(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___ 来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____ 。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g)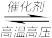 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___ 。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___ ;此时H2的转化率为___ 。
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
| ② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g)
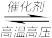 2NH3(g)。
2NH3(g)。(1)下列描述能说明该可逆反应达到化学平衡状态的有
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%,CO2可转化成有机物实现碳循环,有效降低碳排放。
(1)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)ΔH=-49.0kJ∙mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
①计算:从0min到3min,H2的平均反应速率v(H2)=_____ mol∙L-1∙min-1。
②能说明上述反应达到平衡状态的是_____ (填编号)。
A.c(CO2)∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有_____ (填编号)。
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)将CO2通入适量氢氧化钠溶液中进行处理时,可生成Na2CO3溶液,在Na2CO3溶液中,下列关系式错误的是_____ 。
A.c( )>c(OH-)>c(
)>c(OH-)>c( )
)
B.c(Na+)=2c( )+2c(
)+2c( )+2c(H2CO3)
)+2c(H2CO3)
C.c(OH-)=c(H+)+c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)+c(H+)=c( )+c(
)+c( )+c(OH-)
)+c(OH-)
(3)煤燃烧产生的烟气中含有氮的氧化物,用甲烷催化氧化可以还原NOx原理为:
①CH4(g)+2NO2(g)⇌ CO2(g)+N2(g)+H2O(g)ΔH=-867.0kJ/mol;
②N2(g)+2O2(g)⇌2NO2(g) ΔH=+67.8kJ/mol;
③适量的N2和O2完全反应,每生成标准状况下11.2LNO 时,则吸收45kJ的热量,则CH4催化还原NO的热化学反应方程式为_____ 。
(4)已知A(g)+B(g)⇌C(g)+D(g)ΔH,反应的平衡常数和温度的关系如下:
回答下列问题:
830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=_____ 。

(1)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g)ΔH=-49.0kJ∙mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
①计算:从0min到3min,H2的平均反应速率v(H2)=
②能说明上述反应达到平衡状态的是
A.c(CO2)∶c(CH3OH)=1∶1
B.混合气体的密度不再发生变化
C.单位时间内消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
③反应达到平衡后,保持其他条件不变,能加快反应速率且使体系中气体的物质的量减少,可采取的措施有
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
(2)将CO2通入适量氢氧化钠溶液中进行处理时,可生成Na2CO3溶液,在Na2CO3溶液中,下列关系式错误的是
A.c(
 )>c(OH-)>c(
)>c(OH-)>c( )
)B.c(Na+)=2c(
 )+2c(
)+2c( )+2c(H2CO3)
)+2c(H2CO3)C.c(OH-)=c(H+)+c(
 )+2c(H2CO3)
)+2c(H2CO3)D.c(Na+)+c(H+)=c(
 )+c(
)+c( )+c(OH-)
)+c(OH-)(3)煤燃烧产生的烟气中含有氮的氧化物,用甲烷催化氧化可以还原NOx原理为:
①CH4(g)+2NO2(g)⇌ CO2(g)+N2(g)+H2O(g)ΔH=-867.0kJ/mol;
②N2(g)+2O2(g)⇌2NO2(g) ΔH=+67.8kJ/mol;
③适量的N2和O2完全反应,每生成标准状况下11.2LNO 时,则吸收45kJ的热量,则CH4催化还原NO的热化学反应方程式为
(4)已知A(g)+B(g)⇌C(g)+D(g)ΔH,反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | x | 0.6 | 0.4 |
回答下列问题:
830℃时,向一个2L的密闭容器中充入0.20mol的A和0.80mol的B,反应至10s时达到平衡,测得A的转化率为80%,计算830℃时,反应的平衡常数x=

您最近一年使用:0次



