回答下列问题:
(1)基态Li原子的电子排布式为___________ ,其处于元素周期表中的___________ (填“s”、“d”、“ds”或“p”)区。
(2)现有4种元素的基态原子的电子排布式如下:①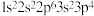 ;②
;② ;③
;③ ;④
;④ 。则下列比较中,正确的是___________。
。则下列比较中,正确的是___________。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②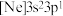 、③
、③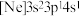 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(4)在第四周期元素中,未成对电子数最多的元素是___________ (写元素符号),它的价层电子的轨道表达式___________ 。
(5)Cu与Zn相比,第二电离能与第一电离能差值更大的是___________ (写元素符号),原因是___________ 。
(1)基态Li原子的电子排布式为
(2)现有4种元素的基态原子的电子排布式如下:①
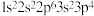 ;②
;② ;③
;③ ;④
;④ 。则下列比较中,正确的是___________。
。则下列比较中,正确的是___________。| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高化合价:④>③=②>① |
 、②
、②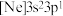 、③
、③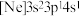 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(5)Cu与Zn相比,第二电离能与第一电离能差值更大的是
更新时间:2024-01-16 15:50:38
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是___ ;

(2)Se原子的原子序数为___ ,基态电子的排布式为[Ar]___ ;
(3)H2Se的稳定性比H2S___ (填“强”或“弱”)。SeO3分子的立体构型为___ 。
(4)下列分子中含手性碳的是___ 。
a. b.
b.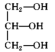 c.
c. d.CH3CHClCH2CHO
d.CH3CHClCH2CHO
(5)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因___ ;氮元素的E1呈现异常的原因是___ 。

(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(2)Se原子的原子序数为
(3)H2Se的稳定性比H2S
(4)下列分子中含手性碳的是
a.
 b.
b. c.
c. d.CH3CHClCH2CHO
d.CH3CHClCH2CHO(5)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】如图所示是元素周期表的一部分,表中所列字母分别代表一种元素。

试回答下列问题:
(1)以上元素中,属于d区元素的是_______ (填元素符号),元素k在周期表的位置是_______ 。
(2)画出c的核外电子排布图_______ ,这样排布遵循了构造原理、_______ 原理和_______ 规则。
(3)元素c的电负性_______ 元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是_______ (用元素符号表示);第三周期元素最高价氧化物对应的水化物中,酸性最强的是_______ (填化合物的化学式)。

试回答下列问题:
(1)以上元素中,属于d区元素的是
(2)画出c的核外电子排布图
(3)元素c的电负性
您最近一年使用:0次
【推荐3】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为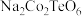 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为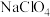 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:
(1)基态Na原子中,核外电子占据的原子轨道总数为_______ ,Te属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
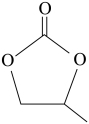
(2) 的空间结构为
的空间结构为_______ ,碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为_______ ,1mol碳酸丙烯酯中 键的数目为
键的数目为_______ 。
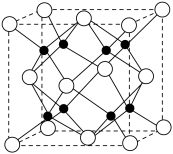
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为_______ ,该晶胞的密度为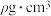 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为_______ cm(用含有 、
、 的代数式表示)。
的代数式表示)。
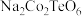 (制备原料为
(制备原料为 、
、 和
和 ),电解液为
),电解液为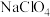 的碳酸丙烯酯溶液。回答下列问题:
的碳酸丙烯酯溶液。回答下列问题:(1)基态Na原子中,核外电子占据的原子轨道总数为
(2)
 的空间结构为
的空间结构为 键的数目为
键的数目为
(3)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为
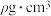 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Na与O之间的最短距离为
,则Na与O之间的最短距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】已知A、B、C、D、E、F都是元素周期表中前36号元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,C原子基态时s电子数与p电子数相等,D在元素周期表的各元素中电负性最大,E的基态原子核外有6个能级且全部充满电子,F原子基态时未成对电子数是同周期元素中最多的。
(1)F元素的名称是________ ,基态F原子的价电子轨道表示式_________ 画出AC2的电子式_______________ E元素常见离子的电子排布式______________ 。
(2)A、B、C的电负性大小顺序(填元素符号,下同)______________ ,第一电离能大小顺序为_________________ 。
(1)F元素的名称是
(2)A、B、C的电负性大小顺序(填元素符号,下同)
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】硫、硒、碲的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛。回答下列问题:
(1)基态Se原子的最高能级组的电子排布式为
(2)下列有关氧族元素单质及其化合物的性质说法正确的是_______。
A.氧族元素气态氢化物的稳定性按 、 、 、 、 、 、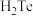 的顺序依次减弱 的顺序依次减弱 |
B.其氢化物中的键长按 、 、 、 、 、 、 的顺序依次减小 的顺序依次减小 |
C.其阴离子的还原性按 、 、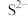 、 、 、 、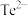 的顺序依次增强 的顺序依次增强 |
D.其最高价氧化物的水化物酸性按 、 、 、 、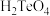 顺序依次增强 顺序依次增强 |
 分子结构式为
分子结构式为 中含有π键的数目为
中含有π键的数目为 结构有两种,已知硫氰酸(
结构有两种,已知硫氰酸( )的沸点低于异硫氰酸(
)的沸点低于异硫氰酸( ),其原因是
),其原因是(4)
 分子结构如图所示,已知键角
分子结构如图所示,已知键角 为
为 ,
, 为
为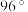 ,则
,则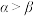 的原因主要是
的原因主要是
(5)二硒键和二硫键是重要的光响应动态共价键(在特定条件下断开并能复原的化学键),其光响应原理可用如图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:
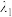
 ,(填“>”或“<”或“=”),其原因是
,(填“>”或“<”或“=”),其原因是
您最近一年使用:0次
【推荐3】氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为_______ 。
②BH 的空间构型是
的空间构型是_______ (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2⇌2NH3实现储氢和输氢。下列说法正确的是_______。
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。C60晶体易溶于苯、CS2,说明C60是_______ 分子(选填“极性”或“非极性”)。
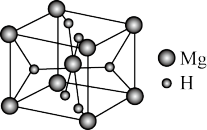
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为_______ cm3[用a、NA表示(NA表示阿伏加德罗常数的数值)]。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为
②BH
 的空间构型是
的空间构型是(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2⇌2NH3实现储氢和输氢。下列说法正确的是_______。
| A.NH3分子中N原子采用sp3杂化 |
| B.相同压强时,NH3沸点比PH3高 |
| C.[Cu(NH3)4]2+中,N原子是配位原子 |
D.CN-的电子式为[∶C︙︙N∶]-,C60分子结构 |
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】有四种前四周期的元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)基态A原子的核外电子排布式为_______ 。
(2)B元素在元素周期表中第_______ 族。
(3)C的基态原子的轨道表示式为_______ ,其原子核外有_______ 个未成对电子,能量最高的电子为_______ 轨道上的电子。
(4)B的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为_______ ;与D的氢化物的水溶液反应的化学方程式为_______ 。
| 元素 | 结构、性质等 |
| A | 单质是应用最广泛的金属 |
| B | 第三周期元素,其最高价氧化物对应的水化物呈两性 |
| C | 气态氢化物极易溶于水,可用作制冷剂 |
| D | 海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水处理过程中常用的消毒杀菌剂 |
(1)基态A原子的核外电子排布式为
(2)B元素在元素周期表中第
(3)C的基态原子的轨道表示式为
(4)B的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】亚铁氰化钾( )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(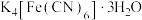 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(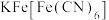 )。回答下列问题。
)。回答下列问题。
(1)O元素位于___________ 区,基态O原子核外电子的空间运动状态有___________ 种。
(2)Fe在元素周期表中的位置___________ ,基态Fe原子的价电子轨道表示式为___________ 。
(3)黄血盐(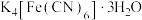 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是___________ , 该原子能量最高的电子所在能级符号为___________ 。
(4)亚铁氰化钾( )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为___________ 。
(5)普鲁士蓝(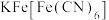 )中C的杂化方式为
)中C的杂化方式为___________ 。
 )是一种常见的食盐抗结剂,其三水合物(
)是一种常见的食盐抗结剂,其三水合物(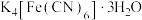 )是黄色晶体,俗称黄血盐,遇
)是黄色晶体,俗称黄血盐,遇 立即产生深蓝色沉淀(
立即产生深蓝色沉淀(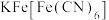 )。回答下列问题。
)。回答下列问题。(1)O元素位于
(2)Fe在元素周期表中的位置
(3)黄血盐(
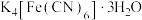 )中四种非金属元素的第一电离能最大的是
)中四种非金属元素的第一电离能最大的是(4)亚铁氰化钾(
 )中四种元素的电负性由大到小的顺序为
)中四种元素的电负性由大到小的顺序为(5)普鲁士蓝(
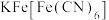 )中C的杂化方式为
)中C的杂化方式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,且是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等;D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:A_____ ,B_____ ,C_____ ,D_____ 。
(2)写出C、D两种元素基态原子核外电子排布的轨道表示式。C_____ ,D_____ 。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:_____ 。
(4)写出B元素单质和氢化物的电子式,单质_____ ,氢化物_____ 。
(5)C元素位于第_____ 周期_____ 族。A、B、C、D四种元素原子半径由大到小顺序是_____ 。B、C离子半径大小是_____ 。
(1)写出四种元素的元素符号:A
(2)写出C、D两种元素基态原子核外电子排布的轨道表示式。C
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:
(4)写出B元素单质和氢化物的电子式,单质
(5)C元素位于第
您最近一年使用:0次
【推荐1】X、Y、Z、W是元素周期表前四周期中的常见元素,其原子序数依次增大。X元素的一种核素的质量数为12,中子数为6;Y元素是动植物生长不可缺少的、构成蛋白质的重要组成元素;Z的基态原子核外9个原子轨道上填充了电子且有2个未成对电子,与X不同族;W是一种常见元素,可以形成一种具有磁性的黑色晶体氧化物。
(1)写出下列元素的名称:X__________ ,Y__________ ,Z__________ 。
(2)X—H和Y—H属于极性共价键,其中极性较强的是________ (X、Y用元素符号表示)。X的第一电离能比Y的________ (填“大”或“小”)。
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:_______________ 。
(4)W的基态原子的价层电子排布式为_________________ 。
(5)Y元素的核外电子轨道表达式为________________ 。
(1)写出下列元素的名称:X
(2)X—H和Y—H属于极性共价键,其中极性较强的是
(3)写出X的单质与Z的最高价氧化物对应水化物的浓溶液反应的化学方程式:
(4)W的基态原子的价层电子排布式为
(5)Y元素的核外电子轨道表达式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】下图是元素周期表的一部分,用化学用语回答下列问题:
(1)元素D的元素符号是______ ,元素Y所处的族序号是______ 。
(2)下列是元素X的某些原子的电子排布图,能量最高的原子是______(填字母)。
(3)元素F的基态原子中最高能层符号是______ ,元素J的基态原子中最高能级符号是______ 。
(4)元素H的基态原子的价层电子排布式______ ,元素L的基态原子的简化电子排布式______ 。
(5)画出元素I的原子结构示意图______ 。
(6)第三周期所列六种元素中,电负性最大的是______ (填元素符号,下同),原子半径最大的是______ ,第一电离能最小的是______ 。形成的简单离子中,离子半径最小的是______ 。
族 周期 | ⅠA 族 | O 族 | ||||||||||||||||
一 | A | |||||||||||||||||
二 | X | E | Y | |||||||||||||||
三 | B | F | G | I | J | K | ||||||||||||
四 | M | H | D | L |
(1)元素D的元素符号是
(2)下列是元素X的某些原子的电子排布图,能量最高的原子是______(填字母)。
A.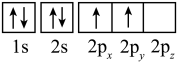 | B.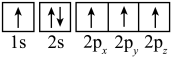 |
C. | D.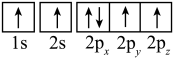 |
(3)元素F的基态原子中最高能层符号是
(4)元素H的基态原子的价层电子排布式
(5)画出元素I的原子结构示意图
(6)第三周期所列六种元素中,电负性最大的是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题。
(1)写出F元素的电子排布式:________ 。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为________ 。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是_________ 。
(4)B、C、D、E的第一电离能由大到小的顺序是________ (写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________ (写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:晶胞中距离一个B+最近的B+有________ 个;B+的配位数是________ 。
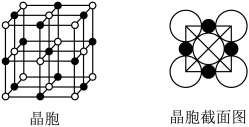
(1)写出F元素的电子排布式:
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是
(4)B、C、D、E的第一电离能由大到小的顺序是
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:晶胞中距离一个B+最近的B+有

您最近一年使用:0次



