(1)某温度时,在2L容器中A、B 两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
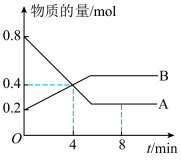
②反应开始至 4 min 时,B 的平均反应速率为
③平衡时,A 的物质的量为 0.2mol,B 的物质的量为 0.5mol,计算该反应的化学平衡常数
④4 min 时,反应是否达到平衡状态?
(2)下图表示在密闭容器中反应:
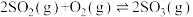
 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a 时改变的条件可能是
达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a 时改变的条件可能是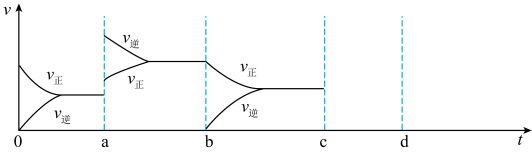
相似题推荐
CO(g)+2H2(g)
 CH3OH(1)△H=xkJ/mol
CH3OH(1)△H=xkJ/mol(1)已知常温下CH3OH(1)、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)
 CH3OH(g)△H<0,相关数据如图。
CH3OH(g)△H<0,相关数据如图。①该反应0~10min的平均速率υ(H2)
②10min时容器内CO的体积分数为
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=
(1) H2 和CO合成甲醇反应为:CO(g)+2H2(g)
 CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为
(2) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g)
 CH3OH(g) +H2O(g)+Q。
CH3OH(g) +H2O(g)+Q。①该反应的平衡常数表达式为K=
(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点


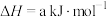 。回答下列问题:
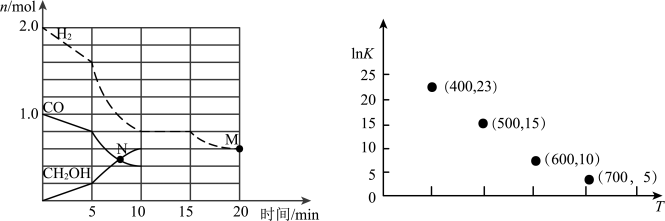
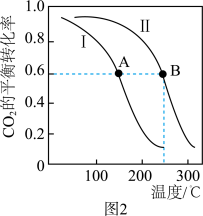
。回答下列问题:(1)CO的平衡转化率与温度、压强的关系如图所示。
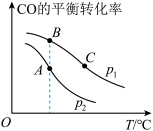
①a
②A、B、C三点的平衡常数KA、KB、KC的大小关系是
③下列叙述能说明上述反应已达到化学平衡状态的是
a.
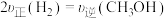
b.CH3OH的体积分数不再改变
c.混合气体的平均摩尔质量不再改变
d.同一时间内,消耗0.04mol H2,生成0.02mol CH3OH
(2)在温度为T的条件下,往一容积为2L的密闭容器中,充入0.3mol CO与0.4mol H2发生反应生成CH3OH,平衡时,测得CH3OH的物质的量为0.15mol。
①温度为T时的化学平衡常数K=
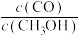
②若以不同比例投料,测得某时刻各物质的浓度:CO为0.1mol/L、H2为0.2mol/L、CH3OH为0.2mol/L,此时
 (正)
(正) (逆)(填“>”“<”或“=”)。
(逆)(填“>”“<”或“=”)。
(1)①一定温度下,在密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的
2NH3(g) ΔH<0。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率a1=
,则N2的转化率a1=②若向该容器中再加入3molH2,达到平衡状态时,N2的转化率为 a2,则a2
(2)对于反应 2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较 P1、P2 的大小关系:P1
②该反应的平衡常数 K 的表达式为
③下列措施中能够同时满足增大反应速率和提高NO转化率的是
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度 E.压缩容器体积
(3)已知同温同压下,下列反应的焓变和平衡常数分别表示为
①2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1 K1=a
2SO3(g) ΔH1=-197 kJ·mol-1 K1=a②2NO(g)+O2(g)
 2NO2(g) ΔH2=-144 kJ·mol-1 K2=b
2NO2(g) ΔH2=-144 kJ·mol-1 K2=b③NO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c
SO3(g)+NO(g) ΔH3=m kJ·mol-1 K3=c则m的数值为
(4)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是
CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入1molCO2和3molH2,在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是A.CO2、H2、CH3OH、H2O的浓度均不再变化 B.v生成(CH3OH)=v消耗(CO2)
C.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1 D.容器中混合气体的密度保持不变
E.H2的消耗速率与CH3OH的消耗速率之比为3∶1

(1)该反应的化学方程式为
(2)若X、Y、Z均为气体,反应恰好达到平衡时:
①用Z表示的平均反应速率为
②若此时将容器的体积缩小为原来的
 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为(3)在一密闭容器中发生反应
 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。
,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。①判断t1、t3、t4时刻分别改变的一个条件是:(填字母代号)
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.恒温恒容时充入氮气
t1时刻
②依据上述①中的结论,下列时间段中,氨的百分含量最高的是
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6。
(1)研究
 之间的转化具有重要意义,下图能表示
之间的转化具有重要意义,下图能表示 之间转化历程。
之间转化历程。
①写出图中所表示的总反应的热化学方程式
②上述总反应的决速步骤的活化能是
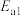 或
或 )。
)。(2)
 与
与 在高温下发生反应:
在高温下发生反应: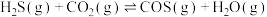
 。在610K时,将0.1mol
。在610K时,将0.1mol 与0.3mol
与0.3mol 充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
充入2.5L的空钢瓶中(体积不变),经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①能判断该反应达到化学平衡状态的依据是
A.容器中压强不变
B.容器中
 的物质的量分数不变
的物质的量分数不变C.

D.容器中混合气体的密度不变
②计算该反应的平衡常数K,写详细过程
③要增大该反应的平衡常数K,可采取的措施是
④上述反应达到平衡后,其他条件不变,减小压强,请在下图中画出正、逆反应速率随时间t变化的示意图

【推荐2】已知反应:2SO2(g)+O2(g)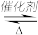 2SO3(g) ΔH=-Q kJ·mol-1。将2 molSO2和1 molO2通入体积为5 L的密闭容器中进行反应。反应在不同催化条件下进行,反应体系总压强随时间的变化如图所示。
2SO3(g) ΔH=-Q kJ·mol-1。将2 molSO2和1 molO2通入体积为5 L的密闭容器中进行反应。反应在不同催化条件下进行,反应体系总压强随时间的变化如图所示。
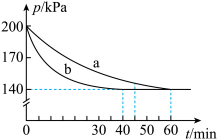
(1)由图可知,催化效率更佳的是曲线
A.SO2的转化率不再变化 B.体系温度不再变化
C.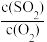 不再变化 D.混合气体平均分子量不再变化
不再变化 D.混合气体平均分子量不再变化
(2)观察曲线a,通过计算回答下列问题:
①60min内,用浓度变化表示O2的平均反应速率为
②平衡时,SO3的百分含量为
(3)反应2SO2(g)+O2(g)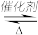 2SO3(g)中,V2O5是催化剂的活性成分,有人提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,如图所示:
2SO3(g)中,V2O5是催化剂的活性成分,有人提出:V2O5在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,如图所示:
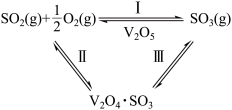
已知反应Ⅱ为SO2+V2O5 V2O4·SO3,则反应Ⅲ的化学方程式为
V2O4·SO3,则反应Ⅲ的化学方程式为
 ∆H>0。经过2min后达到平衡,容器的压强增加了20%。
∆H>0。经过2min后达到平衡,容器的压强增加了20%。(1)该反应自发进行的条件是
(2)2min内H2O的平均反应速率为
(3)2min平衡时
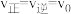 ,采取下列措施后,使
,采取下列措施后,使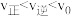 的是__________。
的是__________。| A.恒温恒容下,除去部分H2O | B.降低温度 |
| C.恒温恒容下,充入Ar | D.恒温恒压下,充入Ar |
(5)下列说法正确的是__________。
| A.增加碳单质,可以加快该反应速率 |
| B.2min时,H2O的转化率为20% |
| C.当混合气体的平均摩尔质量不再变化时,可以判断该反应达到了平衡 |
| D.平衡后向体系内补加0.4molH2O(g)和0.4molCO(g),反应向逆反应方向进行 |
(1)在催化剂的作用下,
 加氢合成乙烯的反应为
加氢合成乙烯的反应为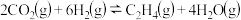
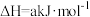 。压强为p时,按
。压强为p时,按 投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示:
投料,测得达到平衡状态时,容器内各物质浓度的关系随温度的变化曲线如图1所示: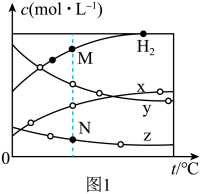
a
 浓度:
浓度: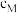
 。
。(2)恒容密闭容器中进行反应:
 ,在甲、乙两个容积均为1 L的密闭容器中通入的
,在甲、乙两个容积均为1 L的密闭容器中通入的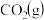 、
、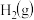 的物质的量如表:
的物质的量如表: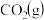 | 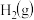 | |
| 甲容器 | 1 mol | 2 mol |
| 乙容器 | 2 mol | 4 mol |
 的平衡转化率曲线如图2所示。曲线Ⅰ对应的是
的平衡转化率曲线如图2所示。曲线Ⅰ对应的是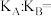
(1)溶于水的
 只有部分转化为
只有部分转化为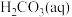 ,大部分以水合
,大部分以水合 的形式存在,水合
的形式存在,水合 可用
可用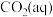 表示。已知25℃时,
表示。已知25℃时,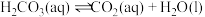 的平衡常数
的平衡常数 ,正反应的速率可表示为
,正反应的速率可表示为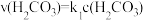 ,逆反应的速率可表示为
,逆反应的速率可表示为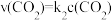 ,则
,则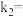
 的代数式表示)。
的代数式表示)。(2)25℃时,潮湿的石膏雕像表面会发生反应:
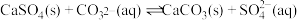 ,其平衡常数
,其平衡常数
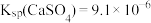 ,
,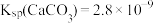 ]
](3)溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用。请从化学平衡的角度说明原因:
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1.,则6s时c(A)=
(3)1200℃时反应C(g)+D(g)⇌A(g)+B(g)的平衡常数的值为




