镍是一种硬而有延展性并具有铁磁性的金属,它能够高度磨光和抗腐蚀,用镍制造的不锈钢和各种合金钢被广泛地用于飞机、舰艇、雷达、导弹、陶瓷颜料、永磁材料、电子遥控等领域。回答下列问题:
(1)基态Ni原子的价层电子轨道表示式为_______ 。
(2)具有不对称结构的Schiff碱及其与过渡金属形成的配合物结构类似于生命体系的真实情况。有一种广泛用于生命体系中金属蛋白的模拟研究,其结构如图所示。_______ 。
(3)二氧化硒主要用于电解锰行业,其中一种制备方法为2NiSeO4 2NiSeO3+O2↑、NiSeO3
2NiSeO3+O2↑、NiSeO3 NiO+SeO2.下列分子或离子的VSEPR模型为平面三角形的是_______(填字母)。
NiO+SeO2.下列分子或离子的VSEPR模型为平面三角形的是_______(填字母)。
(4)草酸镍可用于制镍粉和镍的催化剂等,加热分解的化学方程式为NiC2O4 NiO+CO↑+CO2↑,属于非极性分子的产物是
NiO+CO↑+CO2↑,属于非极性分子的产物是____ ,等物质的量的CO与CO2分子中的π键数目之比为_____ 。
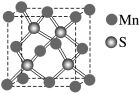
(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞结构如图所示。在MnS中,每个Mn原子周围距离相等且最近的Mn原子数为___ ;若MnS晶胞的边长为a pm,则MnS的密度表达式为_______ g·cm-3。
(1)基态Ni原子的价层电子轨道表示式为
(2)具有不对称结构的Schiff碱及其与过渡金属形成的配合物结构类似于生命体系的真实情况。有一种广泛用于生命体系中金属蛋白的模拟研究,其结构如图所示。

(3)二氧化硒主要用于电解锰行业,其中一种制备方法为2NiSeO4
 2NiSeO3+O2↑、NiSeO3
2NiSeO3+O2↑、NiSeO3 NiO+SeO2.下列分子或离子的VSEPR模型为平面三角形的是_______(填字母)。
NiO+SeO2.下列分子或离子的VSEPR模型为平面三角形的是_______(填字母)。A.SeO | B.SeO | C.NiO | D.SeO2 |
 NiO+CO↑+CO2↑,属于非极性分子的产物是
NiO+CO↑+CO2↑,属于非极性分子的产物是(5)阿拉班达石是一种属于立方晶系的硫锰矿,其晶胞结构如图所示。在MnS中,每个Mn原子周围距离相等且最近的Mn原子数为
更新时间:2024-04-15 09:17:58
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】元素周期表是化学中最重要的基本工具之一、它可以帮助化学家更好地研究元素,在科学研究和工业应用中有广泛应用。近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe—Sm—As—F—O组成的化合物。
(1)比较离子半径:F-___________ O2-(填“大于”“等于”或“小于”)。
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为___________ 。
(3)元素As与P同族,请举一事实说明非金属性P元素比As元素强___________ 。
(4)已知H3PO4为三元酸,其结构式为: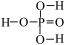 。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是
。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是___________ 。若将足量的KOH与次磷酸(H3PO2)充分反应,则化学方程式为___________ 。
(5)已知KH2PO4溶液呈酸性,可能的原因是___________ 。
(1)比较离子半径:F-
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为
(3)元素As与P同族,请举一事实说明非金属性P元素比As元素强
(4)已知H3PO4为三元酸,其结构式为:
 。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是
。次磷酸(H3PO2)中P的成键情况与H3PO4中的相同,则H3PO2的结构式是(5)已知KH2PO4溶液呈酸性,可能的原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质,X分子含有10个电子。它们之间的转化关系如图②所示。
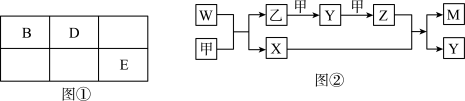
请回答下列问题:
(1)E元素价电子排布式为_____________ ,Z化学式为_____________ ;X分子的空间构型为_____________ 。
(2)E元素可分别与钙(Ca)、钛(Ti)元素形成化合物,其中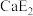 的熔点为782℃,沸点1600℃,
的熔点为782℃,沸点1600℃,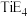 的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是
的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是_______________________________________ 。
(3)已知一种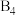 分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由
分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由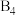 气态分子变成
气态分子变成 气态分子的热化学方程式为:
气态分子的热化学方程式为:_________________________ (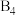 和
和 分子用化学式表示)。
分子用化学式表示)。
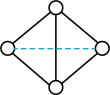
(4)将一定量的 、
、 的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中
的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中 为0.1mol,
为0.1mol, 为0.1mol。则该条件下
为0.1mol。则该条件下 的平衡转化率为
的平衡转化率为_____________ ,该温度下的平衡常数为_____________ 。

请回答下列问题:
(1)E元素价电子排布式为
(2)E元素可分别与钙(Ca)、钛(Ti)元素形成化合物,其中
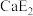 的熔点为782℃,沸点1600℃,
的熔点为782℃,沸点1600℃,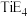 的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是
的熔点为−24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是(3)已知一种
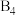 分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由
分子结构如图所示:断裂1mol B−B键吸收167kJ的热量,生成1mol B≡B放出942kJ热量。则由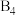 气态分子变成
气态分子变成 气态分子的热化学方程式为:
气态分子的热化学方程式为: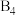 和
和 分子用化学式表示)。
分子用化学式表示)。
(4)将一定量的
 、
、 的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中
的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中 为0.1mol,
为0.1mol, 为0.1mol。则该条件下
为0.1mol。则该条件下 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】回答下列问题:
(1)基态Li原子的电子排布式为___________ ,其处于元素周期表中的___________ (填“s”、“d”、“ds”或“p”)区。
(2)现有4种元素的基态原子的电子排布式如下:①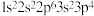 ;②
;② ;③
;③ ;④
;④ 。则下列比较中,正确的是___________。
。则下列比较中,正确的是___________。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②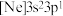 、③
、③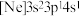 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(4)在第四周期元素中,未成对电子数最多的元素是___________ (写元素符号),它的价层电子的轨道表达式___________ 。
(5)Cu与Zn相比,第二电离能与第一电离能差值更大的是___________ (写元素符号),原因是___________ 。
(1)基态Li原子的电子排布式为
(2)现有4种元素的基态原子的电子排布式如下:①
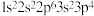 ;②
;② ;③
;③ ;④
;④ 。则下列比较中,正确的是___________。
。则下列比较中,正确的是___________。| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高化合价:④>③=②>① |
 、②
、②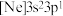 、③
、③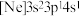 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(5)Cu与Zn相比,第二电离能与第一电离能差值更大的是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】Ⅰ.蒙脱石散对消化道内的病毒、病菌及其产生的毒素、气体等有极强的固定、抑制作用,常用于成人及儿童急性、慢性腹泻。蒙脱石散的有效成分可表示为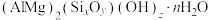 。
。
(1)基态
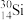 原子的核外电子排布式为
原子的核外电子排布式为(2)O、Mg、Al、Si四种元素的第一电离能从大到小的顺序为
(3)
 是无色透明液体,可以与N-甲基咪唑
是无色透明液体,可以与N-甲基咪唑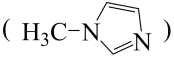 等物质反应。
等物质反应。①将用毛皮摩擦过的橡胶棒靠近 液流,液体流
液流,液体流
②一个N-甲基咪唑分子中含有
(4)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
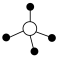 :其中●表示氧原子,中心◯表示硅原子,其俯视图为
:其中●表示氧原子,中心◯表示硅原子,其俯视图为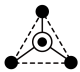 。
。① 晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在
晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在 之间插入O原子而形成。
之间插入O原子而形成。
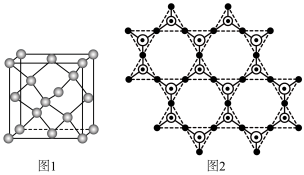
推测 晶胞中含有
晶胞中含有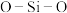 的键角为
的键角为
②蒙脱石散中的“(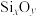 )”是一种大片层状的多硅酸根,其可能结构如图2所示,则
)”是一种大片层状的多硅酸根,其可能结构如图2所示,则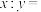
Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
(5)一个晶胞中有
 最近的Sn
最近的Sn 晶体中与Sn距离最近的As有
晶体中与Sn距离最近的As有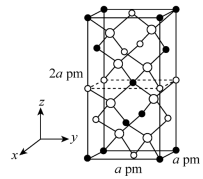
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】四种短周期元素的性质或结构信息如表所示。请根据信息回答下列问题:
(1)B元素在周期表中的位置为___________ ,写出A原子的电子排布式___________ ,D元素是___________ (写元素符号)。
(2)写出C单质与水反应的化学方程式___________ 。A与C形成的化合物溶于水后,溶液的pH___________ 7(填“大于”、“等于”或“小于”)。
(3)A、B、C、D原子半径由大到小的顺序是___________ ;A、B两元素第一电离能较大的是___________ (写元素符号),写出证明这一结论的一个实验事实___________ 。
| 元素 | 性质或结构信息 |
| A | 室温下单质呈粉末状固体,如热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| B | 单质常温、常压下是气体,能溶于水;原子的M层有1个未成对的p电子 |
| C | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰 |
| D | 原子最外层电子层上s电子数等于p电子数;单质为空间网状晶体,具有很高的熔、沸点 |
(2)写出C单质与水反应的化学方程式
(3)A、B、C、D原子半径由大到小的顺序是
您最近一年使用:0次
【推荐3】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍。M原子的M能层上有4个未成对电子。请完成下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:___ (用元素符号表示)。
(2)基态M原子的核外电子排布式为___ 。
(3)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为___ (用化学式表示)。
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:
(2)基态M原子的核外电子排布式为
(3)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
(1) 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为___________ ;Cu和Ni在元素周期表中的位置相邻,Ni在元素周期表中的位置是___________ 。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为___________ ; 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是___________ 。 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有___________ 。 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是___________ ,二是___________ 。
(3) 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子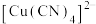 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为___________ ,与 互为等电子体的离子有
互为等电子体的离子有___________ 写出一种即可。
(4)已知ZnS的晶胞如图所示, 的配位数为
的配位数为___________ 。若晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为___________ (用含 、
、 的代数式表示)nm。
的代数式表示)nm。

(1)
 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体
 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是(3)
 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子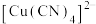 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为 互为等电子体的离子有
互为等电子体的离子有(4)已知ZnS的晶胞如图所示,
 的配位数为
的配位数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为 、
、 的代数式表示)nm。
的代数式表示)nm。
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】完成下列问题。
Ⅰ.短周期元素D、E、X、Y、Z原子序数逐渐增大,它们的最简单氢化物分子空间结构依次是正四面体形、三角锥形、正四面体形、V形、直线形。回答下列问题:
(1)HZO分子的中心原子价层电子对数的计算式为___________ ,该分子的空间结构为___________ 。
(2)Y的价层电子排布式为_________ ,Y的最高价氧化物的VSEPR模型为________ 。
(3)D、E的最简单氢化物的分子空间结构分别是正四面体形与三角锥形,这是因为_______ 。
a.两种分子的中心原子的价层电子对数不同
b.D、E的非金属性不同
c.E的氢化物分子中有一个孤电子对,而D的氢化物分子中没有
Ⅱ.有A、B、C、D、E、F六种主族元素,有关信息如下:
①短周期元素C原子的价电子排布式为ns2np2,E的单质可在空气中燃烧;
②如图是元素周期表中主族元素的一部分:
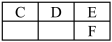
③A、B同周期,其电离能数据如下(单位:kJ·mol-1):
试回答下列问题:
(4)F原子的核外电子排布式为___________ 。
(5)C、D、E元素的电负性相对大小为___________ (用元素符号表示)。
(6)化合价是元素的一种性质,由A、B的电离能数据判断下列说法正确的是______ (填字母)。
a.A通常显+1价,B通常显+4价
b.B元素的第一电离能较小,其活泼性比A强
c.A、B的单质分别与盐酸反应放出等量氢气时,消耗单质的物质的量之比为3∶2
Ⅰ.短周期元素D、E、X、Y、Z原子序数逐渐增大,它们的最简单氢化物分子空间结构依次是正四面体形、三角锥形、正四面体形、V形、直线形。回答下列问题:
(1)HZO分子的中心原子价层电子对数的计算式为
(2)Y的价层电子排布式为
(3)D、E的最简单氢化物的分子空间结构分别是正四面体形与三角锥形,这是因为
a.两种分子的中心原子的价层电子对数不同
b.D、E的非金属性不同
c.E的氢化物分子中有一个孤电子对,而D的氢化物分子中没有
Ⅱ.有A、B、C、D、E、F六种主族元素,有关信息如下:
①短周期元素C原子的价电子排布式为ns2np2,E的单质可在空气中燃烧;
②如图是元素周期表中主族元素的一部分:

③A、B同周期,其电离能数据如下(单位:kJ·mol-1):
| I1 | I2 | I3 | I4 | |
| A | 738 | 1 451 | 7 733 | 10 540 |
| B | 578 | 1 817 | 2 745 | 11 575 |
(4)F原子的核外电子排布式为
(5)C、D、E元素的电负性相对大小为
(6)化合价是元素的一种性质,由A、B的电离能数据判断下列说法正确的是
a.A通常显+1价,B通常显+4价
b.B元素的第一电离能较小,其活泼性比A强
c.A、B的单质分别与盐酸反应放出等量氢气时,消耗单质的物质的量之比为3∶2
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】完成下列填空
(1)甲烷的结构特点
甲烷分子中5个原子不在同一平面上,而是形成_________ 的空间结构,碳原子位于正四面体的_________ ,4个氢原子位于4个_________ ,分子中的4个C—H的长度和强度_________ ,相互之间的夹角_________ ,分子结构示意图: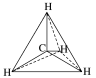 ,球棍模型为
,球棍模型为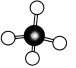 ,空间充填模型为
,空间充填模型为 。
。
(2)几种常见的烷烃
(3)烷烃结构的特点
①结构特点
a.单键:碳原子之间都以___________ 结合。
b.饱和:碳原子剩余价键全部跟___________ 结合。
c.结构:每个碳原子都与其他原子形成___________ 结构。
②链状烷烃通式:___________ 。
(1)甲烷的结构特点
甲烷分子中5个原子不在同一平面上,而是形成
 ,球棍模型为
,球棍模型为 ,空间充填模型为
,空间充填模型为 。
。(2)几种常见的烷烃
| 烷烃 | 乙烷 | 丙烷 | 正丁烷 |
| 分子式 | |||
| 结构式 | 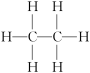 | 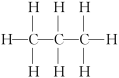 |  |
| 结构简式 |
①结构特点
a.单键:碳原子之间都以
b.饱和:碳原子剩余价键全部跟
c.结构:每个碳原子都与其他原子形成
②链状烷烃通式:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐1】含铜材料用途非常广泛,用超临界CO2/CH3CN及水作电解质,使用碳作载体的铜基催化剂可高效地将CO2还原为HCOOH.回答下列问题:
(1)铜、锌在元素周期表中为相邻元素,铜元素在元素周期表中的位置是________ ,基态锌原子的价层电子排布式为________ ,铜、锌元素中第一电离能较大的_________ (填元素符号)。
(2)CH3CN分子中σ键与π键的个数比为___________ ;CH3CN能与水混溶的原因为___________ (填一条即可)。
(3)配合物硫酸二乙二胺合铜(Ⅱ){[Cu(En)2]SO4,其中En是乙二胺(H2NCH2CH2NH2)的简写}是铜的一种重要化合物。乙二胺分子中碳原子的杂化方式为___________ 杂化,[Cu(En)2]2+中提供空轨道形成配位键的原子为___________ 。(填元素符号)。
(4)Cu的某氧化物晶胞结构如图。Cu的配位数为___________ ,该氧化物的化学式为___________ (Cu不在面上或棱上)。

(1)铜、锌在元素周期表中为相邻元素,铜元素在元素周期表中的位置是
(2)CH3CN分子中σ键与π键的个数比为
(3)配合物硫酸二乙二胺合铜(Ⅱ){[Cu(En)2]SO4,其中En是乙二胺(H2NCH2CH2NH2)的简写}是铜的一种重要化合物。乙二胺分子中碳原子的杂化方式为
(4)Cu的某氧化物晶胞结构如图。Cu的配位数为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】铁系元素是第一过渡系列第VIII族的三个相邻元素——Fe、Co、Ni,它们是人体必需的微量元素,也是现代工业和高新技术的重要材料。
(1)基态Ni的轨道中未成对电子有___________ 个。
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。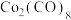 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测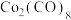 是
是___________ (填“极性”或“非极性”)分子;写出CO的结构式:___________ 。
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: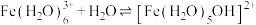 (配离子)
(配离子)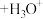 。则配离子中
。则配离子中 的配位数为
的配位数为___________ ,1mol该配离子所含σ键的数目为___________ (设 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。
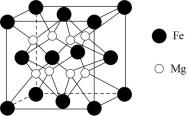
(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为___________ 。
(1)基态Ni的轨道中未成对电子有
(2)如图,Co的羰基配合物在工业上常用作有机物偶联和羰基引入的试制。
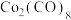 常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测
常温下为橙红色固体,不溶于水,易溶于有机溶剂。推测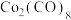 是
是
(3)已知,金属离子的电荷越高,极化能力越强,水解能力越强。故
 在酸性溶液中常发生水解:
在酸性溶液中常发生水解: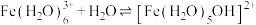 (配离子)
(配离子) 。则配离子中
。则配离子中 的配位数为
的配位数为 为阿伏伽德罗常数)。
为阿伏伽德罗常数)。(4)Fe-Mg是一种高效储氢材料,其晶胞结构如图。储氢时,H2分子在晶胞的体心和棱的中点位置,则晶体吸附H2后的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】金属元素及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)锰元素在周期表中的位置是___ ,基态锰原子的最外层电子排布式为___ 。
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是___ ,Cr(CO)6中σ键与π键的个数比为___ 。
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___ 。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+__ △[Fe(H2O)6]3+(填<”或“=”),理由___ 。
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。
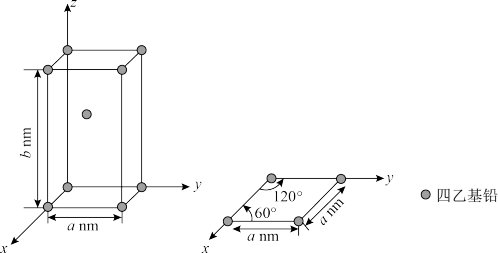
Pb(CH2CH3)4在晶体结构中的配位数是___ 。设阿伏加德罗常数为NAmol-1,Pb(CH2CH3)4的摩尔质量为Mg/mol,则Pb(CH2CH3)4晶体的密度是___ g/cm3(列出计算式即可)。
(1)锰元素在周期表中的位置是
(2)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是
(3)[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用∆表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]2+
(5)已知Pb(CH2CH3)4晶体的堆积方式如图。

Pb(CH2CH3)4在晶体结构中的配位数是
您最近一年使用:0次



